蛋白质组学在结肠癌研究中的进展
2023-02-20吴傲综述张丽军审校
吴傲 综述,张丽军 审校
上海市公共卫生临床中心,上海 201508
结肠癌是在全球男性和女性中占据高发病率和死亡率地位的癌症。在发达国家,由于早期检测和更加有效的治疗方式,结肠癌的死亡率显著降低,但在全世界癌症死亡率原因中,结肠癌仍排在第四位[1-4]。早期的诊断治疗对结肠癌患者十分重要,有研究表明,2009— 2011 年,超过19 100 人因结肠癌死亡,其中大部分是由晚期远端转移导致的[5-6]。因此,寻找快速有效的诊断和治疗方法十分必要。运用蛋白质组学技术发现癌症组织中的差异蛋白质,研究其在癌症中的功能及作用,从而用于癌症的诊断和治疗,已成为一种新的趋势[7]。本课题组前期构建了小鼠结肠癌模型,并通过液相色谱-质谱(liquid chromatograph-mass spectrometer,LC-MS)技术分析了小鼠结肠癌组织中的差异蛋白质,本文对其中乳腺癌相关耐药蛋白(ATP-binding cassette sub-family G member 2,ABCG2)和蛋白质二硫异构酶A2(protein disulfide-isomerase A2,PDIA2)两种蛋白质的表达及功能作一综述。
1 差异蛋白质的发现过程及方法
基于蛋白质组学技术发现差异蛋白质的方法为目前使用较多的方法之一。对结肠癌细胞、结肠癌组织、临床患者样本(血浆、粪便)等相关样本提取蛋白,通过高分辨率的质谱串联液相色谱仪,能够识别出较多差异蛋白质,从中挑选出与结肠癌相关的差异蛋白质,并进行后续验证,是目前寻找分子标志物的主要流程(图1,以结肠癌细胞为例[8])。
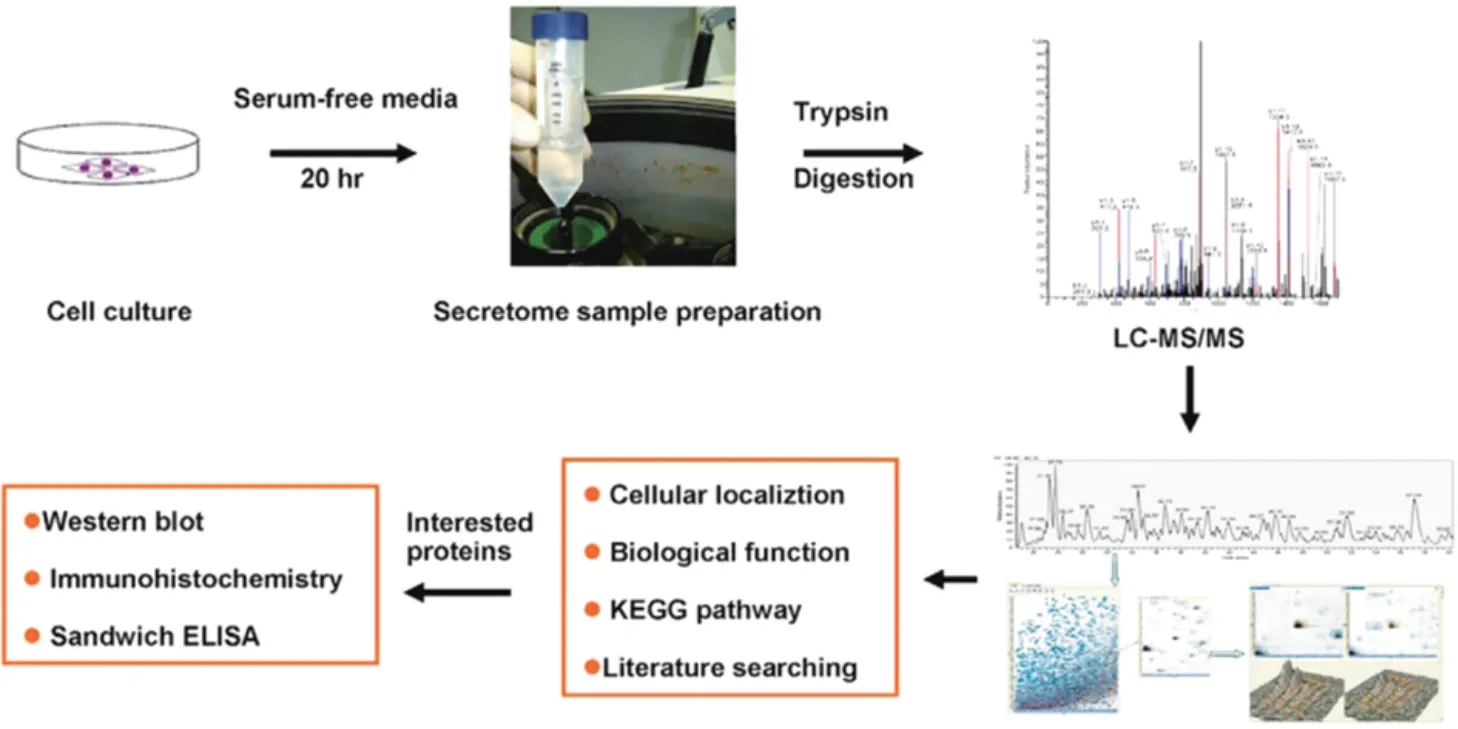
图1 结肠癌样本筛选差异蛋白质分析流程图Fig.1 Flow chart of analyzing and screening of differential proteins in colon cancer samples
提取结肠癌细胞SW480 及其淋巴结转移株SW620 细胞全细胞蛋白,对转移株和原始细胞株之间的差异蛋白质进行比较。在GHOSH 等[8]的研究中,共发现1 140 种特殊蛋白,其中转移株中有147种蛋白质相对原始株出现明显变化,有6 个差异蛋白质通过免疫印迹方法确证。对这些蛋白质进行了功能学分析,以作为结肠癌发生发展的生物标志。同时,也对细胞培养上清中的分泌蛋白进行了分析,从而达到区分不同细胞株差异蛋白质的目的。XUE等[9]对SW480和SW620细胞培养物上清进行酶解分析后,采用LC-MS 技术,共测出910 种蛋白质,其中145 种为差异蛋白质。同时发现三叶因子和生长分化因子15 在SW620 细胞中表达上调,对临床样本进行免疫组化分析显示,三叶因子与淋巴结转移相关。
在 APCmin/+鼠结肠癌模型中,ZHU 等[10]发现有27 种蛋白表达上调,但有25 种蛋白表达下调。研究还发现1个包含45种结肠癌中上调基因的共表达网,该共表达网与自身免疫和炎症有关,为结肠癌的进展提供了新的视角。RANGIAH 等[11]运用同位素标记的方法对鼠结肠癌细胞系和正常细胞系分泌蛋白质进行比较研究,分别发现了614 和929 种蛋白,其中418种蛋白是两个细胞系共有的。同时用APCmin/+鼠结肠癌模型和正常老鼠血浆进行验证,结果显示,仅有抑制蛋白1 和热休克蛋白8 在结肠癌细胞中表达是升高的,而在血浆中则是降低的,可以作为结肠癌在体内作用机理的一个新方向。
同样在临床患者组织样本中,通过两种不同的定量蛋白质组学技术,KIM 等[12]发现了 175 个2 倍差异以上的蛋白质,基因分析发现与细胞聚集及活动有关的蛋白质在预后差的患者中大幅增加,并且后续也通过免疫印迹试验及免疫组化对其中22 种蛋白质进行了确证,该发现为临床个体化治疗提供了准确可靠的信息以及潜在的帮助;BESSON 等[13]通过同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术标记结合基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time off-lightmassspectrometry,MALDI-TOF-MS)的方法,分析 28 例结肠癌患者组织以及邻近正常组织,分别对不同分期的患者组织中的蛋白质进行检测,发现555 种在结肠癌中有明显上调或者下调的蛋白。在分泌蛋白中,嗅质蛋白4(olfactomedin 4,OLFM4)在结肠癌病理Ⅰ期中明显上调,在结肠癌病理Ⅱ期中几乎达到最高含量(与正常组织相比),表明OLFM4 可能与参与细胞转化初始步骤的致癌基因相关。并且有文献指出,OLFM4在与富含亮氨酸重复序列G蛋白偶联受体5(leucinerich-repeat-containing G-protein-coupled receptor 5,Lgr5)关联的结肠癌干细胞中有表达[14-15],而Lgr5与肿瘤的恶性程度直接相关,这也进一步证明了OLFM4与结肠癌肿瘤的分期相关,或许可将OLFM4 作为结肠癌肿瘤分期的早期标志物。
有关结肠癌患者腹水中分泌的微泡(外泌体)目前研究较少。CHOI等[16]进行的蛋白质组学研究鉴定出846种外泌体蛋白,其中384种至少在两个患者腹水中鉴定出来,这些蛋白可能通过迁移、侵袭、免疫调节等影响肿瘤的进展,为研究微泡在肿瘤进展中的作用提供了帮助,也为结肠癌诊断提供了新的思路。
血浆是比较常用的用来进行蛋白质组学分析的样本。ZHANG 等[17]应用 iTRAQ 标记的蛋白质组学技术检测了10个结肠癌患者和正常人血浆中的蛋白,在结肠癌患者组发现9个上调蛋白和4个下调蛋白,为结肠癌诊断提供了潜在的生物标志物。
虽然粪便隐血试验是结肠癌筛查的首选方法,但其灵敏度和特异性均较低。近年来,有研究者运用液相色谱-质谱仪-多反应监测(liquid chromatographmass spectrometer-multiple reaction monitoring,LC-MSMRM)技术分析粪便中的蛋白质,取得了很好的成果。ANG等[18]从结肠癌患者粪便中发现了19 种蛋白,在结肠癌患者和健康人中进行定量分析发现,血红蛋白、过氧化物酶、丝束蛋白、细丝蛋白以及S100A9 仅在结肠癌患者中表达,可以作为诊断的参考。
2 ABCG2在结肠癌中的表达及功能
2.1 ABCG2 在结肠癌中的表达情况 ABCG2 是三磷酸腺苷结合蛋白中的一个亚族成员。对正常人各种组织的冰冻切片进行免疫组化分析以及对ABCG2的蛋白质和RNA 含量进行分析,发现ABCG2在正常组织如胰腺、肝脏、结肠、乳腺等中均有一定表达[19-20];在骨髓瘤患者的浆细胞中,ABCG2 的表达与正常浆细胞中的表达基本一致[21];对72 例非小细胞肺癌患者用福尔马林固定的组织样本进行免疫组化分析发现,有46%的患者组织样本中有ABCG2 表达[22];同样在淋巴癌[23]及结肠癌[24]中均有ABCG2 表达。ABCG2 在十二指肠、小肠、结肠、直肠、精囊、子宫内膜、阑尾中高度表达,在肾脏、睾丸、胎盘中中度表达,而在甲状腺、肾上腺、肺、等组织中低表达(https://www.proteinatlas.org)。ABCG2 在结肠癌中的表达情况始终不明确[25],在所有关于ABCG2 的研究中,约1/2 认为ABCG2 在结肠癌中表达是上调的,约1/2认为表达是下调的。
GUPTA等[26]对154个癌症患者的组织样本RNA进行定量分析,发现ABCG2 在结肠癌组织中的含量与正常组织中的含量相比,低了6 倍,推测这种降低可能与肿瘤的发生密切相关。同样在DIETRICH等[27]的研究中,通过分析21 位结肠癌肿瘤患者组织标本及4 只ApcMin 鼠肿瘤样本中的蛋白质含量及RNA含量,也发现与正常组织相比,ABCG2含量明显低于健康组织[患者样本:(28 ± 35)%,鼠样本:(58 ±34)%]。
然而,在 CANDEIL 等[28]的研究中,ABCG2 在结肠癌细胞HCT116中高表达,同样,在Caco-2细胞中,ABCG2 的表达增加了 5.2 倍[29]。SILVESTRIS 等[30]通过免疫组化方法发现在58 位结肠癌患者中,56%患者高表达ABCG2,且在细胞膜和细胞质均有较强染色,与临床病理特性密切相关,但ABCG2 并不影响这些患者的治疗效果。
2.2 ABCG2的主要功能及定位分析 通过uniprotkb网站查询,ABCG2 与肿瘤细胞耐药密切相关,同样与细胞中药物及外源性物质的转运相关。NAKAYAMA 等[31]的研究表明,ABCG2 在许多器官的顶膜上均有一定表达,如肾脏、肠道、肝脏等;ABCG2是尿酸盐的高容量转运载体,在人体尿酸盐生理平衡中起重要作用,且基因损伤会增加人血清中尿酸水平,引起痛风等症状。ZHANG 等[32]通过表达序列标签发现,在人类脑cDNA 库中,ABCG 家族有大量表达,尤其ABCG2 表达更多,这一现象在人类微血管内皮细胞中,通过测定蛋白质和RNA 水平,得到进一步验证;并且在4 例人大脑细胞中,通过免疫组化方法,也同样得到验证。同时,通过构建小鼠细胞模型,发现ABCG2 参与了将药物导出血脑屏障的过程。DESUZINGES-MANDON 等[33]的研究显示,一种经过验证的荧光素亚铁血红素类似物锌卟啉是由ABCG2 转运的,同样 ABCG2 的细胞外基质 3(extracellular loop3,ECL3)包含了1 个卟啉域,与亚铁血红素、氯高铁血红素均有相互作用,能够将这些物质转运给血清白蛋白。
关于ABCG2 定位的研究较多,有研究指出,野生型ABCG2在细胞表面,即细胞质膜中有表达[34-35],同样的结果在DIOP 等[36]的研究中也有报道。但在KOBUCHI等[37]的报道中指出,ABCG2不仅在质膜上有表达,在细胞器上也有表达,如在线粒体上,作为一种功能转运体,通过将原卟啉Ⅸ从线粒体转运至细胞液中来调节原卟啉Ⅸ的水平
3 ABCG2 在结肠癌中的表达与远端转移的相关性及其治疗
SILVESTRIS 等[30]分析了 58 例患者结肠癌组织样本中ABCG2 的含量,与远端转移无相关性;SPEIGL 等[38]的研究表明,ABCG2 含量与肿瘤分期呈正相关,即肿瘤分期第Ⅳ期的ABCG2 含量明显高于第Ⅲ期;且ABCG2 与转移性黑色素瘤患者的生存有一定关联。
PALSHOF 等[39]的研究表明,ABCG2可将抗肿瘤药物的生物活性成分从结肠癌细胞中转运出来,从而使癌细胞对肿瘤药物不敏感。虽然研究并未验证低表达ABCG2 的患者对肿瘤药物治疗效果更好,但发现低表达ABCG2的肿瘤患者的总生存率增加。
4 PDIA2蛋白在结肠癌中功能的研究
4.1 蛋白质二硫键异构酶(protein disulfide-isomerase,PDI)家族介绍 PDI家族是一类结构相关的酶[40],能够在内质网内腔中催化新合成蛋白质二硫键的产生、断裂和异构化,可作为分子伴侣,也可作为同一亚细胞单位正确折叠蛋白的质量控制系统。有关哺乳动物的PDI家族成员见表1。

表1 哺乳动物PDI家族成员Tab.1 Family members of mammalian PDI
有关PDI 的结构,在不少文献中均有报道[41-42]。FREEDMAN等[43]的研究中有详细介绍。其中,图2A为从同源序列中推导出的人PDI 家族的总框架。S 形状代表信号序列在生物合成中是断开的且并构成成熟蛋白;每个有颜色标记的板块(a、b、b′、a′)均代表成熟蛋白的1个区域,a和a′代表催化区域,b和b′代表非催化区域。图2B为成倍的硫氧还蛋白的PDI的三级结构。人PDIa由核磁共振测定,人PDIb由核磁共振和原型测定,大肠埃希菌硫氧还蛋白由X射线测定。
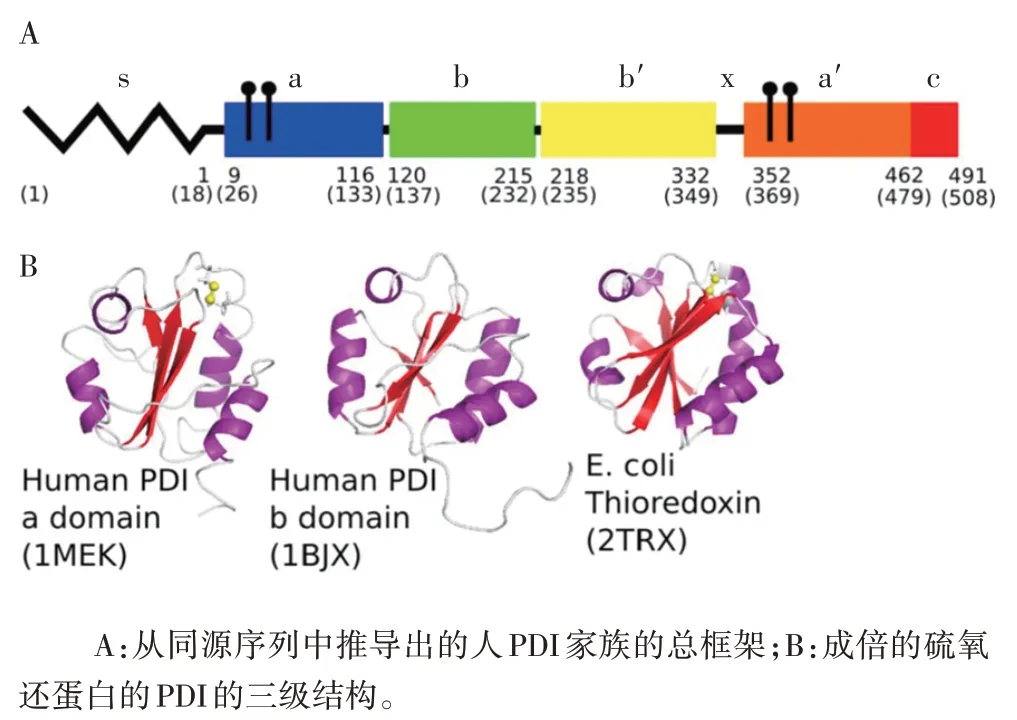
图2 PDI的基本结构Fig.2 Basic structure of PDI
PDI 主要有以下两部分功能[44]:①催化功能。PDI的氧化还原性能取决于CXXC 活性位点,当处于氧化状态时,二硫化物能够通过自身活性位点的减少来催化氧化;当处于还原状态时,基质二硫化物会减少,并且活性位点会处于氧化状态。②氧化还原调节。三肽的谷胱甘肽构成了主要的细胞氧化还原缓冲体系,中间有1 个半胱氨酸,使其能够以还原和氧化的形式存在。
4.2 PDIA2 的介绍及组织中的表达情况 PDIA2 是蛋白质PDI 家族的一员,主要在内质网中起作用[45]。PDIA2 是唯一能够催化异构酶反应的伴侣家族,与含半胱氨酸的蛋白质相互作用,并涉及哺乳动物线粒体蛋白质翻译后移位[46]。沉默PDIA2 后,会降低血管平滑肌细胞的迁移能力[47]。
PDIA2在人正常胰腺(腺泡细胞)中表达最高[48],同时,在鼠其他器官中,也有一定的表达,包括胃(胃主细胞)、盲肠、回肠(潘氏细胞)、附睾以及前列腺等[49]。尽管在人正常胰腺中有大量PDIA2表达,但在胰腺癌和胰腺癌细胞系中,PDIA2几乎不表达。PDIA2在人正常组织中几乎仅胰腺中有表达(https://www.proteinatlas.org)。
4.3 PDIA2 的功能及定位 PDIA2 主要定位于细胞内质网上(uniprotkb 网站)。作为细胞内雌激素结合蛋白质,可能涉及在胰腺中调节雌激素的细胞水平和生物学功能,在FU 等[50]的研究中很好地证明了这一点,即PDIA2 可作为一种高容量细胞内雌二醇结合蛋白,并且能够调控培养的哺乳动物细胞以及人类胰腺组织中雌二醇的浓度水平;可作为一种伴侣蛋白,抑制错误折叠蛋白质的聚集,同时具有异构酶和伴侣功能,并且在体外能够与新合成的多肽进行作用,是一种受氧化还原剂调控的分子伴侣。XU 等[51]指出,PDI 对人卵巢癌细胞的生存、增殖具有重要作用。WALKER 等[52]在有关 PDIA2 的研究中提出,PDIA2在抗原呈递方面也具有重要作用,参与自身免疫疾病的呈递。
5 差异蛋白质在结肠癌中的应用与展望
差异蛋白质不仅作为一种辅助诊断结肠癌的手段,在作为结肠癌治疗靶点上同样具有很好的前景。HOUDT 等[53]的研究表明,杆状病毒凋亡抑制重复含体6(baculoviral inhibitors of apoptosis repeat-containing 6,BIRC6)是一种凋亡蛋白,其会干扰奥沙利铂(抗肿瘤药物)对肿瘤干细胞的抵抗力,从而使肿瘤干细胞不被药物杀死。反向推测,如果抑制BIRC6 的表达,有可能从根本上抑制结肠癌肿瘤干细胞的表达,进而达到治疗结肠癌的目的。但临床样本具有复杂性多样性,对于结肠癌中差异蛋白质的功能研究,未来尚需加大力度,使其更广泛地应用于临床,以期能达到治疗和诊断的目的。
