人鸟苷酸结合蛋白5基因启动子核心调控区域的鉴定及其转录活性分析
2023-02-20叶婷杨康王田甜廖玉娇杜文倩黄敏蒋佩文李敏惠杨平
叶婷,杨康,王田甜,廖玉娇,杜文倩,黄敏,蒋佩文,李敏惠,杨平
1.成都医学院基础医学院,四川 成都 610500;2.成都医学院科研实验中心,四川 成都 610500;3.成都医学院生物科学与技术学院,四川 成都 610500;4.成都医学院药学院,四川 成都 610500;5.成都医学院教务处,四川 成都 610500
鸟苷酸结合蛋白(guanylate binding protein,GBP)是干扰素刺激基因(interferon stimulate gene,ISG)之一[1]。人 GBP 家族有 7 个成员:GBP1 ~ 7,具有多种生物学功能[2]。研究显示,GBP5 在病原菌引起的炎症反应中起重要作用[3]。感染后,机体可通过调控GBP5的表达,激活Caspase-1/11依赖的细胞炎性反应,启动抗感染固有免疫应答[4-6]。同时,GBP5 还具有广谱的抗病毒能力。甲型流感病毒感染宿主细胞后,机体可通过激活转录因子NF-κB调控GBP5启动子活性,诱导GBP5表达进而发挥其抗病毒生物学效应[7]。基因的表达是一个涵盖mRNA 转录、转录后修饰、蛋白质翻译等的复杂过程,而转录因子的调控机制是其中重要环节。目前关于GBP5启动子核心区域的定位和相关转录因子的调控机制尚不清晰。基于此,本研究通过构建人GBP5启动子荧光素酶报告基因质粒,确定GBP5启动子核心区域,筛选出可能调控其启动子活性的转录因子,为进一步探究GBP5的生物学功能奠定理论基础。
1 材料与方法
1.1 细胞及质粒 人胚胎肾上皮细胞293FT 购自美国 Invitrogen 公司;质粒 pGL3-Basic、pGL3-Control 及海肾荧光素酶质粒pRL-CMV 购自美国Promega 公司;pIRES2-EGFP质粒购自南京擎科生物公司。
1.2 主要试剂及仪器 胎牛血清、Opti-MEM 培养基、DMEM 基础培养基购自美国Gibco 公司;细胞基因组DNA 提取试剂盒、琼脂糖凝胶回收试剂盒、无内毒素小剂量质粒DNA 提取试剂盒、细胞总RNA 提取试剂盒购自天根生化科技(北京)有限公司;LipoD293 转染试剂购自美国SignaGen 公司;E.coliDH5α、氨苄青霉素购自生工生物工程(上海)股份有限公司;PCR 反转录及扩增试剂盒、DL15000 和DL2000 DNA marker、限制性内切酶HindⅢ、BamHⅠ和XhoⅠ以及T4 DNA Ligase 购自日本TaKaRa公司;双荧光素酶检测试剂盒购自美国Promega公司;蛋白提取裂解液、蛋白酶抑制剂、BCA 蛋白定量试剂盒购自中国Transgene公司;兔抗人GBP5、GAPDH单克隆抗体以及HRP 标记的山羊抗兔IgG 购自美国CST 公司;PVDF 膜、ECL 显色液购自美国 Millipore 公司;Universal ProbeLibrary Set(Human Probes#1-#90)(Cat.No.04683633001)购自美国Roche 公司;全波长酶标仪(VICTOR-X)购自美国PerkinEImer 公司;实时定量PCR仪(CFX96)购自美国Bio-Rad公司。
1.3 生物信息学分析 通过NCBI数据库查询获得人GBP5(ID:115362)基因组全长序列,选取GBP5基因5′UTR区域上游2 042 bp(-1 995 ~ +47 bp)启动子序列,利用在线网站JASPAR(http://jaspar.genereg.net/)对GBP5启动子区域转录因子结合位点进行预测分析。
1.4 目的基因序列的扩增 使用Primer 5 软件设计引物,引物序列见表1,引物由南京擎科生物科技有限公司合成。以提取的293FT细胞基因组DNA为模板,PCR 扩增获得不同长度的GBP5启动子片段和YY1基因序列,用凝胶回收试剂盒纯化扩增产物。

表1 GBP5不同启动子片段PCR引物信息Tab.1 Primer sequences of different promoter fragments of GBP5 for PCR
1.5 人GBP5启动子序列重组质粒的构建 利用限制性内切酶HindⅢ和XhoⅠ对pGL3-basic 质粒和目的序列进行双酶切,用T4 连接酶将目的序列与质粒DNA 按摩尔比5∶1 16 ℃连接过夜,连接产物转化E.coliDH5α,涂布含 100 μg/mL 氨苄青霉素的LB 琼脂平板,37 ℃恒温培养箱倒置培养16 h;挑取单个阳性克隆进行菌落PCR 鉴定。将鉴定正确的质粒转至含100 μg/mL 氨苄青霉素的液体培养基中,37 ℃摇菌12 h;用无内毒素质粒DNA 提取试剂盒提取质粒,并送至南京擎科生物科技有限公司测序。
1.6YY1过表达质粒的构建 用限制性内切酶HindⅢ和XhoⅠ双酶切目的基因和pIRES2-EGFP 质粒,用T4 DNA 连接酶连接构建YY1过表达质粒pIRES2-EGFP-YY1,方法同1.5项,经菌落PCR及双酶切鉴定后,提取质粒备用。
1.7 细胞转染 采用LipoD293 试剂,具体方法参考试剂说明书进行。提前18 ~24 h 将对数生长期的293FT 细胞接种至96孔板中,2×104个/孔,转染前30 ~60 min 更换新鲜的完全培养基。每组设3 个重复孔,按10∶1 的比例共转染各重组质粒和内参质粒pRL-CMV,同时设阳性对照和阴性对照组,分别以相同的转染比例共转染包含SV40 启动子和增强子序列的阳性对照质粒pGL3-Control 和缺少真核启动子和增强子序列的阴性对照质粒pGL3-Basic。
提前18 ~24 h 将对数生长期的293FT 细胞接种至12孔板中,3×105个/孔,转染前30 ~60 min更换为新鲜的完全培养基,用LipoD293 试剂将YY1过表达质粒转染至293FT 细胞,设转染pIRES2-EGFP 空载体质粒的对照组,48 h 后观察荧光表达情况。RT-qPCR 法检测过表达质粒转染后细胞中YY1mRNA转录水平。使用Roche 在线网站(roche.com)设计引物,引物序列见表2,引物由南京擎科生物科技有限公司合成。采用Taqman探针法,进行qPCR。反应条件为:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,共40 个循环。以GAPDH的表达水平为标准进行相对定量,采用2-ΔΔCq法分析YY1基因的表达倍数变化。

表2 RT-qPCR引物序列及探针号Tab.2 Primer sequences and probe numbers of RT-qPCR
1.8 双荧光素酶活性检测 将重组质粒和对照质粒(pGL3-Basic、pGL3-Control)分别与内参质粒 pRLCMV 共转染至293FT 细胞72 h 后,检测荧光素酶活性。用全波长酶标仪检测萤火虫萤光素酶(A560)和海肾萤光素酶(A465)活性,分析启动子不同截短片段的转录活性。
1.9 GBP5蛋白表达的检测 采用Western blot法。用LipoD293 试剂进行YY1过表达质粒转染,提前将对数生长期的293FT细胞接种至6孔板中,6×105个/孔,转染前30 ~60 min 更换为新鲜的完全培养基,转染48 h 后,提取细胞总蛋白,BCA 法定量蛋白质浓度。取等量(50 μg)蛋白,经12%SDS-PAGE分离后,转印至0.45 μm PVDF膜上,5%脱脂奶粉室温封闭2 h;加入兔抗人GBP5、GAPDH 单克隆抗体(均1∶1 000 稀释),4 ℃孵育过夜;TBST 洗涤3 次,加入HRP 标记的山羊抗兔IgG(1∶1 000 稀释),室温孵育2 h;ECL 试剂盒显色,化学发光仪曝光成像。使用Image Lab 软件进行图像分析,以GAPDH为内参。
1.10 统计学分析 所有试验均独立重复3 次,计量资料以均数 ± 标准差()表示,使用 GraphPad Prism 7 软件进行统计学分析,多组与对照组的比较采用Dunnett检验和One-way ANOVA检验,两组间比较采用非配对t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1GBP5启动子区域转录因子结合位点预测分析通过 NCBI 数据库查询获得人GBP5(ID:115362)基因组全长序列,选取GBP5基因5′UTR 区域上游2 042 bp(-1 995 ~ +47 bp)启动子序列;JASPAR 在线软件预测结果显示,GBP5启动子区域有多个转录因子结合位点,其中YY1、STAT1和FOXP3的预测评分排序靠前(系统评分值均大于5),见表3。

表3 JASPAR软件转录因子预测结果Tab.3 Prediction result of transcription factor by JASPAR
2.2GBP5启动子各截短片段重组质粒的鉴定GBP5启动子不同截短片段PCR 产物经1.5%琼脂糖凝胶电泳分析,分别可见2 042、1 671、1 180、567和166 bp的特异性条带,大小与预期相符,见图1。双酶切重组质粒质粒 pGL3-GBP5-11、pGL3-GBP5-21、pGL3-GBP5-31、pGL3-GBP5-41、pGL3-GBP5-51后,经1.5%琼脂糖凝胶电泳分析,各亚克隆片段大小正确,见图2。鉴定正确的质粒测序结果经BLAST 比对,插入片段与设计序列同源性达100%。以上结果表明重组质粒构建正确。
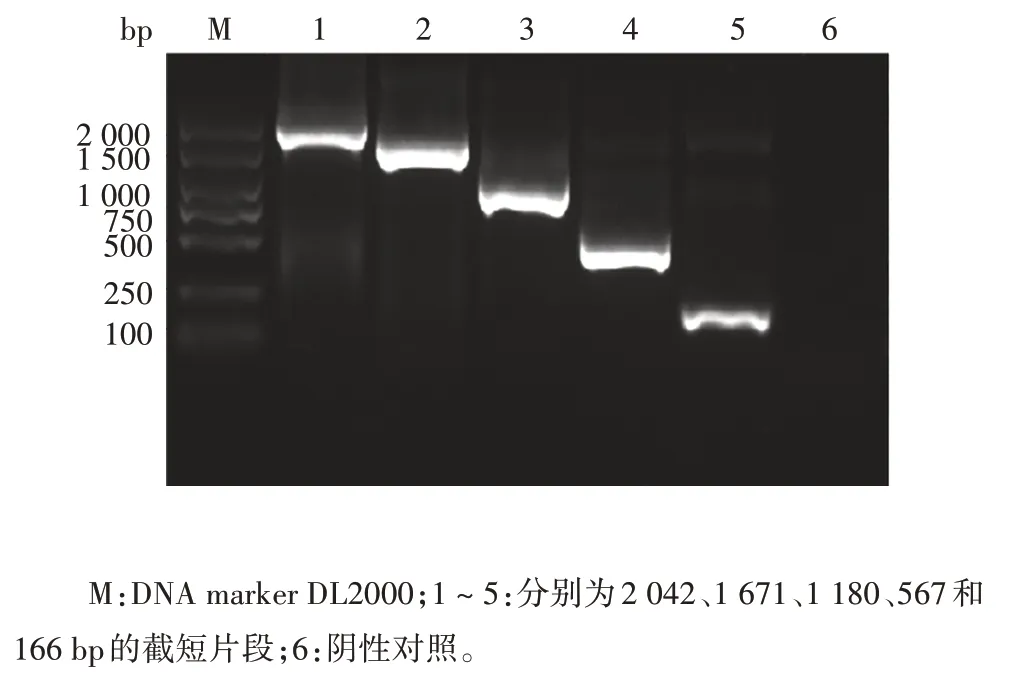
图1 GBP5启动子截短片段PCR产物电泳图Fig.1 Electrophoretic profile of PCR products of GBP5 promoter truncated fragments
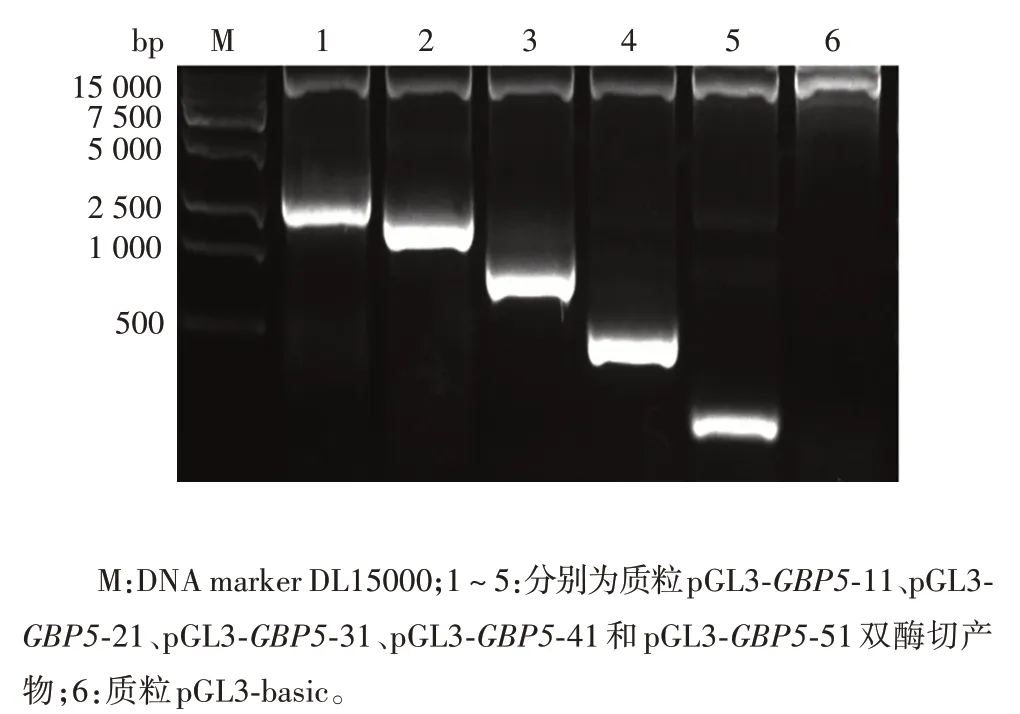
图2 GBP5 启动子各片段重组质粒的双酶切(HindⅢ/XhoⅠ)鉴定Fig.2 Restriction map of recombinant plasmids of GBP5 promoter fragments(HindⅢ/XhoⅠ)
2.3GBP5启动子活性双荧光素酶活性 结果显示,GBP5启动子各质粒的荧光素酶活性均高于阴性对照组,均具有启动子活性。相比阴性对照组,质粒pGL3-GBP5-21启动子活性最高,而pGL3-GBP5-41显著降低,差异均有统计学意义(t分别为67.59和27.84,P均<0.05),见图3。表明GBP5基因核心启动子区域为 5′UTR 上游-1 623 ~ -520 bp,当截短GBP5启动子-1 061 ~ -520 bp 区域(转录因子YY1 结合位点)后,启动子活性明显降低,提示在该区域的YY1结合位点可能会显著影响GBP5启动子的活性。

图3 GBP5启动子双荧光素酶活性检测Fig.3 Double luciferase activity assay of GBP5 promoter
2.4 转录因子YY1对GBP5启动子活性的影响
2.4.1YY1过表达质粒的鉴定 PCR 扩增产物经1.5%琼脂糖凝胶电泳分析,可见1 245 bp 的特异性条带,大小与预期相符,见图4。质粒pIRES2-EGFPYY1的双酶切产物经1%琼脂糖凝胶电泳分析,可见1 245 bp 的目的基因片段和5 260 bp 的载体片段,大小均与预期相符,见图5。

图4 YY1的CDS序列PCR产物电泳图Fig.4 Electrophoretic profile of PCR product of YY1 CDS sequence

图5 质粒pIRES2-EGFP-YY1的双酶切(HindⅢ/XhoⅠ)鉴定Fig.5 Restriction map of plasmid pIRES2-EGFP-YY1(HindⅢ/XhoⅠ)
2.4.2YY1过表达质粒的鉴定 RT-qPCR 结果显示,与对照组相比,质粒pIRES2-EGFP-YY1转染组细胞YY1基因mRNA转录水平升高约20 000倍,差异有统计学意义(t=69.39,df=2,P< 0.001),表明质粒成功转染293FT 细胞并过表达目的基因。倒置荧光显微镜下观察可见明显荧光表达,见图6。表明YY1瞬时过表达质粒构建成功。

图6 质粒pIRES2-EGFP-YY1 与pIRES2-EGFP 分别转染293FT细胞48 h的荧光显微镜观察(标尺:100 μm)Fig.6 Fluorescence microscopy of plasmids pIRES2-EGFPYY1 and pIRES2-EGFP 48 h after transfection to 293FT cells respectively(Scale bar:100 μm)
2.4.3YY1过表达质粒对GBP5启动子活性及其蛋白表达的影响 双荧光素酶活性分析结果显示,与pGL3-GBP5-21组比较,过表达YY1可显著激活GBP5启动子活性,差异有统计学意义(t= 19.95,df= 2,P< 0.001),见图7。Western blot 分析显示,过表达YY1可上调GBP5 蛋白表达水平,见图8。表明YY1是调控GBP5表达的潜在转录因子。
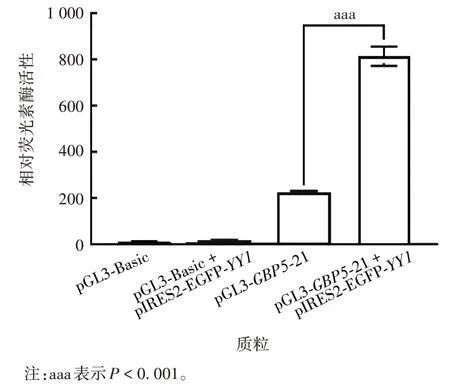
图7 双荧光素酶活性分析过表达YY1对GBP5启动子活性的影响Fig.7 Effect of YY1 overexpression on GBP5 promoter activity analyzed by double luciferase activity

图8 Western blot 分析质粒pIRES2-EGFP-YY1 转染293FT细胞48 h GBP5蛋白表达水平Fig.8 Western blotting of GBP5 protein expression 48 h after pIRES2-EGFP-YY1 transfection to 293FT cells
3 讨论
GBP5 作为病原体感染激活的相关效应分子,在机体免疫应答中发挥重要的生物学作用[8]。研究报道,在弗朗西斯菌感染机体前期,GBP5 通过调控黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)炎性小体的组装,增强宿主对病原菌的抵抗能力[9]。GBP5是干扰素诱导巨噬细胞活化的标志物之一[10],同时激活表达的GBP5也可参与调控干扰素通路、促进ISG的表达,从而抑制病毒的复制[11]。
GBP5基因启动子功能和特性的确定对进一步深入研究GBP5 的生物学功能具有重要意义。启动子作为基因表达的“开关”,具有调控基因表达时间及强度的功能,而转录因子则是控制“开关”的把手,调控启动子活性。YY1 属于GLI-Kruppel 锌指蛋白家族,是一种多功能转录因子,具有双重转录活性,参与调控多种基因的转录表达[12-15]。由于所处环境和结合蛋白因子的不同,YY1 在调节基因表达时既可作为抑制因子,也可作为激活因子[16-19]。已有研究发现,表皮生长因子受体(epidermal growth factor receptor,EGFR)介导Src-p38 MAPK-YY1信号通路的活化,诱导胶质瘤细胞中GBP1 的表达,促进胶质瘤细胞生长[20]。目前有关 YY1 结合GBP5启动子调控GBP5 表达的生物学活性尚未见报道。本研究通过构建GBP5启动子不同截短片段的荧光素酶报告基因重组质粒,发现GBP5核心启动子区域位于5′UTR上游-1 623 ~-520 bp,同时过表达YY1后,重组质粒荧光素酶活性明显增强,表明YY1能影响GBP5的启动子活性,提示YY1是调控GBP5表达的潜在转录因子。本研究为深入阐明GBP5基因的表达调控机制奠定了基础,也为明确GBP5的生物学功能提供了实验依据,后续将进一步探究YY1调控GBP5表达的相关信号通路。
