短暂前脑缺血再灌注对大鼠海马中脑源性神经营养因子启动子与组蛋白去乙酰化酶3结合的影响及其作用机制
2023-02-20张倩严德萍史晋朝钟锦周阳赵欣张宇李建国
张倩,严德萍,史晋朝,钟锦,周阳,赵欣,张宇,李建国
山西医科大学生理学系细胞生理学教育部重点实验室,山西 太原 030001
脑卒中包括缺血性和出血性两种,大部分患者为缺血性脑卒中[1]。脑卒中易致残、致死,大量致残患者在学习记忆、语言行动等方面出现明显障碍[2]。大脑中的海马区域与学习记忆显著相关,海马CA1区神经元对缺血较敏感,CA3区和DG区神经元对缺血不敏感[3]。海马不同区域受到相同刺激发生不同反应的现象与脑内神经元损伤相关,但作用机制尚未明确[4]。
损伤刺激可激活脑内多种保护机制,其中,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在大脑内源性保护方面具有重要作用[5]。不同BDNF启动子能够控制BDNF的相关表达,如Bdnfp1、Bdnf-p2、Bdnf-p4和Bdnf-p6[6],同时,BDNF蛋白的表达还受表观遗传修饰的调控,其中组蛋白乙酰化修饰是较重要的表观遗传调节方式之一[7]。组蛋白去乙酰化酶(histone deacetylases,HDACs)可通过改变组蛋白乙酰化程度调控基因的转录水平,从而影响蛋白表达[8]。HDACs种类较多,根据结构功能和存在部位可分为4类,共18种亚型,其中HDAC3属于Ⅰ类,在染色质重塑过程中发挥重要作用,通过表观遗传调控作用参与多种疾病的病理生理过程[9]。
长链非编码RNAs(longnon-codingRNAs,lncRNAs)是一种非编码RNA,长度多于200个核苷酸[10],能够识别基因结合位点,经过募集组蛋白修饰酶进一步调节基因转录[11]。反义脑源性神经营养因子(BDNF antisense,BDNF-AS)是从BDNF反义基因转录而来的一种lncRNAs,可能在启动子与HDAC3结合中发挥一定作用,相关机制尚未明确[12]。本研究通过建立短暂前脑缺血再灌注(ischemia-reperfusion,I/R)大鼠模型,探讨I/R对大鼠海马中BDNF启动子Bdnf-p1、Bdnf-p2、Bdnf-p4和Bdnf-p6与HDAC3结合水平的影响及其可能的作用机制。
1 材料及方法
1.1 主要试剂及仪器 尼氏染色试剂盒购自北京索莱宝科技有限公司;O.C.T冰冻组织切片包埋剂购自美国SAKURA公司;染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)组织样本试剂盒及HDAC3兔多克隆抗体(85057)购自美国Cell Signaling Technology公司;动物组织总RNA提取试剂盒购自天根生化科技(北京)有限公司;荧光定量PCR扩增及反转录试剂盒购自日本TaKaRa公司;紫外分光光度计购自德国艾本德公司;Olympus荧光显微镜购自日本奥林巴斯公司。
1.2 实验动物SPF级SD大鼠,雄性,150只,10周龄,体质量260~280 g,购自斯贝福(北京)生物技术有限公司,动物许可证号为:SCXK(京)2019-0010。本实验对大鼠的所有处理均以科研为目的进行养殖和使用,且按照动物伦理相关规定进行。实验前将大鼠适应性饲养约1周,自由摄水饮食,术前禁食禁水8 h。
1.3 动物分组及处理 将SD大鼠随机分为Sham组(35只)和I/R组(65只)。经大鼠腹腔注射4%水合氯醛麻醉后,固定头部,于双耳连线中点处切开约1.5 cm,拨开肌层,分离翼状孔。I/R组采用Pulsinelli四血管夹闭法建立I/R 模型,电凝双侧翼状孔下走行的双侧椎动脉,分离双侧颈总动脉,次日夹闭双侧颈总动脉,15 min 后恢复脑内血流灌注。若大鼠在1 min内昏迷,翻正反射消失,眼球苍白,瞳孔散大,呼吸加深加快,表明建模成功。Sham组大鼠除不进行椎动脉电凝和双侧颈总动脉夹闭外,其他操作同I/R组。
1.4 I/R 对大鼠海马中神经元存活影响的检测 采用尼氏染色法。建模48 h后,经大鼠腹腔注射4%水合氯醛麻醉,剖开心脏,经升主动脉灌注4 ℃生理盐水300 mL 冲洗心脏,再注入4%多聚甲醛约400 mL,先快后慢,待大鼠逐渐僵硬且肺部发白后,立刻处死,取全脑组织,置4%多聚甲醛中浸泡固定1 d;用30%蔗糖脱水,进行包埋、切片,经尼氏染色试剂盒染色,于荧光显微镜下观察并拍照。
1.5 I/R对大鼠海马中BDNF启动子与HDAC3结合水平影响的检测 采用ChIP 法。根据NCBI Gen-Bank 数据库中登录的Bdnf基因序列(24225),应用Primer 5 软件设计引物,Bdnf-p1 F:5′-TCATGGTGTCCGTTCCAAAA-3′,R:5′-AGAGGAGCCGAGGATGAATG-3′;Bdnf-p2 F:5′-GTGAGTAGCAATAAACCCTGCATT-3′,R:5′-TGCTGTTCTTTGGCGTGTG-3′;Bdnf-p4 F:5′-AACCACCAACTGTCTGGGAAA-3′,R:5′-CCTCAACTTCTGTGGGTCTGTG-3′;Bdnf-p6 F:5′-GGTGCAGGGGAATTAGGGATA-3′,R:5′-GGCTGCTTAAAGGGGACGA-3′。引物由宝生物工程(大连)有限公司合成。采用ChIP 组织样本试剂盒提取两组大鼠脑组织DNA,以其为模板扩增Bdnf-p1、Bdnf-p2、Bdnfp4 和Bdnf-p6 基因。PCR 反应条件为:95 ℃预变性30 s;95 ℃变性 5 s,60 ℃退火 30 s,共 40 个循环;融解(95 ℃ 5 s,60 ℃ 1 min,1 个循环),降温(50 ℃ 30 s,1个循环)。以大鼠海马各区经ChIP 后,提取的2%全染色质样本(2% Input 样本)为参照,按下式计算HDAC3 的 2% Input 富集效率,即为Bdnf启动子与HDAC3的结合水平。
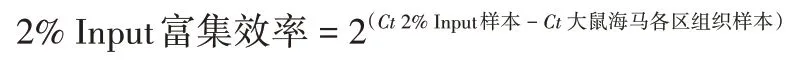
1.6 I/R 对大鼠海马中BDNF-AS 表达水平影响的检测 采用qPCR 法。根据NCBI GenBank 数据库中登录的Bdnf基因(24255),应用Primer 5 软件设计引物,Bdnf-AS F:5′-GTTCTTCGGGAATGTGGCTAA-3′,R:5′-TGCTGTCTCTGTGGTCTGA-3′;GAPDHF:5′-ATGGCTACAGCAACAGGGT-3′,R:5′-TTATGGGGTCTGGGATGG-3′。引物由上海派森诺生物科技股份有限公司合成。用动物组织总RNA 提取试剂盒提取两组大鼠脑组织总RNA,反转录合成为cDNA,以其为模板进行PCR 扩增。PCR 反应条件同1.5项。以GAPDH为内参,2-△△Ct法计算 BDNF-AS 相对表达量。
1.7 统计学分析 应用GraphPad prism 7 软件制作图片,SPSS 24.0 软件进行统计学分析,试验数据均采用均数±标准差()表示,组间两两比较采用非配对t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 I/R 对大鼠海马中神经元存活的影响 与Sham 组比较,I/R 组大鼠海马 CA1 区神经元数目大幅减少,CA3 区和DG 区神经元数目变化较小,见图1。
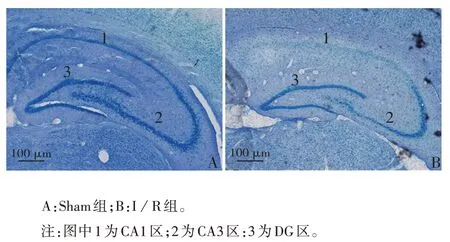
图1 大鼠海马区神经元的存活情况(尼氏染色)Fig.1 Survival of neurons in hippocampus of rats(Nissl staining)
2.2 I/R对大鼠海马中BDNF启动子与HDAC3结合水平的影响 与Sham 组比较,I/R 组大鼠海马CA1区中Bdnf-p1 和Bdnf-p2 与HDAC3 结合水平明显降低(t分别为2.575 和 2.241,P均 < 0.05),Bdnf-p4和Bdnf-p6 与HDAC3 结合水平差异无统计学意义(t分别为1.033 和0.348,P均 > 0.05);CA3 区中Bdnfp1 和Bdnf-p2 与 HDAC3 结合水平明显增加(t分别为12.600 和 3.191,P分别 < 0.001 和 < 0.05),Bdnf-p6与HDAC3 结合水平明显降低(t=4.029,P <0.05),Bdnf-p4 与HDAC3 结合水平差异无统计学意义(t=0.175,P> 0.05);DG 区中Bdnf-p1、Bdnf-p2、Bdnf-p4和Bdnf-p6 与HDAC3 结合水平差异均无统计学意义(t分别为0.684、1.316、1.687、0.630,P均 > 0.05)。见图2。

图2 大鼠海马区HDAC3与BDNF启动子的结合水平Fig.2 Binding levels of HDAC3 to BDNF promoters in hippocampus of rats
2.3 I/R 对大鼠海马中BDNF-AS 表达水平的影响与Sham组比较,I/R组大鼠海马CA1区中BDNF-AS的表达水平明显降低(t= 2.560,P< 0.05),在CA3及DG 区的表达水平均明显升高(t分别为3.543 和3.637,P均 < 0.01),见图3。
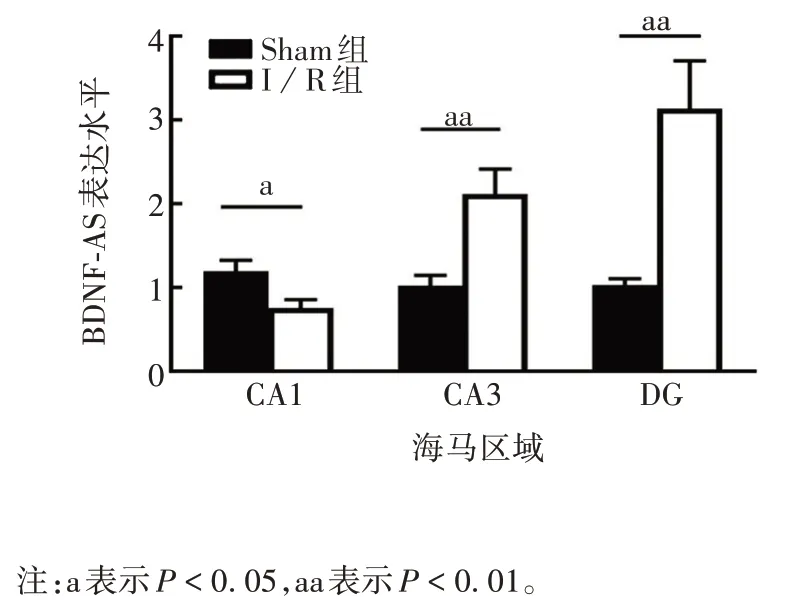
图3 大鼠海马区BDNF-AS的表达水平Fig.3 Expression level of BDNF-AS in hippocampus of rats
3 讨论
目前,虽然在预防和支持性治疗脑卒中方面已取得了一定进展,但还不能避免造成大脑的缺血性细胞死亡。缺血性损伤刺激会激活脑内多种自我保护机制,如BDNF 表达增加、抗炎、抗氧化和抗兴奋毒性等[13]。有研究表明,脑缺血后,BDNF 在缺血较敏感的海马CAl 区表达水平降低,在缺血耐受的海马CA3和DG区则维持高水平[14]。
Bdnf由 1 个 3′编码的外显子和 9 个 5′非编码的外显子组成,不同启动子通过调控不同Bdnf转录本影响BDNF 蛋白的翻译效能,进而调控BDNF 蛋白的表达[15],其中,Bdnf转录本Ⅰ、Ⅱ、Ⅲ和Ⅳ在啮齿类和人之间高度保守,因此,本研究选取Bdnf转录本Ⅰ、Ⅱ、Ⅲ和Ⅳ相应的启动子Bdnf-p1、Bdnf-p2、Bdnf-p4 和Bdnfp6 探讨Bdnf转录本表达对表观遗传调控的作用机制,如组蛋白乙酰化、磷酸化、泛素化、甲基化等[16],其中,组蛋白的乙酰化修饰是通过组蛋白乙酰转移酶(histone acetyltransferases,HATs)和HDACs共同作用的结果。不同HDACs 在海马区和神经元中表达水平不同,如包括HDAC3 在内的Ⅰ类、类HDACs 在海马区均呈高表达[17]。本研究发现,I/R 可影响BDNF 不同启动子与HDAC3 的结合水平,前期研究也发现,BDNF不同启动子组蛋白乙酰化水平在I/R后会发生不同改变[14],两项研究的结论相符。
LncRNAs属于非编码RNAs,通过RNA聚合酶Ⅱ转录而来,通常由5′端帽状、剪接和3′端聚腺苷酸构成[18]。lncRNAs 不仅是非编码 RNA 的重要组成部分,也是真核生物细胞核中重要的调控因子,可调节不同的基因表达[19]。lncRNAs 根据调节方式可分为3类:转录型、表观遗传型和转录后型。其中,表观遗传型是通过诱导DNA 和组蛋白甲基化、组蛋白乙酰化和泛素化来影响表观遗传修饰[20]。lncRNAs 在转录位点募集相关的染色质修饰因子,可能通过区域、位点甚至等位基因的特异性方式来控制整个染色体的转录状态,这些复合物能形成一个局部染色质环境,可促进或抑制其他调节因子的组装[21]。BDNF-AS可调控BDNF 表达,促使相关神经元突起生长和保持神经元存活[22],BDNF-AS在神经元兴奋作用下,利用表观遗传机制调节BDNF 表达,参与有关突触可塑性的形成。
本研究发现,I/R 大鼠BDNF 不同启动子与HDAC3 的结合水平与BDNF-AS 表达相关。与Sham组比较,I/R 组大鼠海马中,BDNF-AS 在 CA1 区表达明显下降(P< 0.05),可通过HDAC3在Bdnf-p1和Bdnf-p2 的结合减少使CA1 区神经元大量死亡;而BDNF-AS 在CD3 区表达明显上升(P< 0.01),可通过HDAC3 在Bdnf-p1 和Bdnf-p2 的结合增加使CA3区神经元存活。在DG区,I/R组大鼠海马中BDNFAS表达明显升高(P <0.01),与Bdnf-p1、Bdnf-p2、Bdnfp4、Bdnf-p6 和 HDAC3 的结合无关,可能与 BDNF-AS募集其他表观遗传修饰酶并调控BDNF 表达相关,具体作用机制需进一步深入研究。因此推测,在BDNF-AS 的介导下,乙酰化修饰酶的动态平衡发生改变,使BDNF 启动子区相关组蛋白乙酰化修饰发生不同改变,从而对海马多个脑区的神经元存活产生不同影响。
综上所述,I/R大鼠海马CA1、CA3和DG区Bdnf启动子与HDAC3 的结合水平存在差异,可能与BDNF-AS表达不同相关。本研究为缺血损伤后神经元BDNF 表达调控机制的研究奠定了基础,也为脑卒中的临床治疗提供了新的思路。
