热量限制对小鼠心肌缺血/再灌注损伤的影响及其作用机制
2023-02-20王文丽贺忠梅吉晔楠孙思雨杨瑞瑞燕子曹济民
王文丽,贺忠梅,吉晔楠,孙思雨,杨瑞瑞,燕子,曹济民
山西医科大学生理学系细胞生理学教育部重点实验室,山西 太原 030001
心血管疾病位居全球人类死因的首位,且发病率及死亡率呈逐年上升趋势[1-2]。目前,对急性缺血性心脏病患者的主要治疗方式为缺血区域再灌注,这是提高救治成功率、改善患者生活质量的重要措施[3]。研究表明,单纯再灌注疗法可能加重已有的缺血性心肌损伤,甚至威胁患者生命,即心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)[4]。MI/RI 的发生机制与氧自由基生成过多,中性粒细胞浸润,线粒体结构与功能受损,心肌细胞坏死、凋亡及焦亡等密切相关[5-6]。
细胞焦亡(pyroptosis)是由gasdermin 蛋白家族D(gasdermin D,GSDMD)介导的一种新型程序性细胞死亡方式,表现为Nod 样蛋白受体3(nod-like receptor protein 3,NLRP3)炎性小体活化、caspase-1 激活及细胞膜孔形成,胞浆内IL-1β和IL-18释放,从而放大炎症级联反应[7]。细胞焦亡与细胞凋亡有相似特征,如DNA 损伤、核固缩和caspase 依赖性,但细胞焦亡有其特殊的形态学特征,如焦亡细胞会发生染色质浓缩和DNA 断裂,但细胞核仍保持完整[8];焦亡过程产生的DNA 损伤不依赖caspase 活化的DNA 酶(caspase activated DNase,CAD)[9];细胞焦亡时炎症诱导的孔隙形成导致细胞肿胀和胞膜渗透溶解,而凋亡的细胞膜是完整的[8]。有研究发现,细胞焦亡和相关炎症小体激活在动脉粥样硬化、心肌梗死、MI/RI等心血管疾病进展中发挥重要作用[10-11]。热量限制(caloric restriction,CR)是一种抗衰老、抗肥胖、推迟或减少老龄相关疾病的饮食调控方法。研究发现,CR 对心血管系统具有多重保护作用,可防止血管发生动脉粥样硬化,提高心肌耐受性,延缓心脏衰老[12]。另有研究报道,在大鼠MI/RI 模型中,CR可通过减少活性氧自由基(reactive oxygen species,ROS)的产生改善 MI/RI[13],但 CR 对 MI/RI产生的影响与细胞焦亡的相关性尚未明确。因此,本研究在对小鼠进行CR 干预基础上,构建MI/RI 模型,观察细胞焦亡情况,以评价CR 对MI/RI的保护作用,并探讨相关机制。
1 材料与方法
1.1 主要试剂 伊文思蓝/TTC 试剂、SDS-PAGE 凝胶试剂盒及蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)均购自北京索莱宝技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehvde,MDA)含量及乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒均购自南京建成生物工程研究所;肌酸激酶同工酶(creatine kinase-MB,CK-MB)含量检测试剂盒购自武汉 Bio-Swamp 公司;IL-1β 及 IL-18 ELISA 检测试剂盒均购自北京Sino Biological 公司;HRP 标记的羊抗兔IgG 和兔抗GAPDH 多克隆抗体均购自北京中杉金桥生物有限公司;超敏ECL 化学发光试剂盒购自美国 AffinitY 公司;兔抗 NLRP3 及 caspase-1 多克隆抗体均购自沈阳万类生物有限公司;兔抗凋亡相关斑点样蛋白(apoptosis-associated speckle-like protein,ASC)多克隆抗体购自中国ABclonal公司;兔抗GSDMD多克隆抗体购自美国Abcam公司。
1.2 实验动物 SPF级C57小鼠,40只,雄性,8月龄,体质量25~30 g,由北京市昌扬西山养殖场提供,动物许可证号为:SCXK(京)2016-0002。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,且按照动物伦理相关规定进行(文件号:SYDL2019012)。
1.3 动物分组及处理 将40只小鼠随机分为正常饮食组(AL 组)和CR 组,每组20 只,AL 组小鼠每日自由摄食;CR 组小鼠控制日进食量,每2 周递减10%,持续8 周,监测体质量变化。每组再分为假手术组和 MI/RI 组,共 4 组,即 AL+Sham 组、AL+I/R 组和CR+Sham组、CR+I/R组,每组10只。将AL+I/R组和CR +I/R 组小鼠用七氟醚麻醉后,气管插管,连接小动物呼吸机,于左侧第3~4 肋间开胸,暴露心脏,结扎冠状动脉左前降支,30 min 后松开结扎线再灌注24 h;相应Sham组只穿线不结扎。
1.4 各组小鼠心肌缺血和梗死面积的测定 采用伊文思兰/TTC 染色法。再灌注24 h 后,原位结扎冠状动脉,右心腔注射0.2 mL 2%伊文思蓝,钳夹腹主动脉,30 s后剪下心脏,0.9%氯化钠溶液冲洗,-80 ℃放置5 min;取出,将心脏组织切成1~1.5 mm 厚的切片,放入预热的2%TTC 中,37 ℃避光孵育30 min;置多聚甲醛中固定30 min,拍照,计算心肌缺血区面积和梗死面积。假手术组未经缺血再灌注手术,因此未进行伊文思兰/TTC染色。
1.5 各组小鼠心肌组织病理学观察 采用HE 染色法。将小鼠心肌组织置于10%甲醛溶液中固定,石蜡包埋后常规切片,将切片置65 ℃烤炙1 h;经二甲苯脱蜡及酒精梯度脱水后进行常规HE染色,置光镜下观察。
1.6 各组小鼠心肌组织损伤情况的测定 取20 mg小鼠心肌组织,置EP 管中,加入 180 μL 的0.9%氯化钠溶液,于冰上剪碎,超声粉碎后,3 000×g离心10 min,收集上清,采用相应试剂盒检测LDH、SOD活性及CK-MB、MDA含量。
1.7 各组小鼠血清中IL-1β 及IL-18 含量的检测 采用ELISA 法。再灌注24 h 后,经小鼠腹主动脉采血,分离血清,采用相应试剂盒检测血清中IL-1β及IL-18含量。
1.8 各组小鼠心肌组织细胞中焦亡相关蛋白表达水平的检测 采用Western blot 法。再灌注24 h 后,用RIPA 裂解液提取各组小鼠心脏组织蛋白,经12%SDS-PAGE 分离后,转移至PVDF 膜,用5%脱脂奶粉室温封闭2 h;分别加入兔抗NLRP3、GSDMD、ASC、caspase-1多克隆抗体(均1∶1 000稀释),4 ℃孵育过夜;用TBST 洗涤3 次,加入HRP 标记的羊抗兔IgG(均1∶2 000 稀释),室温孵育2 h;ECL 法显色。采用Image J 软件分析条带的灰度值,目的蛋白与GAPDH灰度值的比值表示目的蛋白相对表达水平。
1.9 统计学分析 应用Graphpad Prism 6.02 软件进行统计学分析,试验数据采用均数 ± 标准差()表示,多组间比较采用单因素方差分析(one-wayANOVA),两组比较采用t检验,以P< 0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠体质量变化 AL 组小鼠体质量较平稳,呈略增趋势,而CR组小鼠体质量有所降低。8周后,CR组小鼠体质量[(24.54±0.41)g]明显低于AL组[(31.46±0.25)g],且差异有统计学意义(t=14.34,P< 0.05),见图1。

图1 各组小鼠的体质量Fig.1 Body weights of mice in various groups
2.2 各组小鼠的心肌缺血和梗死面积 AL+I/R组及CR+I/R组小鼠心肌缺血区面积分别为(72.04±4.50)%和(76.28±3.01)%,差异无统计学意义(t=0.783 0,P> 0.05);心梗面积分别为(73.33 ± 3.14)%和(47.53 ± 1.69)%,CR+I/R组较AL+I/R组明显减少(t=7.250,P< 0.01)。见图2。

图2 小鼠心肌缺血和梗死面积的比较Fig.2 Comparison of myocardial ischemia and infarct size in mice
2.3 各组小鼠心肌组织病理学观察 AL + Sham 及CR + Sham 组小鼠心肌纤维排列整齐;AL + I/R 组小鼠心肌纤维断裂,失去正常的整齐排列结构,并伴有心肌细胞的坏死,CR+I/R 组小鼠心肌纤维排列则相对整齐,病理改变明显减轻。见图3。

图3 各组小鼠心肌组织的镜下观察(HE染色,×200)Fig. 3 Microscopy of myocardial tissue of mice in various groups(HE staining,× 200)
2.4 各组小鼠心肌组织的损伤情况 与AL + Sham组比较,AL+I/R组小鼠心肌组织中的LDH 活性及CK-MB、MDA 含量明显增加(t分别为7.691、5.051、5.515,P均 < 0.01),SOD 活性明显降低(t= 7.458,P< 0.05);与 AL + I/R 组比较,CR + I/R 组 LDH活性及CK-MB、MDA 含量明显降低(t分别为4.331、2.875、5.343,P均 < 0.05),SOD 活性明显增加(t=4.211,P< 0.05)。见表1。表明 CR 能改善MI/RI所致的心肌损伤。
表1 各组小鼠心肌组织中LDH、SOD的活性及CK-MB、MDA的含量(,n=4)Tab.1 Activity of LDH and SOD and content of CK-MB and MDA in myocardium of mice in various groups(,n=4)
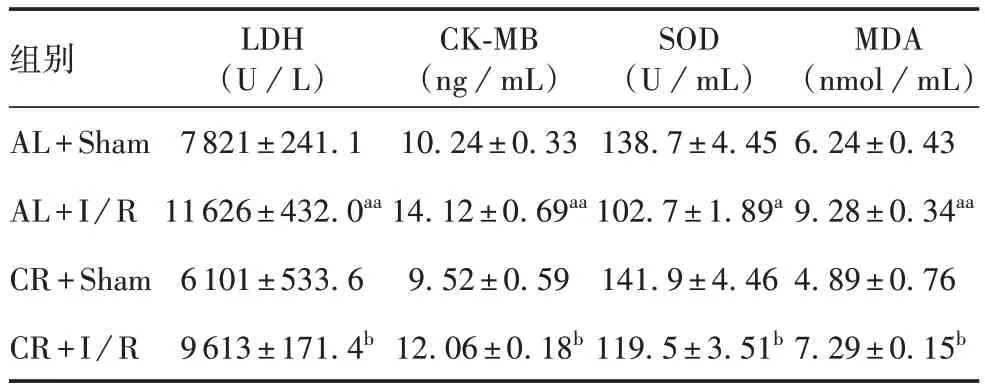
表1 各组小鼠心肌组织中LDH、SOD的活性及CK-MB、MDA的含量(,n=4)Tab.1 Activity of LDH and SOD and content of CK-MB and MDA in myocardium of mice in various groups(,n=4)
注:与AL+Sham组比较,a表示P < 0.05,aa表示P < 0.01;与AL+I/R组比较,b表示P < 0.05。
组别AL+Sham AL+I/R CR+Sham CR+I/R LDH(U/L)7 821±241.1 11 626±432.0aa 6 101±533.6 9 613±171.4b CK-MB(ng/mL)10.24±0.33 14.12±0.69aa 9.52±0.59 12.06±0.18b SOD(U/mL)138.7±4.45 102.7±1.89a 141.9±4.46 119.5±3.51b MDA(nmol/mL)6.24±0.43 9.28±0.34aa 4.89±0.76 7.29±0.15b
2.5 各组小鼠血清中IL-1β及IL-18的含量 与AL+Sham组比较,AL+I/R组小鼠血清中IL-1β及IL-18含量明显升高(t分别为6.626和13.500,P均<0.05);与AL+I/R 组比较,CR + I/R 组小鼠血清中 IL-1β及IL-18 含量明显降低(t分别为3.375和4.266,P均<0.05)。见表2。表明CR 可降低MI/RI 后炎症因子IL-1β及IL-18的表达。
表2 ELISA 法检测各组小鼠血清中IL-1β 及IL-18 的含量(pg/mL,,n=5)Tab.2 Determination of serum levels of IL-1β and IL-18 in mice of various groups by ELISA(pg/mL,,n=5)

表2 ELISA 法检测各组小鼠血清中IL-1β 及IL-18 的含量(pg/mL,,n=5)Tab.2 Determination of serum levels of IL-1β and IL-18 in mice of various groups by ELISA(pg/mL,,n=5)
注:与AL+Sham 组比较,a表示 P < 0.05;b 表示与AL+I/R 组比较,P < 0.05。
组别AL+Sham AL+I/R CR+Sham CR+I/R 23.68±0.88 55.39±4.71a 24.00±0.94 37.96±2.13b 234.9±12.38 746.3±54.21a 210.6±27.02 500.6±19.46b IL-1βIL-18
2.6 各组小鼠心肌组织中细胞焦亡相关蛋白的表达水平 与AL + Sham 组比较,AL + I/R 组小鼠心肌组织细胞中NLRP3、GSDMD、ASC、caspase-1 的相对表达水平显著上调(t分别为 5.919、4.071、7.033、6.495,P均 < 0.01);与AL+I/R组比较,CR+I/R组的 NLRP3、GSDMD、ASC、caspase-1 蛋白表达水平分别降低了32%、36%、26%和30%,差异均有统计学意义(t分别为3.412、3.420、3.480、2.585,P均 <0.05)。见图4和表3。

图4 Western blot 法检测各组小鼠心肌组织中细胞焦亡相关蛋白的表达Fig.4 Western blotting of expression of pyroptosis-associated proteins in myocardial tissue of mice in various groups
表3 各组小鼠心肌组织细胞中NLRP3、GSDMD、ASC、caspase-1的相对表达水平(,n=4)Tab.3 Relative expression levels of NLRP3,GSDMD,ASC and caspase-1 in myocardial tissue of mice in various groups(,n=4)

表3 各组小鼠心肌组织细胞中NLRP3、GSDMD、ASC、caspase-1的相对表达水平(,n=4)Tab.3 Relative expression levels of NLRP3,GSDMD,ASC and caspase-1 in myocardial tissue of mice in various groups(,n=4)
注:a 表示与 AL+Sham 组比较,P < 0.01;b 表示与 AL+I/R 组比较,P < 0.05。
组别AL+Sham AL+I/R CR+Sham CR+I/R NLRP3 0.44±0.05 1.06±0.09a 0.47±0.04 0.72±0.03b GSDMD 0.49±0.08 1.03±0.10a 0.43±0.07 0.66±0.04b ASC 0.39±0.07 0.97±0.04a 0.39±0.02 0.72±0.06b caspase-1 0.36±0.04 0.76±0.05a 0.37±0.03 0.53±0.07b
3 讨 论
CR 是科学家于1935 年提出的一种纯饮食调节方案,指摄食种类正常、摄入量总量减少30%~40%,同时保证必需氨基酸的摄入。CR 能够延缓机体衰老,延长寿命,这种保护效应与降低机体新陈代谢,减少氧自由基产生有关[14-15]。非药物的饮食调控可避免药物的毒副作用,但这种方法也受到一些质疑,因此探讨其对机体保护作用的具体机制是进行科学推广的一项重要环节。DAVID 等[16]报道,在异丙肾上腺素诱导的心肌肥厚小鼠模型中,CR 可激活抗氧化酶SOD 和GSH-Px 的活性,调节细胞内的氧化还原平衡。另外,用间歇性禁食模拟CR 可减小大鼠的心肌梗死面积,减少心肌细胞凋亡,降低心肌组织肥厚程度,改善心室重构[17-18]。本研究发现,CR对小鼠MI/RI具有保护作用,即CR 能明显减少MI/RI 引起的心肌组织LDH 与CK-MB 释放(P< 0.05),减小心梗面积(P<0.01),改善心肌组织的病理变化,同时能够减轻MI/R所致的氧自由基过度生成(P<0.05)。
细胞焦亡是一种新发现的细胞死亡方式,参与多种疾病的发生发展过程[7],当机体受到伤害性刺激时,活化NLRP3 炎性小体,激活caspase-1 及切割GSDMD,可产生具有成孔活性的GSDMD-N 末端,GSDMD-N 末端在细胞膜上寡聚形成跨膜孔,使胞浆内IL-1β、IL-18 等炎症因子释放,引发炎症反应[19]。GUO等[20]报道,在MI/RI大鼠模型中,抑制miR-383可通过激活RP105/PI3K/AKT通路,从而减少NLRP3炎性小体的激活,改善MI/RI,表现为LDH 与CKMB 的释放减少及心肌梗死面积明显减小,表明抑制细胞焦亡是减轻MI/RI 的一种有效策略。本研究结果发现,CR 可明显降低MI/RI 小鼠细胞焦亡相关蛋白 NLRP3、GSDMD、ASC、caspase-1 的表达水平(P均 <0.05),表明CR 可抑制细胞焦亡的发生,该结果与上述研究结果相符。
综上所述,本实验通过建立CR 小鼠模型,观察CR 对MI/RI 的影响,发现CR 可减轻小鼠心肌组织的损伤状况和氧化应激水平,减小术后心肌梗死面积,缓解MI/RI 病理损伤程度,改善MI/RI 损伤。CR 可抑制细胞焦亡相关蛋白的表达,证明抑制细胞焦亡是CR 减轻MI/RI 的一种保护途径。本研究为缺血性疾病的治疗提供了新的非药物辅助策略,但由于CR 的作用具有多靶点和复杂性,许多潜在的分子机制尚未明确,后续实验需设计多种CR 方案或多个时间点深入探究其减轻MI/RI 的其他可能作用机制。
