沉默E6相关蛋白对人乳头瘤病毒阴性宫颈癌细胞中p53蛋白表达水平的影响
2023-02-20解亦航郭宇微孙渤轩辛杨于嘉敏赵春艳
解亦航,郭宇微,孙渤轩,辛杨,于嘉敏,赵春艳
大连医科大学检验医学院临床生化检验教研室,辽宁 大连 116044
抑癌基因p53具有调控细胞周期、细胞凋亡和维持基因组稳定性等多种重要功能,在保持遗传完整性及避免生物细胞癌变等方面具有重要作用[1-3]。50%以上肿瘤细胞中存在p53的缺失、突变或功能失活[4-5]。正常细胞在缺氧、射线、癌基因激活等压力下会激活p53途径,启动细胞凋亡或基因修复,而癌细胞(即使存在野生型p53)几乎均缺乏激活p53途径的能力[6]。因此,尽管癌细胞暴露于各种形式的致癌应激环境中(如致癌基因激活、细胞缺氧和正常环境丧失),仍可继续增殖和存活[7]。有研究表明,p53蛋白使细胞在压力条件下通过凋亡避免细胞癌变[1,7],激活宫颈癌细胞中休眠的p53可抑制肿瘤细胞生长[8-9]。因此,抑制野生型p53降解、恢复突变体p53结构、促进p53重新激活是癌症治疗药物重要的研发方向。活化的(割裂的)半胱氨酸天冬氨酸特异性蛋白酶-3(cleavedcysteinyl aspartate specific proteinase-3,cleaved-caspase-3)是诱导细胞凋亡的关键效应分子,其蛋白水平可反映细胞的凋亡情况[10-11]。在正常细胞中,主要通过鼠双微体2(murine double minute 2,Mdm2)介导的泛素化降解途径进行p53蛋白的调控[12-13]。
高危人乳头瘤病毒(high risk human papilloma virus,HR-HPV)入侵机体细胞后,病毒自身编码的E6蛋白通过与E6相关蛋白(E6-associated protein,E6AP)结合介导p53泛素化降解,从而逃避由p53触发的细胞凋亡[14-15]。但在非HPV 感染的宫颈癌细胞(C33A)中,E6AP对p53蛋白的调控作用尚未明确[16]。因此,本研究通过siRNA 技术沉默E6AP 表达,探讨沉默E6AP 对C33A 细胞中p53 蛋白水平的影响,以期为后续宫颈癌治疗药物的研发提供实验依据。
1 材料与方法
1.1 细胞 C33A细胞购自武汉普诺赛生命科技有限公司。
1.2 主要试剂及仪器 胎牛血清(11011-8611)购自浙江天杭生物科技股份有限公司;青-链霉素(SV30010)和MEM 培养基(SH30024.01)均购自美国HyClone公司;LipofectamineTM2000 转染试剂盒(11668-019)购自美国Invitrogen公司;RIPA(弱)裂解液(P0013D)及ECL 均购自上海碧云天生物技术有限公司;鼠抗p53 单克隆抗体(60283-2-lg)及兔抗E6AP 多克隆抗体(10344-1-AP)均购自美国Proteintech 公司;兔抗cleaved-caspase-3 多克隆抗体(WL02117)购自沈阳万类生物技术有限公司;兔抗GAPDH 多克隆抗体(AP0063)购自南京巴傲得(Bioworld)生物科技有限公司;HRP标记的山羊抗兔IgG(ZB-2301)及山羊抗鼠IgG(ZB-2305)均购自北京中杉金桥生物技术有限公司;PVDF膜(IPFL00010)购自德国Merck Millipore公司。
1.3 E6AP的siRNA 沉默 参考文献[8-9]方法,设计特异性沉默E6AP的siRNA序列(siE6AP:5′-CAACUCCUGCUCUGAGAUATT-3′)及沉默对照无序siRNA序列(siControl:5′-UUCUCCGAACGUGUCACGUTT-3′),序列均由苏州吉玛基因股份有限公司合成。
1.4 细胞培养 将C33A 细胞用含10%胎牛血清和1%青-链霉素双抗的MEM 培养基,于37 ℃,5% CO2条件下常规培养。
1.5 细胞转染 取对数生长期的C33A 细胞,接种至24 孔板,1.5 × 105个/孔,于37 ℃,5% CO2条件下培养18 h;在LipofectamineTM2000 转染试剂的介导下将 siE6AP 及 siControl 序列分别转染 C33A 细胞,继续培养6 h;更换含10%胎牛血清的MEM 培养基(不含抗生素)。转染48 h 后,用4 ℃预冷的PBS 洗涤1次,RIPA(弱)裂解液冰上裂解细胞20 min;于 4 ℃,2 000×g离心10 min,取上清,BCA法蛋白定量。
1.6 沉默E6AP对C33A细胞中E6AP、p53和cleavedcaspase-3蛋白表达水平影响的检测 采用Western blot法。取siE6AP及siControl组C33A 细胞培养上清,经10%及15%SDS-PAGE(前者用于检测E6AP、p53 和GAPDH,后者用于检测cleaved-caspase-3)分离蛋白后,转移至PVDF膜,用5%脱脂牛奶室温封闭2 h;加入兔抗E6AP多克隆抗体(1∶5 000稀释)、鼠抗p53 单克隆抗体(1∶5 000稀释)、兔抗caspase-3/cleaved-caspase-3 多克隆抗体(1∶500 稀释)及兔抗GAPDH 多克隆抗体(1∶20 000稀释),4 ℃孵育过夜;TBST洗涤3次,每次10 min,加入HRP 标记的山羊抗兔IgG 及山羊抗鼠IgG(均1∶5 000 稀释),室温作用1 h;TBST 洗涤3次,每次10 min,ECL法显色。
1.7 统计学分析 应用SPSS 16.0 统计学软件进行统计学分析,实验数据均采用均值 ± 标准差()表示,组间比较采用独立样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 siRNA 沉默 E6AP 的效果 siControl 和 siE6AP组C33A 细胞中E6AP 蛋白表达量分别为(0.506 4 ±0.185 99)和1,前者明显低于后者,且差异有统计学意义(t=-4.597,P< 0.05),见图1。表明siE6AP 可沉默C33A细胞中E6AP的表达。

图1 Western blot 法检测siE6AP对C33A细胞中E6AP的沉默作用Fig.1 Western blotting of silencing effect of siE6AP on E6AP in C33A cells
2.2 沉默E6AP对C33A 细胞中p53蛋白表达水平的影响 siE6AP 和 siControl 组 C33A 细胞中 p53 蛋白表达水平分别为(1.572 5±0.218 77)和1,前者明显高于后者,且差异有统计学意义(t=4.533,P< 0.05),见图2。表明在C33A 细胞中沉默E6AP 可显著提高p53蛋白水平。

图2 Western blot 法检测沉默E6AP 对C33A 细胞中p53蛋白表达的影响Fig.2 Western blotting of effect of silencing E6AP on expression of p53 protein in C33A cells
2.3 沉默E6AP 对C33A 细胞中凋亡关键效应分子cleaved-caspase-3表达水平的影响 siE6AP和siControl组C33A 细胞中cleaved-caspase-3 的蛋白水平分别为(1.817 8±0.199 55)和1,前者明显高于后者,且差异有统计学意义(t=7.099,P< 0.05),见图3。表明在C33A 细胞中沉默E6AP 可显著提高cleaved-caspase-3蛋白的表达水平。
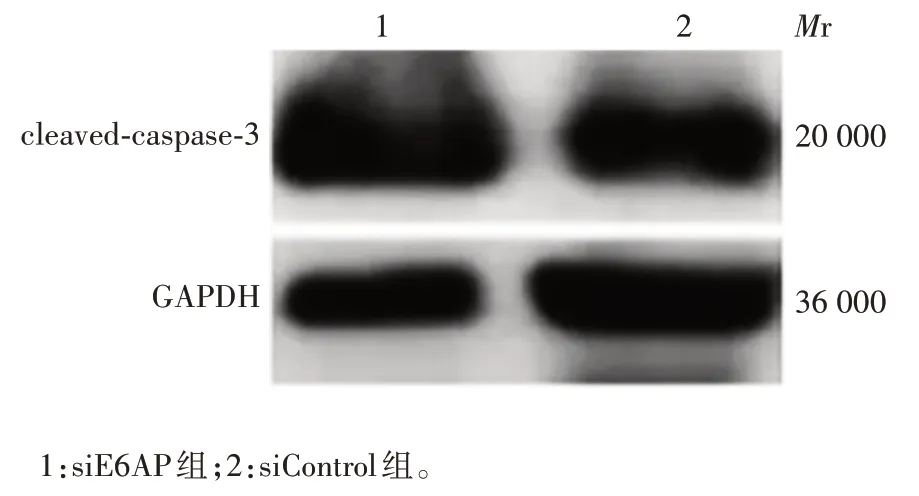
图3 Western blot法检测沉默E6AP对C33A细胞中cleavedcaspase-3蛋白表达水平的影响Fig.3 Western blotting of effect of silencing E6AP on expression of cleaved-caspase-3 protein in C33A cells
3 讨论
泛素化蛋白酶体途径是细胞内蛋白质降解的主要途径之一,该途径主要由泛素活化酶E1、泛素结合酶E2 及泛素蛋白连接酶E3 完成,其中E3 决定了靶蛋白的特异性[16]。目前已知的 E3 酶多达 600 多种,Mdm2 和 E6AP 是两种重要的 E3 酶[16]。Mdm2 是生理情况下介导p53 降解的主要E3 酶,Mdm2 通过与p53 蛋白结合抑制其转录功能,并通过泛素化蛋白酶体途径介导其降解[17]。同时,p53 又可正调节Mdm2表达,从而形成自动反馈调节回路[18-19]。E6AP蛋白广泛存在于几乎所有细胞中,参与多种抑癌基因蛋白的泛素化降解,如早幼粒细胞白血病蛋白(promyelocytic leukemia protein,PML)及簇集蛋白(stress-induced chaperone clusterin,CLU)、p27Kip1等,与宫颈癌、白血病、非小细胞性肺癌、前列腺癌及乳腺癌等多种癌症的发生发展密切相关[16,20-21]。HR-HPV感染的宫颈癌细胞中,在E6 蛋白参与下,E6AP 可介导p53 泛素化降解,使p53 降解由自动反馈调节Mdm2 途径转换为 E6 调控的 E6AP 途径[14-15],导致p53调控失控。有研究发现,在缺乏E6的情况下,E6AP可单独通过泛素化途径降解p53[15]。目前,对E6AP诱导p53 降解的研究多集中于HPV 感染的宫颈癌细胞或含有野生型p53的HPV 阴性宫颈癌细胞中(如RKO 和 MCF7)[15,22],对突变型p53在 HPV 阴性宫颈癌细胞研究较少。p53突变是HPV 阴性宫颈癌细胞中p53失活的主要原因[23],因此,本研究选择HPV阴性的宫颈癌细胞系C33A(其含有Arg273Cys 突变型p53)进行研究。结果表明,沉默E6AP C33A 细胞中的p53 表达水平显著提高(P< 0.05),表明E6AP 介导的突变型p53泛素化降解可能存在不依赖E6的途径或其他间接途径,具体机制需进一步深入研究。
caspase-3为caspase 家族成员之一,是参与凋亡途径的关键效应分子。正常状况下,胞质中的caspase-3以无活性Pro-caspase-3形式存在。p53可促使凋亡蛋白释放至细胞质中,诱导凋亡小体进行组装,切割Pro-caspase-3,形成具有活性的cleaved-caspase-3,快速启动细胞凋亡程序[24]。本研究结果表明,沉默E6AP 提高p53 表达水平的同时,可显著提高细胞中凋亡的关键效应分子cleaved-caspase-3 的含量(P<0.05)。提示在C33A细胞中,可通过沉默E6AP恢复p53活性,进一步诱导细胞凋亡。
恢复p53 活性是抗肿瘤治疗的重要策略之一。在HPV 阳性宫颈癌细胞中,p53 失活主要是由E6AP介导的泛素蛋白酶体途径降解所致;而在HPV 阴性宫颈癌细胞中,p53失活多是由p53的突变所引起[23]。因此,对于野生型p53,可通过抑制蛋白酶体活性以降低p53 的泛素化降解,从而恢复p53 活性;对于突变体p53,治疗策略可分为3类:恢复突变p53的野生型构象和转录活性、靶向突变p53的降解、诱导合成杀伤力[25-26]。目前,针对恢复p53活性的药物研发多集中于破坏 p53-Mdm2 相互作用方面[1],而 C33A 细胞中p53的突变为热点突变Arg273Cys,该突变使其失去与DNA 结合的能力,从而丧失其抑癌基因活性并获得致癌活性[25-26]。本研究发现,在HPV 阴性宫颈癌细胞中,突变型p53有可能通过E6AP 途径降解,这为靶向调控突变p53的降解提供了实验依据,为癌症治疗药物的设计和研发提供了新靶点。
