土壤湿度对番茄青枯病侵染进程和光合特性及根系生长的影响
2023-02-20袁泽南李甜竹张俊威李建明
袁泽南,周 洁,李甜竹,杜 越,张俊威,李建明
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
番茄青枯病是由青枯劳尔氏菌(Ralstoniasolanacearum)引起的爆发性病害,是世界上危害最大、分布最广,造成损失最严重的植物病害之一。青枯劳尔氏菌是一种革兰氏阴性细菌,可侵染50多个科的200多种植物,其中茄科作物番茄、辣椒和烟草等受害最为严重[1]。青枯病一旦发生,对植株就是毁灭性的危害[2]。目前关于青枯病的研究主要集中在抗病品种选育、生防菌选育、土壤消毒、化学药剂研发和土壤微生物互作等方面[3],我国已经筛选出多种防治青枯病的方法,但仍存在许多瓶颈,任何一种防治手段都无法保证百分之百的防效,这也说明番茄青枯病防治在世界范围内的重要性[4]。
关于环境因子对青枯病发生的影响,前人已经进行了一些研究,发现空气温度、湿度、降水和日照时数等都会影响青枯病的发生[5];烤烟青枯病发生流行最适温度在30~35 ℃,相对湿度90%以上[6]。刘宪臣[7]研究发现,接种后第5天在30和35 ℃以下,土壤湿度80%室内烟草青枯病发病率高于土壤湿度40%,但随着时间延长,发病率逐渐趋于一致。当土壤中病原菌数量为106.82CFU/g、土壤温度为30.55 ℃、相对湿度为81.42%以上时,烟草青枯病的病情指数最高为91.13%[8]。可见湿度是影响青枯病发生的一个关键因素,当温度基本满足青枯病发生的需求时,湿度就成为起决定性作用的气候因子,适宜的土壤温度和湿度有利于青枯菌在田间存活[9],但国内外关于土壤湿度对番茄青枯病发生影响的研究报道较少。
青枯菌通过寄主根的机械损伤部位侵染寄主植物的根,在无机械损伤时,侧根是青枯菌繁殖和侵入的优先位点[10-11],青枯菌的传染是从根部向顶部逐渐扩散的[12]。感染青枯菌后,致病菌株侵染原生木质部导管降解细胞壁,约25%的木质部导管定殖足以引起番茄植株的部分萎蔫[13]。电镜观察发现,青枯菌强致病力菌株能以游离形式存在于番茄感病品种根部细胞间隙,降解细胞壁,破坏原生质膜[1]。关于采用扫描电镜观察植株茎部青枯菌数量及侵染进程的研究较少。为此,本研究以番茄青枯病为对象,设置4个土壤湿度处理,借助扫描电镜观察各处理番茄植株不同高度茎部的青枯菌侵染情况,明确各处理青枯菌侵染情况的差异,解析温室番茄种植中土壤湿度-青枯菌-番茄植株之间的互作关系,以及接种青枯菌后番茄植株根系和叶片的响应,通过控制土壤湿度抑制病害的发生,为番茄青枯病的防治提供理论指导。
1 材料与方法
1.1 供试材料
供试番茄品种为金鹏14-8,经致病性测试,发现其为番茄青枯病易感品种;供试青枯菌菌株为P380,由中国农业科学院农业资源与农业区划所魏海雷教授惠赠。
1.2 试验处理
试验于2021年5-9月在陕西省杨凌揉谷镇千玉乡土风情园(108°07′ E,34°28′ N)的不对称大跨度温室大棚中进行。试验设接种青枯菌(处理组)与不接种青枯菌(对照组),分别和4个土壤湿度水平耦合处理。土壤湿度(用土壤相对含水量表示,即土壤湿度=土壤含水量/土壤田间持水量×100%)处理分别为高湿(T1,85%~100%)、中湿(T2,70%~85%)、低湿(T3,55%~70%)和干旱(T4,40%~55%),采用完全随机区组设计。采用盆栽方式,栽培介质为V(当地土壤)∶V(有机肥)∶V(商品基质)=5∶1∶1,植株种植方式为单垄双行,大行距为120 cm,小行距为30 cm,每个湿度处理番茄植株分别选未接种对照6株和接种处理22株,各重复3次,共种植番茄植株336株,小区总面积约96 m2。
青枯菌菌株P380先在TTC固体培养基上于28 ℃恒温培养2~3 d后,挑单菌落至NA液体培养基中,于28 ℃、200 r/min恒温摇床振荡培养2 d,再将菌液转入装有NA液体培养基的锥形瓶中大量培养2 d。用无菌水将青枯菌配成OD600=0.4的菌悬液,待番茄长至7~8叶1心时,采用伤根灌根法接种,每株接种150 mL菌悬液。
土壤湿度控制通过设置不同灌水量的方式进行,采用烘干称重法进行监测。其他试验条件相同,按常规管理方式进行日常管理。
1.3 番茄植株发病率及病情指数监测
接种青枯菌后,从植株出现青枯病症状时开始监测,隔天进行植株发病率统计,并计算病情指数。番茄青枯病的发病症状根据方中达[14]的方法分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ 5个等级,具体分级标准为:0级,叶片正常没有病症发生;Ⅰ级,1%~25%的叶片发生萎蔫;Ⅱ级,26%~50%的叶片发生萎蔫;Ⅲ级,51%~75%的叶片发生萎蔫;Ⅳ级,76%~100%的叶片发生萎蔫。发病率与病情指数计算公式如下:发病率=(感病株数/调查总株数)×100%;
病情指数=∑(各级病叶数×相对级数值)/(调查总叶数×最高级数值)×100。
1.4 番茄茎段青枯菌的扫描电镜观察
接种青枯菌后,分别在接种后第3,5,7,9天对各处理植株进行扫描电镜取样,每处理随机取1株植株,将植株根系从茎基部剪去,叶片剪掉,自下而上分别在植株茎高度为10,20,30 cm处取一小块茎段,依次记为SL1、SL2和SL3(图1)。按照扫描电镜的取样要求,用刀片将茎段切成长×宽×高约为7 mm×7 mm×3 mm的小块,之后放入体积分数4%戊二醛中固定12 h以上,4 ℃冰箱保存。
扫描电镜观察之前用0.1 mol/L pH 6.8 PBS缓冲液漂洗4次,每次10 min;再依次用体积分数10%,30%,50%,70%,80%,90%的乙醇溶液梯度脱水1次,每次10~15 min;接着用体积分数100%的乙醇脱水3次,每次30 min;再进行CO2干燥、粘台、喷金,最后上样,采用西北农林科技大学北校大型仪器平台的扫描电镜观察并拍照,每处理至少统计5个视野。
如图1所示,观察番茄植株茎段横切面的髓部,计算每个茎段对应扫描电镜图片中的青枯菌数量,再根据比例尺换算成每平方厘米内青枯菌的数量。
青枯菌数量(CFU/cm2)=图片中青枯菌数量/(扫描电镜图片长/比例尺×扫描电子显微镜图片宽/比例尺)。
1.5 植株光合作用指标测定
接种后第4天,选取植株新叶下完全展开、长势良好的第4片叶,处理组和对照组各重复测5株,采用Li-6800便携式光合作用仪测定番茄植株的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)。
1.6 植株根系形态指标测定
接种后第6天,处理组和对照组各随机取4株长势一致的番茄植株,从茎基部将植株地上部剪去,将植株根系尽可能完整地洗干净,装入已编号的自封袋中,测定植株的总根系长度、总根表面积、总根系体积、平均直径、根尖数等指标。采用LA-S植物根系分析仪系统对根系进行扫描并分析。
1.7 数据处理
试验数据以“平均值±标准差”表示,用Excel 2016和Origin 2021软件进行试验数据的统计分析和绘图,采用SPSS 23软件进行单因素方差分析,差异显著水平为α=0.05。
2 结果与分析
2.1 不同土壤湿度下接种青枯菌对番茄植株发病率和病情指数的影响
由图1可知,接种青枯菌后第3天,T1、T2、T3处理番茄植株开始出现青枯病患病症状,T4处理未出现患病症状;之后随着时间推移,T1处理发病率和病情指数迅速增加,T2处理次之,其中T1处理从接种后第5天到第7天发病率提高了1.97倍,从接种后第9天到第11天发病率提高了25.00%,接种后第11天发病率高达96.67%,植株几乎全部发病;T2处理从接种后第5天到第7天发病率提高了1倍,接种后第11天发病率达57.67%。T3和T4处理发病率和病情指数随着时间推移增加极其缓慢,T3处理发病率从接种后第3天到第11天提高了11.98倍,但接种后第11天发病率和病情指数分别为21.67%和13.92;T4处理第11天发病率和病情指数仅为10.00%和5.92。
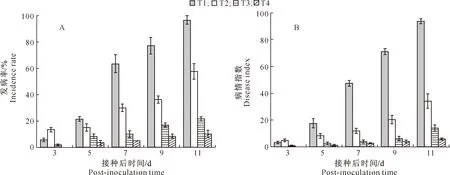
图2 接种青枯菌对不同土壤湿度下番茄植株发病率及病情指数的影响
2.2 不同土壤湿度下接种青枯菌对番茄茎段细菌分布的影响
扫描电镜观察显示,视野中青枯菌的大小为(0.5~0.7) μm×(1.5~2.5) μm,呈两端钝圆的短杆状,多分布于木质部组织缝隙中,分布方式多样。如图3所示,接种后第3天,在T1和T2处理SL1(10 cm)和SL2(20 cm)茎段以及T3处理的SL1茎段中均可观察到青枯菌,且青枯菌数量较少;各处理SL1茎段青枯菌数量为T1>T2>T3,SL2茎段青枯菌数量为T1>T2;SL3(30 cm)茎段均未观察到青枯菌;T4处理各茎段均未观察到青枯菌。
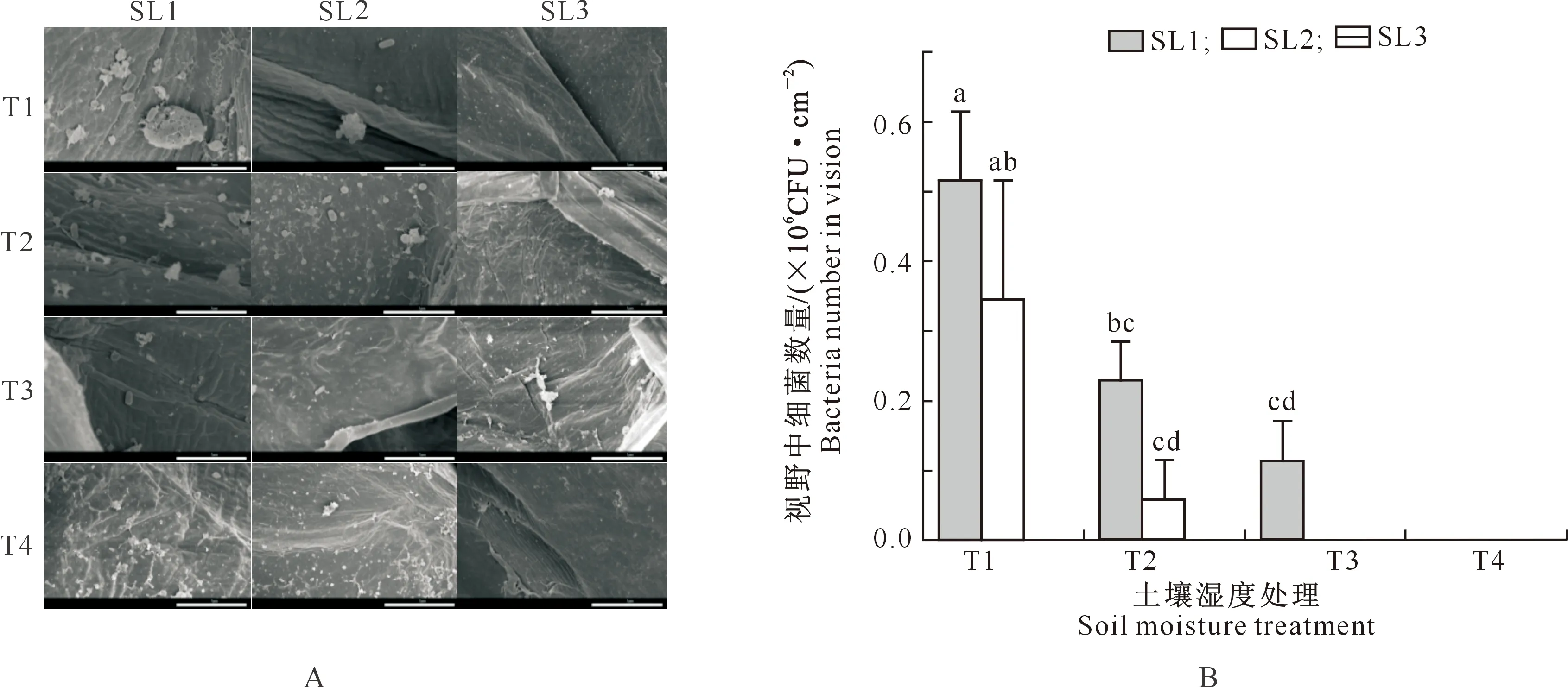
A.接种后第3天扫描电镜结果(比例尺=5 μm);B.不同土壤湿度处理各茎段的青枯菌数量;SL1、SL2、SL3分别代表植株高度为10,20,30 cm茎段;图柱上标不同小写字母表示处理间差异显著(P<0.05);图4、图5和图6同
由图4可知,接种后第5天,各处理番茄SL1茎段青枯菌数量为T1>T2>T3>T4,与T1处理相比,T2、T3、T4处理SL1茎段青枯菌数量分别下降了0.98×106,1.49×106,1.61×106CFU/cm2。T1、T2、T3和T4处理SL2茎段青枯菌数量分别为1.20×106,0.11×106,0.11×106和0 CFU/cm2,SL3茎段青枯菌数量分别为0.34×106,0.23×106,0和0 CFU/cm2,可知青枯菌数量随土壤湿度降低总体呈下降趋势。
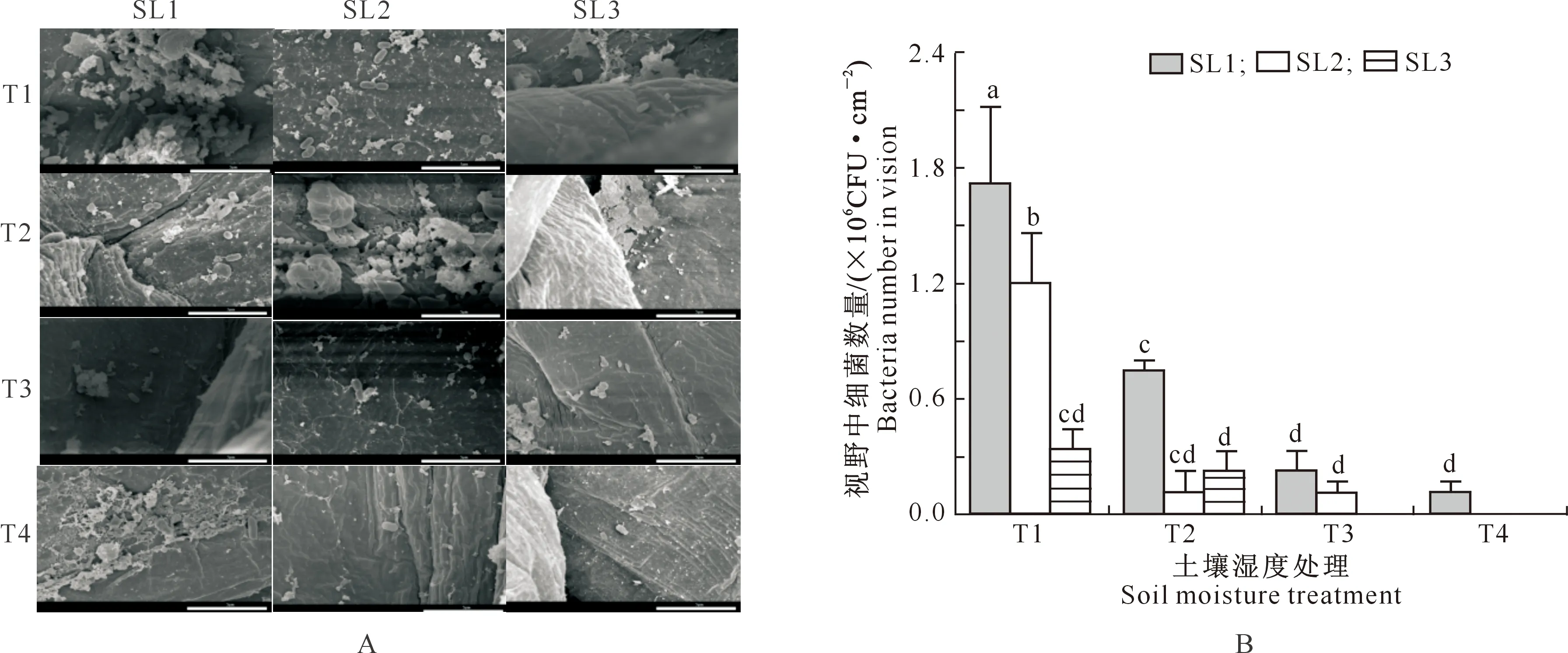
A.接种后第5天扫描电镜结果(比例尺=5 μm);B.不同土壤湿度处理各茎段的青枯菌数量
如图5所示,接种后第7天,各土壤湿度处理番茄SL1茎段青枯菌数量为T1>T2>T3>T4,其中T1、T2、T3、T4处理SL1茎段青枯菌数量分别为3.30×106,0.75×106,0.46×106,0.23×106CFU/cm2,T1处理细菌数量显著高于其他3个处理。各处理SL2茎段青枯菌数量为T1>T2>T3>T4,SL3茎段青枯菌数量为T1>T4>T2>T3。相同处理不同茎段高度处,青枯菌数量随着植株高度升高逐渐降低,T1、T2、T3处理中,青枯菌数量均为SL1>SL2>SL3,但T4处理为SL1>SL3>SL2。

A.接种后第7天扫描电镜结果(比例尺=5 μm);B.不同土壤湿度处理各茎段的青枯菌数量
如图6所示,接种后第9天,同一土壤湿度处理的番茄植株,青枯菌数量随着植株高度的增加呈降低趋势,即SL1>SL2>SL3。T1处理SL1茎段中青枯菌数量为10.79×106CFU/cm2,分别是T2、T3、T4处理此茎段处细菌数量的3.08,62.70,62.70倍。T3和T4处理各茎段青枯菌数量差异不显著,且数量较少。
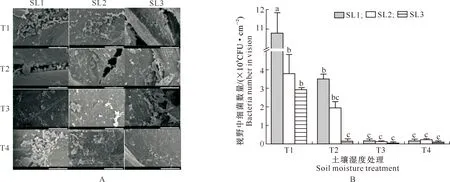
A.接种后第9天扫描电镜结果(比例尺=5 μm);B.不同土壤湿度处理各茎段的青枯菌数量
综上所述,随着接种时间推移,与接种后第3天相比,接种后第5,7,9天,T1和T2处理番茄SL1茎段青枯菌数量急剧增加,分别增加了2.34,5.34,19.90倍和2.25,2.25,14.25倍;T3处理SL1茎段青枯菌数量增加缓慢;T4处理SL1茎段青枯菌数量在接种后第3天为0,之后随接种时间推移增速极其缓慢。各处理SL2茎段处青枯菌数量随接种时间推移变化趋势不尽相同,T1、T2处理变化较大,T3、T4处理变化较小。SL3茎段青枯菌数量以T1处理变化较大,侵染后期增加迅速,在接种后第9天达到2.93×106CFU/cm2, T2、T3、T4处理SL3茎段处青枯菌数量随接种时间推移变化不大。
2.3 不同土壤湿度下接种青枯菌对番茄植株光合作用的影响
由图7 可知,与未接种(对照)植株相比,接种青枯菌后第4天,T1、T2、T3、T4处理植株的Pn分别减弱3.78%,23.20%,10.23%,10.42%;除了T4处理植株叶片的Tr增加16.97%外,T1、T2、T3处理番茄植株叶片的Tr分别降低了11.42%,23.46%,4.96%。
由图7还可知,接种后T1处理的Pn、Tr、Gs和Ci均显著高于T2、T3、T4处理,T2与T3处理间无显著差异,T4处理的各光合指标均显著低于T1、T2、T3处理。与未接种(对照)植株相比,接种青枯菌后各土壤湿度处理植株的Pn、Tr、Gs和Ci均降低(除T4处理的Tr外),说明接种青枯菌后植株的光合能力减弱,蒸腾作用减弱可能是因为受到青枯菌在维管束定殖的影响。

图柱上标不同小写字母表示处理间差异显著(P<0.05)
2.4 不同土壤湿度下接种青枯菌对番茄植株根系形态的影响
如表1所示,与未接种(对照)植株相比,接种青枯菌后第6天,各土壤湿度处理番茄植株的总根系长度、总根表面积、总根系体积均有所下降,其中T1处理总根系长度为5 099.62 cm,较未接种植株下降了3.27%,T2、T3、T4处理的总根系长度分别为3 957.09,2 935.06和2 355.42 cm。与未接种植株相比,接种后第6天,T1、T2、T3、T4处理番茄植株根尖分别增加了22.57%,35.53%,3.90%,12.16%,其中T1、T2处理的根尖数显著高于T3、T4处理。接种青枯菌第6天,T4处理植株的总根表面积显著低于T1、T2处理,但各接种处理植株总根系体积和平均直径差异均不显著。
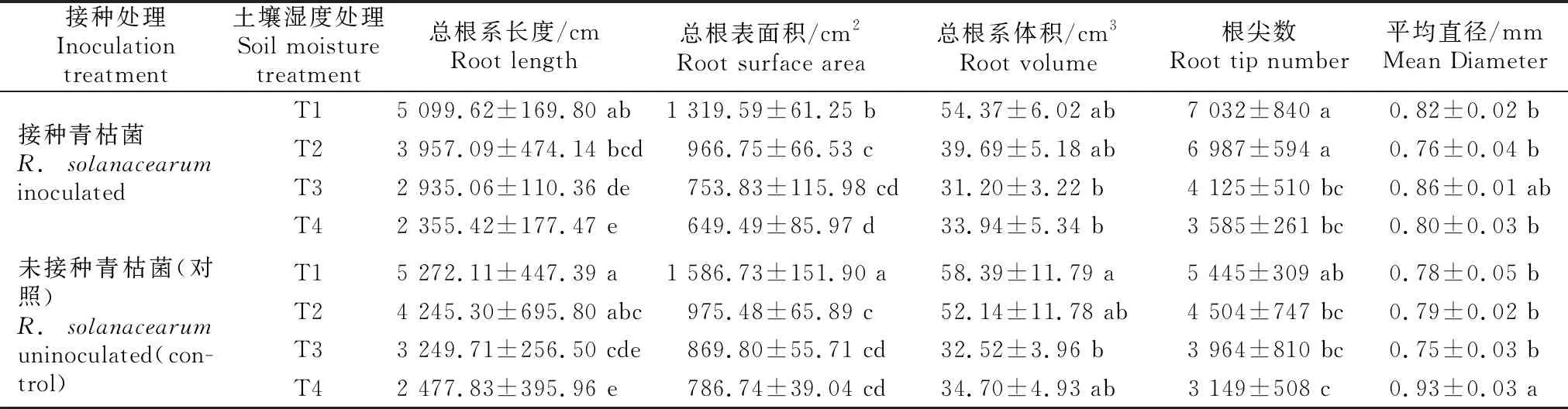
表1 不同土壤湿度下接种青枯菌对番茄植株根系形态的影响
3 讨论与结论
3.1 土壤湿度对番茄青枯病发病率的影响
高湿环境下,有寄主存在时土体中青枯菌的存活量会显著提升,这是因为土壤含水量高会导致寄主防御病菌的相关基因表达下调,进而使得寄主根表青枯菌的存活量增加,土壤中青枯菌的数量与植物青枯病发病率呈显著正相关[15-16]。本研究中,高土壤湿度环境(T1)的青枯病发病率远高于低湿(T3)和干旱(T4)环境,高土壤湿度条件下青枯菌11 d左右就完成了整株侵染,发病率高达96.67%;低土壤湿度(40%~70%)条件下植株的发病率较低,且随着接种时间的推移发病率增加缓慢,因此降低土壤湿度可以抑制青枯病的发展。
3.2 土壤湿度对番茄青枯菌在茎秆中侵染进程的影响
王铮敏等[17]研究茄子体内青枯菌的分布发现,在不同发病期,青枯菌数量均随着植株高度的上升而下降,这与本研究结果一致。刘波等[18]研究发现,番茄和茄子病株体内青枯雷尔氏菌的平均含量>100×108CFU/g,显著高于烟草、花生和生姜(<70×108CFU/g);青枯雷尔氏菌在番茄体内的分布依次为根部>中部以上茎>中部以下茎。本研究中,从植株开始出现症状后观察茎部青枯菌数量,发现随着接种时间推移,在同一土壤湿度处理下青枯菌数量分布表现为下部茎(SL1)>中部茎(SL2)>上部茎(SL3);同一茎段内,各土壤湿度处理番茄青枯菌数量为T1>T2>T3>T4;高土壤湿度下植株体内的青枯菌数量显著高于低湿和干旱处理,同一茎段青枯菌数量随土壤湿度的下降而降低,因此降低土壤湿度可以抑制番茄青枯病在植株体内的蔓延。
侵染前青枯菌能在环境中识别根系分泌信号,通过端生鞭毛的运动向寄主植物靠拢,利用植物凝结素和Ⅳ型菌毛将其细胞粘附在根部表面,通过根系分泌微点、根部伸长区或次生根节点进入植株体内[19-20]。青枯菌在茎木质部的运动十分复杂,木质部中的细菌数量达到109CFU/mL之前基本上是静止的[21]。在番茄根中,即使植株没有显示萎蔫症状,也经常观察到105~108CFU/g细菌的定殖[22]。本试验结果与前人研究结果一致,T3和T4处理病情指数极低,在植株自下而上的茎部能够观察到少量青枯菌,但植株表型并没有显示出青枯病症状。结合取样方法、观察结果和植株青枯病患病情况可知,植株显示青枯病症状与否可能与青枯菌侵染快慢和植株中青枯菌数量积累多少有关。本研究中,接种青枯菌时间越长,同一土壤湿度处理和同一高度茎段处青枯菌数量越多。高湿(T1)处理下各茎段处青枯菌数量呈明显上升趋势,尤其在接种后第7天到第9天,青枯菌数量增加迅速;在中湿(T2)处理中,青枯菌数量也呈增加趋势;在低湿(T3)和干旱(T4)处理中,随接种时间推移各茎段处青枯菌数量增加极其缓慢。因此可以推测降低土壤湿度能减缓青枯菌在植株茎中的侵染进程,使植株的发病率降低。
3.3 土壤湿度对接种青枯菌番茄植株光合特性和根系形态的影响
张红卫等[23]研究发现,小麦的光合速率在土壤含水量偏低的状态下较小,随着土壤含水量增高光合速率增大,叶片气孔传导速率、胞间CO2浓度也随着土壤含水量增大逐渐增高。冬小麦光合参数随着土壤湿度的降低而降低,PAR<100 μmol/(m2·s)时,各水分处理的净光合速率相差不大;PAR>100 μmol/(m2·s) 时,净光合速率随着水分胁迫程度的加重而显著降低[24]。青枯菌随蒸腾液流顺着导管侵染到植株的茎部,同时青枯菌胞外多糖的富集阻断了水分和营养物质的运动,阻塞了维管束,导致植物蒸腾作用减弱,从而出现萎蔫症状[25]。已有研究显示,接种青枯菌后植株叶片的Pn、Gs、Ci、Tr均较未接种植株显著下降[26]。本试验结果显示,接种青枯菌后第4天,各处理Pn、Gs、Ci、Tr随土壤湿度降低而呈下降趋势,可能是因为土壤湿度降低,植株木质化严重,植株的发育受到影响,光合作用受到抑制。与未接种青枯菌的植株相比,接种青枯菌后番茄植株的Pn、Gs、Ci、Tr总体降低,表明接种青枯菌可能抑制植株的光合作用,但接种青枯菌后植株光合效率与未接种(对照)植株相比差异基本不显著,因此番茄青枯病与光合作用的关系还有待于进一步研究。
杨再强等[27]研究表明,不同水分处理番茄根系生长指标(根系总长度、总表面积、总平均直径、根尖数)的最大值均表现为轻度胁迫>中度胁迫>正常灌溉>重度胁迫,表明轻度胁迫利于根系生长,中、重度土壤水分胁迫明显抑制了番茄植株根系的生长。这与本试验中土壤湿度对番茄根系影响的结果不一致,4种土壤湿度处理的番茄植株总根系长度、总根表面积和根尖数均为T1>T2>T3>T4,可能是T1、T2处理的高土壤湿度环境促进了番茄根系生长,而低土壤湿度环境则抑制了番茄根系生长,T4处理对番茄植株的生长造成胁迫,因此根系形态随土壤湿度大小的变化有所不同。段曦[28]研究发现,接种青枯菌后番茄植株根系受损严重,侧根和根毛明显减少;曾东方等[29]研究发现,青枯菌侵染后花生的根系生长速度变慢。有研究表明,接种青枯菌7 d番茄植株根系形态,植株总根系长度、总根表面积、总根系体积均比未接种青枯菌的植株降低,根平均直径变化不明显[30]。本研究结果表明,在接种青枯菌后第6天,与未接种植株相比,接种青枯菌处理番茄植株的总根系长度、总根系体积、总根表面积降低,根尖数增加,根平均直径变化无规律,因此青枯菌侵染可能对番茄植株根系生长存在抑制作用,这与前人研究结果一致。
