伊托必利对重症患者营养不良及肠道屏障功能的改善效果评估
2023-02-19王启明刘汉影陈小云
王启明 刘汉影 陈小云
危重症患者往往存在营养不良的问题,特别是胃肠道功能紊乱,营养摄入严重不足,具有更高的营养不良风险[1]。长期的营养不良可影响机体的组织、器官结构以及功能,容易出现多脏器功能不全,导致肺功能、呼吸肌收缩功能以及免疫功能等损伤或者紊乱,造成患者严重感染,从而增加死亡风险[2]。危重症患者营养不良是病情加重、治疗难度增加的关键因素,也是影响患者预后的危险因素,因此改善患者消化功能并及时补充营养具有重要意义。目前,临床上常采用肠内营养治疗,同时配合益生菌肠内营养干预可一定程度改善患者免疫功能,纠正体内菌群失衡状态以及调节营养状态[3]。研究认为[4],胃动力改变是导致疾病发生、发展的重要因素,通过恢复胃肠道的功能可有效改善患者消化不良、吸收减退等症状,为重症营养不良提供新的治疗选择。伊托必利是常见的胃肠道促动力药,已广泛应用于功能性消化不良引起的各种症状[5],本文将通过实例进一步探讨,旨在为临床治疗提供理论依据。
1 资料与方法
1.1一般资料 选取2020 年1~12 月期间本院收治的108 例重症患者,根据入组先后顺序依次编号,并采用随机数字表法分为对照组和观察组,每组54 例。两组患者的性别、年龄、体重、急性生理学及慢性健康状况评分系统(APACHE Ⅱ)评分及病因等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究经本院伦理委员会批准。
表1 两组患者一般资料比较(n,)

表1 两组患者一般资料比较(n,)
注:两组比较,P>0.05
1.2纳入及排除标准
1.2.1纳入标准 ①MNA-SF 评分<11 分(表明营养不良);②入组前1 d 完成肝肾功能、血糖、血脂等相关检查;③意识清楚,可以配合治疗;④入组患者知情同意。
1.2.2排除标准 ①不能行肠内营养、近期手术、恶性肿瘤;②近期有抗生素应用史;③病程中出现肠穿孔、肠坏死、完全性肠梗阻等肠道不良事件。
1.3方法 在入院后,对所有患者进行基础性治疗,并给予常规肠内营养治疗以及益生菌肠内营养干预,包括使用肠内营养粉剂(商品名:安素,美国雅培制药有限公司)和服用益生菌制剂(规格:0.5 g/片),55.8 g肠内营养粉剂加入到200 ml 凉水中,搅拌溶解,配置成250 ml 营养剂,3 次/d,250 ml/次,服用或管饲;益生菌制剂每片含保加利亚乳杆菌和嗜热链球菌活菌≥0.5×106CFU、长双歧杆菌活菌≥0.5×107CFU,3 次/d,3 片/次。观察组在此基础上口服伊托必利(上海雅培制药有限公司,规格:50 mg/片),3次/d,1片/次。两组患者均治疗2 周。
1.4观察指标及判定标准
1.4.1营养状态 分别于治疗前、治疗2 周后评估患者营养状态。检测血清TP、Alb、Hb 水平,使用全自动生化分析仪进行检查。采用微营养评估量表(mininutritional assessment,MNA-SF)进行营养状态评估,包括患者的体质量指数(BMI)、神经疾病、饮食变化、应激状况、活动能力等情况,总分14 分,分值越高表明营养状态越好。
1.4.2胃肠功能 分别于治疗前及治疗2 周后采集所有患者晨起空腹外周静脉血5 ml,应用酶联免疫吸附试验法(ELISA)(武汉博士德生物工程有限公司)检测肠脂肪酸结合蛋白(intestinal fatty acid binding protein,IFABP)、血管活性肠肽(vasoactive intestinal peptide,VIP)水平。
1.4.3肠道屏障功能 分别于治疗前及治疗2 周后检测患者血液D-乳酸、二胺氧化酶及细菌内毒素水平。采用JY-DLT 肠道屏障功能生化指标分析系统进行检测,联检试剂盒购自于北京中生金域诊断技术有限公司,正常值范围:D-乳酸≤15 mg/dl、二胺氧化酶≤10 U/L、细菌内毒素≤20 U/L。
1.4.4不良事件发生情况 统计治疗期间患者不良事件发生情况,如恶心呕吐、腹痛腹泻、食欲减退、感染等。
1.5统计学方法 采用SPSS23.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1两组患者营养状态比较 治疗前,两组患者血清TP、Alb、Hb 水平以及MNA-SF 评分比较,差异无统计学意义(P>0.05);治疗2 周后,两组患者血清TP、Alb、Hb 水平以及MNA-SF 评分均高于本组治疗前,且观察组患者血清TP、Alb、Hb 水平以及MNA-SF 评分均高于对照组,差异具有统计学意义(P<0.05)。见表2。
表2 两组患者营养状态比较()

表2 两组患者营养状态比较()
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.2两组患者胃肠功能比较 治疗前,两组患者IFABP、VIP 比较,差异无统计学意义(P>0.05);治疗2 周后,两组患者IFABP 低于本组治疗前,VIP 高于本组治疗前,且观察组患者IFABP 低于对照组,VIP 高于对照组,差异具有统计学意义(P<0.05)。见表3。
表3 两组患者胃肠功能比较()
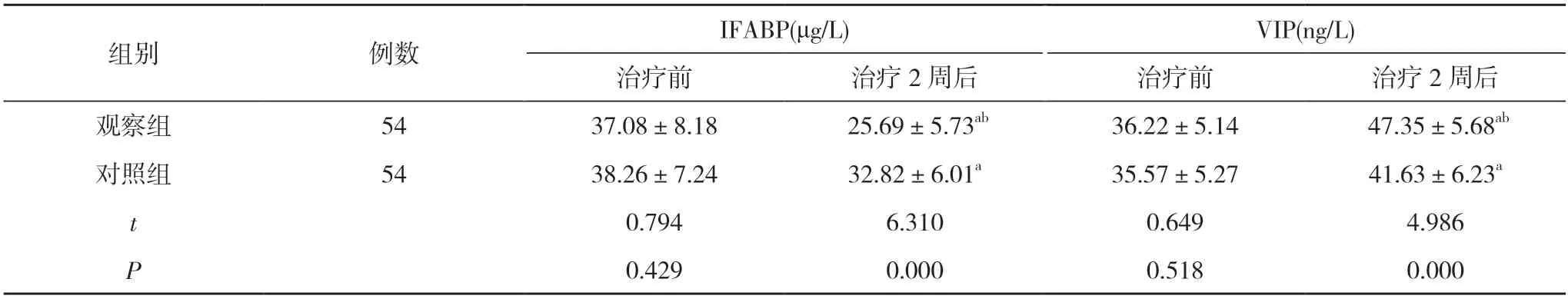
表3 两组患者胃肠功能比较()
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.3两组患者肠道屏障功能比较 治疗前,两组患者D-乳酸、二胺氧化酶、细菌内毒素比较,差异无统计学意义(P>0.05);治疗2 周后,两组患者D-乳酸、二胺氧化酶、细菌内毒素均低于本组治疗前,且观察组患者D-乳酸、二胺氧化酶、细菌内毒素均低于对照组,差异具有统计学意义(P<0.05)。见表4。
表4 两组患者肠道屏障功能比较()
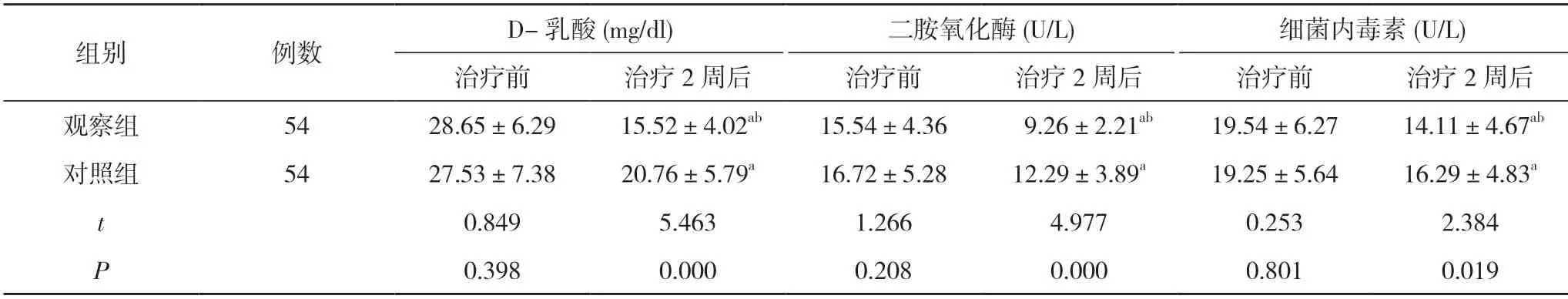
表4 两组患者肠道屏障功能比较()
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.4两组患者不良事件发生情况比较 观察组患者恶心呕吐、感染发生率明显低于对照组,差异具有统计学意义(P<0.05);两组患者腹痛腹泻、食欲减退发生率比较,差异无统计学意义(P>0.05)。见表5。

表5 两组患者不良事件发生情况比较[n(%)]
3 讨论
重症患者的内环境失衡,且处于应激状态,导致胃肠激素调节紊乱,能量消耗增多,并出现消化功能、胃肠功能障碍。同时,重症患者往往有意识障碍、吞咽困难、呼吸困难等症状,无法自主进食,机体需消耗自身贮存的能量以维持正常的生理机能,导致营养供求失衡,容易出现营养不良,进而引起多器官功能衰竭,增加死亡风险[6,7]。营养支持治疗通过提供充足的营养以满足机体的代谢需求,其中肠内营养支持较为常见,可以抑制肠道细菌移位,维护患者胃肠功能正常,防止因胃肠功能受损而导致的器官衰竭、病情恶化[8]。本次研究发现,治疗2 周后,两组患者血清TP、Alb、Hb 水平以及MNA-SF 评分均高于本组治疗前,且观察组患者均高于对照组,差异具有统计学意义(P<0.05)。表明常规肠内营养干预可改善重症患者的营养状态,在此基础上联合伊托必利治疗效果显著。丁丞章等[9]及Lu 等[10]研究认为,患者接受益生菌肠内营养干预后,可有效抑制病原菌大量繁殖,改善肠道菌落紊乱状态,并且维护肠道黏膜的正常功能,进而减少有害物质进入血液循环,故而本次研究发现治疗2 周后,两组患者的血清D-乳酸、二胺氧化酶、细菌内毒素均呈下降趋势。说明常规肠内营养治疗以及含益生菌肠内营养干预可有效促进重症患者的肠道屏障功能恢复,进而降低细菌内毒素等有害物质对机体的刺激或者损伤,利于患者营养状态以及生理功能的恢复。
研究认为[11,12],危重症患者营养不良现象非常多见,与患者机体代谢因素、能量消耗以及胃肠道消化功能状态有关,在开展营养治疗、肠道菌群调节的过程中积极主动恢复患者的胃肠动力学状态对于疾病的治疗具有重要意义。伊托必利具有抑制乙酰胆碱酯酶活性以及阻滞多巴胺D2受体的作用,同时还能刺激乙酰胆碱的释放,从而增强胃、十二指肠的运动,以及促进胃排空,已成为治疗胃动力障碍引起的消化性不良的常用选择[13,14]。本次研究结果表明伊托必利可改善重症患者的胃肠功能。伊托必利可通过调节自主神经系统而改善胃肠道功能,进而促进胃肠道动力学,改善消化道不良症状,故而本次研究发现观察组患者经治疗后恶心、呕吐症状发生率明显低于对照组,差异具有统计学意义(P<0.05)。杨勇等[15]研究认为,肠内营养剂可以加快蛋白质合成,增强体内免疫反应,而益生菌肠内营养干预可保护肠道功能的完整性,促进免疫球蛋白A(IgA)的分泌,同时还能促进淋巴细胞分裂以及调控T 淋巴细胞的分泌功能,两者协同作用改善免疫功能,从而降低感染风险。王石健等[16]通过动物实验表明,伊托必利可通过抑制MAPK 信号通路(抑制cleaved、Caspase-3、NF-κB 等的表达),以及增加胃黏膜紧密连接蛋白(Occludin、ZO-1)的表达,减少胃上皮细胞凋亡,促进损伤胃黏膜的修复,增强胃黏膜屏障功能。同时,配合使用益生菌,改善肠道菌群以及抑制内毒素释放,从而减少毒素、病原菌从肠腔释放入肠壁的淋巴或血液循环中,降低血清细菌内毒素水平以及降低肠源性感染风险,利于疾病的预后。
综上所述,伊托必利可改善重症患者的营养不良状态,促进肠道屏障功能的恢复,纠正胃肠功能紊乱,降低不良事件发生风险,具有良好的临床应用价值。
