乙虫腈对映体在蚯蚓体内的累积行为
2023-02-18冯跃梁程有普郝培培张彩霞
冯跃梁,程有普,郝培培,张彩霞
(1.天津农学院园艺园林学院,天津 300384;2.天津市绿亨化工有限公司,天津 300270)
乙虫腈(ethiprole)属苯基吡唑类手性杀虫剂,能够防治多种咀嚼式口器和刺吸口器害虫,目前已在中国登记,并大量应用于防治水稻中的稻飞虱[1]。水稻是我国主要粮食作物之一,也是我国种植面积较大的粮食作物之一[2],由此可见,对乙虫腈的环境风险评估是重中之重。乙虫腈有1个手性中心,2个对映体。手性农药暴露在手性环境中时往往在吸收、累积和降解过程中表现出不同的对映体选择性[3]。研究手性农药对映体的立体选择性是在对映体水平上全面评价手性农药环境行为的重要组成部分,既有助于手性农药环境风险评估,又对有效单体的开发意义重大。
蚯蚓在土壤生态系统中,是最重要的生物因子之一,在土壤中充当消费者、分解者和调节者的角色[4]。蚯蚓对土壤污染物很敏感,通过吸收、代谢可以清除一些污染物,如农药、多氯联苯、多环芳烃和重金属[5-6]。目前,蚯蚓被认为是一种监测土壤表层中的污染物的指示生物,广泛应用于毒理学试验[7]。目前尚未见从对映体角度研究乙虫腈在蚯蚓中的生物累积行为,基于此,本研究拟从对映体角度探讨乙虫腈在蚯蚓体内富集行为,从而为全面评价乙虫腈的环境行为和提高对映体水平上的生态风险认识提供一定的数据支持。
1 材料与方法
1.1 试验材料
赤子爱胜蚓(Eiseniafoetida),天津市贾立明蚯蚓养殖公司,供试生物选取健康、大小相似(300~350 mg)且带有生殖环带的蚯蚓。人工土壤按照OECD准则配制。配比为:石英砂68.0%(过80~120目筛),高岭土20.0%(高岭石含量大于30.0%),泥炭藓10.0%,用碳酸钙调节人工土壤pH值为7.0±0.5,混合均匀后备用。
1.2 试验试剂
乙虫腈外消旋体(对映体比例1∶1,纯度95.6%)由农业农村部农药检定所提供;R-(+),S-(-)乙虫腈由上海勤路生物技术有限公司制备(光学纯度大于99.0%);色谱纯甲醇、乙醇、异丙醇、乙腈、冰醋酸购于默克公司;分析纯甲醇、乙腈、分析纯氯化钠、分析纯无水硫酸镁购于天津津科精细化工研究所;超纯水由MilliQ超纯水制备系统制备;Pesti-Carb/PSA、氧化铝、氨基、PSA、佛罗铝硅土固相萃取柱(500mg/6mL/30pkg)购于博纳艾杰尔科技有限公司。
1.3 试验仪器
超临界流体串联质谱(SFC-MS/MS)(Waters,美国);样品管理器、柱温箱、二元溶剂管理器、补偿泵、三重四级杆质谱检测器Xevo-TQD和MasslynxV.4.1工作站、人工气候箱(宁波赛福实验仪器有限公司,中国);OD-3多糖涂敷型手性色谱(长度均为150 mm,内径2 mm)(大赛璐药物手性技术有限公司,日本)。
1.4 试验方法
1.4.1 蚯蚓染毒 试验设置单体浓度为0.5、5.0、12.5 mg·kg-1的3个处理组以及空白对照组。将乙虫腈溶于丙酮,加入到装有石英砂的培养皿中,将其放入通风橱中,使丙酮充分挥发,药砂与人工土混匀,每个烧杯中加入15条蚯蚓。通过称质量补水,使土壤湿度保持在40%~60%。人工气候箱的设置条件为湿度80%~85%、温度(20±1)℃、光暗比16∶8。定期(2 h、1、2、3、5、7、10、14、21、28 d)取全部蚯蚓和50 g土壤。取出蚯蚓用纯净水洗净体表后,置于干净湿润的滤纸上清肠6 h,用吸水纸擦干体表后称质量。蚯蚓和土壤样品均置于聚乙烯样品袋中,并且在-20℃下冷冻保存。
1.4.2 蚯蚓和人工土样品处理 蚯蚓样品转移到10.0 mL离心管中,加入钢珠,震荡20 min,完成后取出备用。称取2.0 g蚯蚓基质,加入20.0 mL 1%醋酸乙腈,震荡15.0 min,加入1.0 g NaCl和2.0 g无水MgSO4,涡旋5.0 min,吸取15.0 mL上清液加入到50.0 mL茄形瓶中,用旋转蒸发仪旋干溶剂,加入色谱纯乙腈复溶,备用。将PC/PSA小柱用10.0 mL乙腈活化,加入已备好的复溶液,并收集流出液,以V(甲苯)∶V(乙腈)=1∶3溶液5.0 mL做洗脱液,一并收集,旋干,用1.5 mL色谱纯乙腈复溶。用注射器吸取上清液,通过0.22μm尼龙膜注,进行SFC-MS/MS分析。
将10.0 g人工土样品放入50.0 mL离心管中,加入10.0 mL去离子水,加入10.0 mL1%醋酸乙腈,涡旋震荡15.0 min后,加入2.0 g NaCl和4.0 g无水MgSO4,震荡5 min,在2 811×g条件下离心5.0 min,吸取1.5 mL上清液加入到装有50.0 mg C18+150.0 mg无水硫酸镁的2.0 mL离心管中,震荡1.0 min,放入离心机中,在离心力为2 811×g条件下,离心5.0 min。用注射器吸取上清液,过0.22μm尼龙膜,进行SFC-MS/MS分析。
1.4.3 仪器分析方法 本试验使用超临界流体串联质谱(SFC-MS/MS)对样品进行分析。其中具体的源参数包括毛细管电压、离子源温度、脱溶温度、锥状气体流量和脱溶气体流量分别设定为3.5 kV、150.0℃、500.0℃、30.0 L·h-1、800.0 L·h-1。乙虫腈的母离子质量分数为394.9,定性离子质量分数为250.1,碰撞电压为35.0 V,锥孔电压为20 V。定量离子质量分数为331.0,碰撞电压为15.0 V,锥孔电压为20.0 V。乙虫腈对映体的最佳拆分条件为:OD-3涂敷型手性色谱柱;改性剂比例V(CO2)∶V(IPA)=90∶10;流速:1.8 mL·min-1;柱温:30.0℃;背压:2 000.0 Psi。
1.4.4 数据分析方法 以对映体分数(EF)表示手性农药的对映体选择性。其中,EF=C(+)/[C(-)+C(+)][8]。EF值的定义范围为0~1,EF=0.5表示外消旋体;EF值低于0.5,说明(-)-乙虫腈优先降解,反之亦然。乙虫腈对映体的相对累积用生物-土壤累积因子(BSAF)表示。
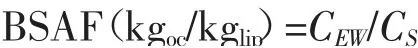
式中,CEW为蚯蚓体内农药浓度;CS为土壤初始农药浓度和最终农药浓度的平均值[9-10]。
使用SPSS17.0进行数据处理、差异显著性分析和单因素方差分析,使用Excel制图。数据均采用平均值±标准差的形式表示。
2 结果与分析
2.1 建立前处理方法
2.1.1 蚯蚓 考察4种提取剂(乙腈、1%甲酸乙腈、1%醋酸乙腈、5%醋酸乙腈),结果只有1%醋酸乙腈的回收率在80%~120%之间,故选取1%醋酸乙腈作为提取剂。蚯蚓体内脂质较多,使用QuEChERS方法中的净化剂可能对脂质清除不彻底。因此,在本试验中对QuEChERS前处理方法进行改良,结合固相萃取技术(SPE)对蚯蚓基质进行净化,试验净化效果良好。蚯蚓中含有色素及脂质物,分别使用PSA固相萃取柱、Alumina N固相萃取柱、Florisil固相萃取柱、C18固相萃取柱、PC/PSA固相萃取柱对蚯蚓基质进行净化。结果显示,PC/PSA固相萃取柱的回收率优于PSA固相萃取柱和C18固相萃取柱,且净化色素效果更好,所以选择PC/PSA固相萃取柱作为蚯蚓的净化剂。
配制200 mg·L-1的标准母液,将母液稀释制备成浓度依次为0.01、0.05、0.1、0.5、1.0 mg·L-1的溶剂标。使用空白基质提取液对母液进行稀释,同样制备成上述浓度的基质标。通过样品检测,使用Execl进行线性回归分析,得出(+)-乙虫腈的线性方程为y=223.94x+2 945,R2=0.998 7。(-)-乙虫腈的线性方程为y=213.62x+2637.3,R2=0.998 6。通过对精密度和准确度验证,(+)-乙虫腈的回收率为100.1%~104.7%,RSD为1.5%~5.7%;(-)-乙虫腈的回收率为91.6%~104.4%,RSD为2.5%~6.9%。
2.1.2 人工土 考察上述4种提取剂,酸化乙腈的提取效率效果比乙腈的效率高,1%甲酸乙腈回收率过高,1%醋酸乙腈和5%醋酸乙腈的回收率相近,基于节省成本、溶剂浪费和环境保护的角度,选择1%醋酸乙腈作为人工土中乙虫腈的提取剂。考察5种净化剂组合(20 mg C18+150 mg无水MgSO4;40 mg C18+150 mg无 水MgSO4;50 mg C18+150 mg无 水MgSO4;40 mg PSA+150 mg无水MgSO4;50 mg PSA+150 mg无水MgSO4),最终选择50 mg C18+150 mg无水MgSO4作为净化剂。
按2.2.1方法进行试验,得出(+)-乙虫腈在人工土中的线性方程为y=216.89x+10 503,R2=0.999 0;(-)-乙虫腈的线性方程为y=202.74x+10 054,R2=0.999 0。通过对精密度和准确度验证,和回收率的计算(添加回收试验中的样品峰面积比上基质标峰面积×100%),(+)-乙虫腈的回收率为86.8%~107.0%,RSD为3.6%~4.4%;(-)-乙虫腈的回收率为89.5%~107.4%,RSD为2.4%~8.0%。
2.2 蚯蚓在单体浓度为0.5 mg·kg-1条件下的累积行为
试验结果显示,人工土中的乙虫腈对映体在前21 d内表现稳定,但是在28 d时,(+)-乙虫腈浓度降解较大,降解率超过20%,根据OECD准则要求,第21天的降解率未超过20%,因此在21 d换土更合适。蚯蚓体内的乙虫腈单体浓度在2 d达到最大值,随后蚯蚓体内的乙虫腈单体浓度不断降低,最终在14 d达到最低值,之后保持平稳状态到28 d。
蚯蚓体内的EF值变化情况如图1所示,随着暴露时间的增加,蚯蚓体内乙虫腈对映体的EF值不断降低。这说明蚯蚓更倾向于吸收(-)-乙虫腈。
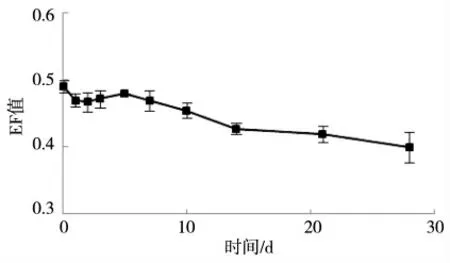
图1 0.5 mg·kg-1浓度下蚯蚓体内乙虫腈对映体的EF值
2个对映体的BSAF计算结果如图2所示,随着暴露时间增加,BSAF值在第2天达到最高,随后不断降低,最终趋于平稳。
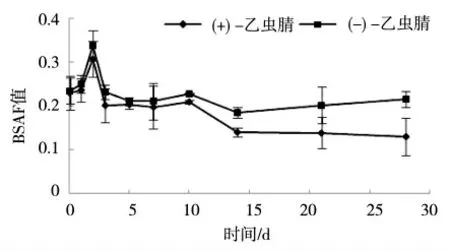
图2 0.5 mg·kg-1浓度下蚯蚓体内乙虫腈对映体的BSAF值
2.3 蚯蚓在5.0 mg·kg-1条件下的累积行为
乙虫腈对映体在人工土中表现稳定。蚯蚓体内(-)-乙虫腈和(+)-乙虫腈在第3天达到最大值,随后在14 d达到最低值,之后保持平稳状态到28 d。蚯蚓体内的EF值如图3所示。蚯蚓在吸收乙虫腈对映体过程中存在选择性,更易吸收(-)-乙虫腈。BSAF结果如图4所示,(+)-乙虫腈在第2天达到峰值,随后开始不断下降。(-)-乙虫腈在第3天达到峰值,随后开始不断下降。(+)-乙虫腈的BSAF值为0.05~0.23,(-)-乙虫腈的BSAF值为0.09~0.27。

图3 5.0 mg·kg-1浓度下蚯蚓体内乙虫腈对映体的EF值
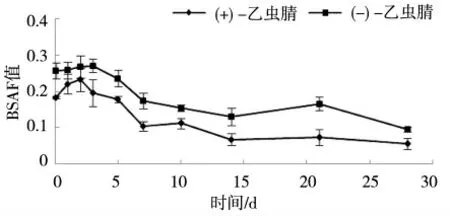
图4 5.0 mg·kg-1浓度下蚯蚓体内乙虫腈对映体的BSAF值
2.4 蚯蚓在12.5 mg·kg-1条件下的累积行为
试验结果显示,乙虫腈对映体在人工土中表现稳定。蚯蚓体内乙虫腈对映体EF值变化情况由图5所示。蚯蚓体内乙虫腈的EF值低于0.5,说明(-)-乙虫腈优先被累积,存在对映体选择性。两个对映体的BSAF计算结果如图6所示,(+)-乙虫腈的BSAF值均小于(-)-乙虫腈,说明(-)-乙虫腈在蚯蚓体内的浓度高。(+)-乙虫腈的BSAF值为0.04~0.12,(-)-乙虫腈的BSAF值为0.07~0.17。
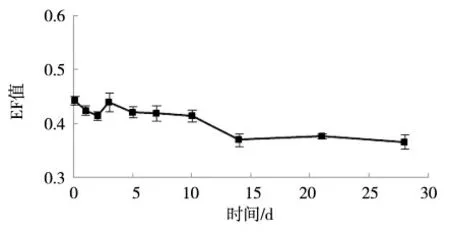
图5 12.5 mg·kg-1浓度下蚯蚓体内乙虫腈对映体的EF值
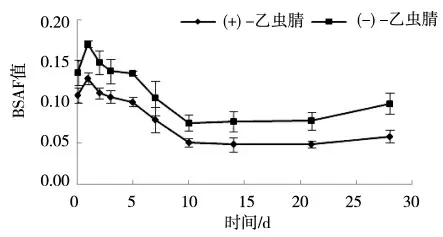
图6 12.5 mg·kg-1浓度下蚯蚓体内乙虫腈对映体的BSAF值
在低中高3个浓度组中,乙虫腈对映体在人工土中不易降解。3个浓度组中,蚯蚓体内的EF值均低于0.5,这表明蚯蚓对(-)-乙虫腈优先在蚯蚓体内富集。
2.5 不同浓度下蚯蚓体内单体累积量
空白对照组中,蚯蚓体内并未检测出(+)-乙虫腈。由图7可以看出,在0.5 mg·kg-1处理组中,蚯蚓体内(+)-乙虫腈累积量在第2天达到最高值,与其他时间点的蓄积量差异显著(P<0.05),之后开始下降,在第7天略有升高后,第10天开始下降,然后保持平稳状态。在5.0 mg·kg-1处理组中,蚯蚓体内(+)-乙虫腈在第2天达到峰值,与其他时间点的蓄积量差异显著(P<0.05),第3天开始下降,在第10天升高之后下降并保持平稳。在12.5 mg·kg-1处理组中,蚯蚓体内(+)-乙虫腈在第1天达到最高浓度,与其他时间点的蓄积量差异显著(P<0.05),在第10天下降到最低,之后保持稳定状态。

图7 蚯蚓体内(+)-乙虫腈的累积浓度
空白对照组中,蚯蚓体内并未检测出(-)-乙虫腈。从图8中可以看出,在0.5 mg·kg-1处理组中,蚯蚓体内(-)-乙虫腈累积量在第2天达到最高,与其他时间点的蓄积量差异显著(P<0.05),在第14天达到最低,接下来保持平稳。在5.0 mg·kg-1处理组中,(-)-乙虫腈累积量在第2天达到最高,与其他时间点的蓄积量差异显著(P<0.05),然后开始降低,最终保持稳态。在12.5 mg·kg-1处理组中,(-)-乙虫腈累积量在第1天达到最高,与其他时间点的蓄积量差异显著(P<0.05),然后开始降低,最终保持稳定状态。

图8 蚯蚓体内(-)-乙虫腈的累积浓度
3 讨论与结论
3.1 讨论
乙虫腈在蚯蚓体内累积行为试验结果显示,乙虫腈在中性土壤中表现稳定,这与田发军[11]和梁旭阳[12]得出的结论一致。但是,在0.5 mg·kg-1的人工土处理组中,前21 d EF值表现平稳,在第28天(+)-乙虫腈浓度降低,导致人工土中的乙虫腈EF值降低。此时(+)-乙虫腈降解率超过20%,21 d的降解率低于20%。因此,在21 d时更换人工土,更换土壤后EF值表现平稳。本研究结果与高成玲[13]的呋虫胺在蚯蚓体内富集研究相似。
在0.5、5.0 mg·kg-1处理组中,(+)-乙虫腈和(-)-乙虫腈在第2天达到最高,此时蚯蚓体内蓄积量与其他时间点的蓄积量差异显著(P<0.05),第14、21、28天差异不显著(P>0.05),达到稳态。在12.5 mg·kg-1处理组中,(+)-乙虫腈和(-)-乙虫腈在第1天达到最高,此时蚯蚓体内蓄积量与其他时间点的蓄积量差异显著(P<0.05),第10、14、21、28天差异不显著(P>0.05),达到稳态。这说明乙虫腈生物累积主要发生在前期,污染程度越大,蓄积量越高。杨广斌等[14]做过毒死蜱对蚯蚓累积特征研究,其结果与本研究类似。
通过3组乙虫腈对映体的BSAF值对比笔者发现,随着暴露浓度的增加,BSAF值反而降低。这种现象同样出现在溴敌隆[15]和全氟烷基物质[16]中。原因可能是在高浓度的土壤或者沉积物中,生物体内可用于吸附的结合位点饱和疏水有机物的抗解吸性导致。Kelly等[17]在研究中表示log Kow在2~5的范围内代表可能有吸附和累积的潜力。在PPDB(农药特性数据库)中获得的乙虫腈的logKow为1.99小于2。因此,乙虫腈对映体在蚯蚓体内累积的可能性很低。高成玲[13]做过呋虫胺在蚯蚓体内的富集行为研究,本研究结果与其相似。
3.2 结论
本研究建立了一种蚯蚓和人工土中的乙虫腈对映体的超临界流体-串联质谱检测方法,该方法的灵敏度、精密度、准确度均符合检测要求,具有绿色、简便、快捷的特点,可用于处理人工土壤和蚯蚓。蚯蚓对乙虫腈对映体吸收具有选择性。在3组不同浓度人工土中,蚯蚓对乙虫腈对映体均不存在生物累积效应。但土壤中污染物浓度越大,蚯蚓体内前期累积量越大。这项工作为今后乙虫腈的生物累积提供了基础数据,可作为环境风险评估的参考。
