不同浓度Fe2+对蛋白激发子AMEP聚合状态以及活性的影响
2023-02-18张襄郏刘铭赖思彤
张襄郏,刘铭,赖思彤,刘 权
(黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163319)
农药是不可或缺的农业生产资料,在控制农业有害生物,促进农业丰产与农民增收,保障国家粮食安全等方面发挥着极其重要的作用。农药的使用实践表明,农药使用可挽回全世界农作物总产30%~40%的损失[1-2]。
广义的生物农药,即生物源农药,是指直接利用生物活体或生物代谢过程产生的具有生物活性的物质,或从生物体提取的物质,以及人工合成的与天然化合物结构相同的物质,作为防治农林作物病、虫、草、鼠害的农药。狭义的生物农药,是指直接利用生物活体(微生物、动物、植物)作为农药[3-4]。本试验研究的AMEP蛋白多聚体属于广义上的生物农药。生物农药作为国家生物农业产业中重要的组成部分,在农作物病虫害防治上发挥着不可或缺的作用。由于生物农药具有自然降解快、对病虫害选择性强、对人畜毒性低等特点,被广泛应用于农业生产中病虫害防治,特别是在无公害和有机农业生产领域。生物农药已成为保障人类健康和农业可持续发展的重要手段[5]。
许多蛋白质激发子已从多种病原体中分离出来,包括细菌中的鞭毛蛋白和harpin[6-7],真菌木聚糖酶[8],酵母转化酶[9]和卵菌激发素[10]。然而,一些来自生防菌株的蛋白质激发子也被报道可激发抗病性,如来自枯草芽孢杆菌(Bacillus subtilis)的Fengycins和Surfacetins[11],来自液化淀粉芽孢杆菌的PEBA1[12]和Bar11[13]。本试验从枯草芽孢杆菌BU412中分离鉴定得到一种新型的AMEP蛋白多聚合体[14],它能够引起烟草的过敏反应,同时还可引起烟草的早期防御反应,如活性氧(H2O2和O2-)的产生和防御酶的激发,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL),以及激发烟草对灰霉病产生抗性。该蛋白兼具拮抗植物病原菌和激发植物抗逆能力的效果,是蛋白类生物农药的理想候选。
本试验通过Fe2+对蛋白质聚合状态的影响及其与蛋白功能活性的相互关系,筛选获得AMEP蛋白的不同多聚体状态,并检测不同聚合状态下该蛋白的抗菌和激发免疫功能活性,并通过过敏反应试验和灰霉抗病试验确定Fe2+对AMEP蛋白影响作用,为Fe2+与AMEP蛋白的混合使用提供理论依据。
1 材料与方法
1.1 材料
试验所用的菌株为枯草芽孢杆菌BU412保存于中国典型培养物保藏中心(CCTCCM2016142),用于提取制备AMEP蛋白。烟草植株(Nicotiana tabacum)用于过敏反应试验,本氏烟(Nicotiana benthamiana)用于灰霉菌接病试验。灰霉菌株(Botrytiscinerea)为本实验室保存。
主要试剂包括酵母提取物、葡萄糖、胰蛋白胨、氯化钠、磷酸缓冲液、核黄素、NBT、邻苯二酚、Tris、HCl、FeSO4·7H2O、L-苯丙氨酸溶液、愈创木酚、L-甲硫氨酸、氯化钠、硫酸铜、氯化锰、氯化镁、氯化钾、硫酸钙、氯化铁、硫酸亚铁、氯化镍和硫酸锌。
主要试验器材包括立式高温灭菌锅、磁力加热搅拌器、电子天平、pH计、恒温水浴锅、恒温培养箱、超微量分光光度计、心机、台式离心机、紫外微量分光光度计、摇床震荡器、漩涡混匀器、研钵、超净工作台、AKTA purifier蛋白纯化仪等。
1.2 AMEP蛋白的制备
1.2.1 培养基的配制 LB培养基(g·L-1):酵母提取物5.0,胰蛋白胨10.0,氯化钠10.0,pH 7.0;YME培养基(g·L-1):酵母提取物4.0,麦芽提取物10.0,葡萄糖4.0,pH 7.2。分装后,进行120℃高压蒸汽灭菌。
1.2.2 菌种活化及接种发酵 将枯草芽孢杆菌BU412的单菌落接种在3 mLLB液体培养基的试管中,于30℃、170 r·min-1培养过夜。将培养液按照1∶100的比例再次接种至300 mL YME液体培养基中,于30℃、170 r·min-1培养24 h。
1.2.3 蛋白的分离纯化 待发酵24 h后,将培养液以4℃、11 000 r·min-1条件下离心15 min,得到上清液,并通过0.22μm膜过滤上清液,将过滤后的粗酶液进行进一步纯化,使用20 mmol·L-1Tris-HCl(pH 7.5)的缓冲液预先平衡DEAE阴离子交换树脂,将离心后的上清液穿过DEAE阴离子交换树脂,使用含有1 mol·L-1NaCl的缓冲液进行洗脱,收集蛋白样品。将收集的蛋白溶液放入冰箱保存。
1.2.4 蛋白的浓缩 预先使用超纯水清洗超滤管,然后使用移液器将收集到的蛋白溶液转移到5 mL 30 KD的超滤管中,经配平后在4℃、4 000 r·min-1的条件下超滤浓缩,待浓缩至1.5 mL时,在使用移液器向超滤管中加入低盐溶液至原体积,在进行超滤浓缩至1.5 mL。重复加低盐操作3次后,使用移液枪吸取上方蛋白溶液,弃去下方溶液。
1.2.5 蛋白的处理 采用单因素和多级试验设计方法对粗酶液进行添加金属离子处理。离子种类和浓度:钠离子、铜离子、锰离子、镁离子、钾离子、钙离子、亚铁离子、镍离子和锌离子,浓度均为0.005g·L-1。将不同金属离子处理过的粗酶液注入AKTA纯化仪中,用凝胶过滤柱进行分离,流速1 mL·min-1,检测波长280 nm,每隔4.8 s读数1次,利用Excel绘制出图表,分析不同金属离子对AMEP蛋白质聚合状态的影响。
1.3 多聚体的获得
1.3.1 蛋白浓度的测定及稀释 对得到的相对分子质量为30 KD以上的蛋白浓缩液使用超微量分光光度计测定浓度,再根据测得的浓度用低盐将其稀释至1 mg·mL-1。
1.3.2 不同Fe2+浓度蛋白质多聚体的制备 分别将浓度为0.2、0.4、0.5 g·L-1Fe2+处理过的蛋白溶液注入AKTA纯化仪中,用凝胶过滤柱进行分离,流速1 mL·min-1,检测波长280 nm,每隔4.8 s读数1次,利用Excel绘制出图表,分析不同浓度Fe2+离子对AMEP蛋白质聚合状态的影响。
1.4 过敏反应
各取0.5 mL浓度为1 mg·mL-1的蛋白溶液与不同浓度的FeSO4溶液混合,分别得到1 mL浓度为0.03、0.3、3 g·L-1亚铁离子的蛋白溶液,用于后续试验。采用烟草6周龄植株诱导抗病试验,以不加入硫酸亚铁的同等浓度的蛋白溶液作对照,使用1mL注射器将上述不同聚合程度的蛋白溶液从烟草叶片背面渗透到叶片中,覆盖1 cm2的面积,放入室温、湿润、遮光的环境下,于24h观察渗透区坏死情况并分析。
1.5 酶的活力测定
1.5.1 前处理 使用棉签将上述不同聚合程度的蛋白溶液均匀涂抹到同等生长状况的大烟草叶片上并做好标记,以不加入硫酸亚铁的同等浓度的蛋白溶液为处理、低盐溶液为对照。并用薄膜遮罩保湿,于24 h后进行测酶活试验。
1.5.2 酶液的制备 用预冷的研钵将烟草叶片0.4 g和pH值为7.8的磷酸缓冲液4 mL,冰水浴中研磨,使用移液器将研磨匀浆转入离心管中,4℃条件下,10 000 r·min-1离心20 min后再将上清液转入新的离心管中待用。
1.5.3 超氧化物歧化酶(SOD)活力测定 预先配制SOD反应液,将pH值为7.8的磷酸缓冲液、1 mg·mL-1的EDTA-2Na、20 mg·mL-1的L-甲硫氨酸、0.1mg·mL-1的核黄素、1mg·mL-1的NBT。按照此顺序且体积比为15.5∶1∶1∶1∶1的比例来配制SOD反应液。
选取型号相同的试管洗净后晾干,向试管中加入3 mL反应液,再吸取50μL的酶液并混匀。并把所有试管放置于4 000 lx光照条件下30 min,同时取4个试管(全不加酶液的磷酸缓冲液),3个作对照,1个作空白;空白置于暗处,对照与混合液光照条件相同,30 min后取出所有试管遮光保存,在560 nm下以空白调零,测吸光度。
1.5.4 过氧化物酶(POD)活力测定 预先配制POD反应液,用pH值为6的磷酸缓冲液配制0.3%的愈创木酚溶液、用蒸馏水配制0.3%的过氧化氢溶液。最后按照80∶1的比例配制POD反应液。在洗净晾干的试管中加入3 mL反应液,再加入50μL酶液摇匀,在470 nm下测吸光度(测量前取只试管加入3 mL反应液调零),每隔1 min读数1次,共读3 min并做好记录。用每分钟内OD值变化0.01为1个过氧化物酶活性单位(U)表示。
1.5.5 多酚氧化酶(PPO)活力测定 首先配制pH值为6的磷酸缓冲液,再配制0.1 mol·L-1的邻苯二酚。随后向洗净后晾干的试管中加入pH值为6的磷酸缓冲液2 mL和0.1 mol·L-1邻苯二酚1 mL,充分混匀后在37℃水浴锅中水浴10 min后迅速加入70μL酶液并混匀,在420 nm下测吸光度,每15 s读数1次,共读45 s并做好记录。
1.5.6 苯丙氨酸解氨酶(PAL)活力测定 预先配制pH值为7.8的磷酸缓冲液、再配制0.02 mol·L-1的L-苯丙氨酸溶液。配完后向试管中加入500μL酶液,磷酸缓冲液2.5 mL。混匀后在30℃水浴锅中水浴30 min,水浴后向试管中加入6 mol·L-1HCl 0.2 mL终止反应,然后在290 nm下测量吸光度。
1.6 灰霉抗病试验
1.6.1 预处理 选取同等生长状况的小烟草叶片,使用棉签将上述不同聚合程度的蛋白溶液均匀涂抹到同等生长状况的小烟草叶片上并做好标记,以不加入硫酸亚铁的同等浓度的蛋白溶液为处理、低盐溶液为对照。并用薄膜对涂抹完蛋白的小烟草进行遮罩保湿,于24 h后进行灰霉接种。具体分组处理为:“CK”组在叶片上涂抹低盐溶液后接种灰霉,“1”组在叶片上涂抹不含Fe2+的AMEP蛋白溶液后接种灰霉,“2”组在叶片上涂抹含低浓度Fe2+的AMEP蛋白后接种灰霉,“3”组在叶片上涂抹含中浓度Fe2+的AMEP蛋白后接种灰霉,“4”组在叶片上涂抹含高浓度Fe2+的AMEP蛋白后接种灰霉。
1.6.2 接种 用剪刀剪下做好标记的小烟草叶片,并在小烟草背面放置事先培养的灰霉(含有灰霉菌丝的琼脂块),放入室温、湿润、遮光环境下,于24 h后观察叶片的灰霉染病(透明圈)情况并拍照。
2 结果与分析
2.1 不同金属离子对蛋白质聚合体状态的影响
如图1所示,在11.04 min时,FeSO4·7H2O处理组有1个明显的吸收峰,经测定为目标蛋白吸收峰,故选择FeSO4·7H2O为最佳金属离子进行后续试验。

图1 不同金属离子对蛋白质聚合体状态的影响
2.2 不同Fe2+浓度对蛋白质聚合体状态的影响
如图2所示,在试验组中,亚铁离子浓度的变化会对AMEP蛋白的聚合状态产生相应的影响,而AMEP蛋白聚合状态的变化对蛋白质功能的影响还不确定,需要进一步检测不同亚铁离子浓度对AMEP蛋白功能的影响。

图2 不同浓度亚铁离子对蛋白质聚合状态的影响
2.3 不同浓度Fe2+对AMEP过敏反应活性的影响
本试验分别用0.03、0.3、3 g·L-1Fe2+和AMEP的混合溶液通过无针注射器注射,将溶液渗透到烟草叶片背面中,AMEP蛋白与经过亚铁离子处理过后的AMEP蛋白均可以引起烟草过敏反应,如图3所示。其中,以0.03 g·L-1Fe2+处理的AMEP蛋白最为明显,3 g·L-1Fe2+显著抑制AMEP蛋白的活性。如图3所示,A为对照,即不加入Fe2+,仅使用蛋白溶液;B为低浓度组,即Fe2+浓度为0.03 g·L-1的蛋白溶液;C为中浓度组,即Fe2+浓度为0.3 g·L-1的蛋白溶液;D为高浓度组,即Fe2+浓度为3 g·L-1的蛋白溶液。结果发现,硫酸亚铁浓度为0.03、0.3 g·L-1的处理组的过敏反应症状比对照明显,而3 g·L-1的硫酸亚铁处理组的过敏反应症状与对照没有明显差别(图3)。推测亚铁离子会增加AMEP412蛋白的聚合度,在低聚合度区间能够增强蛋白活性,而当亚铁离子浓度过高时,AMEP412蛋白的聚合度过大,反而会阻碍其与植物细胞的互作。因此施用时缓冲液中Fe2+的浓度为0.03~0.3 g·L-1为适宜。

图3 不同浓度的Fe2+对AMEP蛋白过敏反应活性的影响
2.4 不同浓度Fe2+下AMEP蛋白对烟草叶片酶活的影响
试验根据向AMEP蛋白溶液加入Fe2+浓度的不同分为4个组,即“处理”组、“低”组、“中”组、“高”组,分别对应的Fe2+浓度为0、0.03、0.3、3 g·L-1,并将仅涂抹低盐溶液的叶片设置为对照组。如图4所示,向AMEP蛋白溶液加入不同浓度的Fe2+后,酶的活性有不同程度的变化。在PAL、SOD酶活试验中,与处理组相比,低浓度组的酶活明显提高,高浓度组的酶活则降低,说明低浓度Fe2+增强其活性,高浓度Fe2+抑制其活性;在POD、PPO酶活试验中,3种浓度组的酶活均低于处理组,即Fe2+会抑制AMEP蛋白对POD、PPO酶的激发作用,且抑制效果随着Fe2+浓度的增加而增强,其中PPO酶尤为明显,但与对照组相比,处理组的酶活明显提高,说明AMEP蛋白能增强POD、PPO酶活性,加入Fe2+后抑制了其活性。
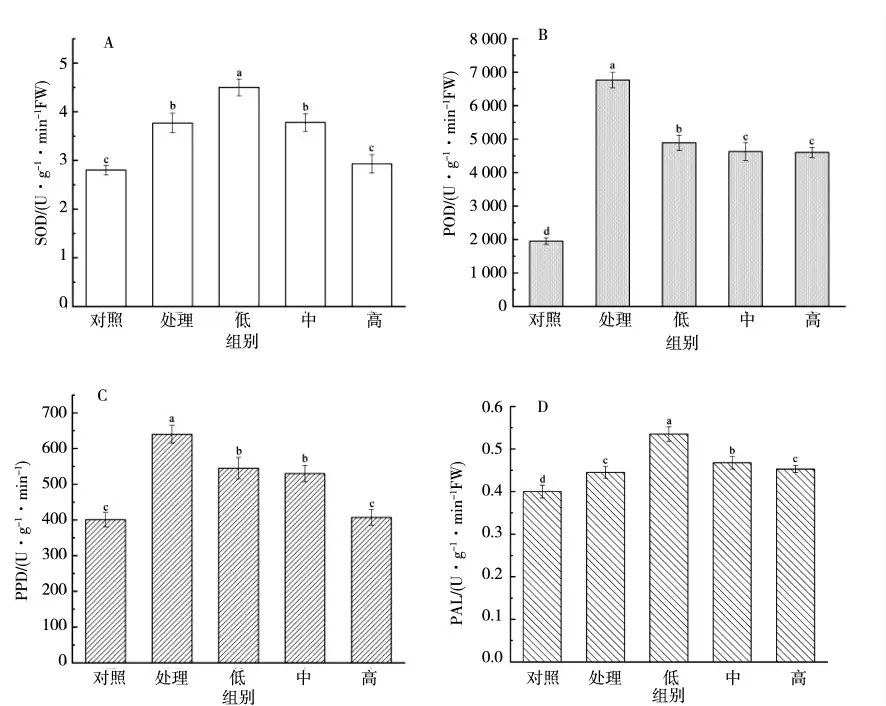
图4 4种酶活性与不同浓度的Fe2+关系
2.5 不同浓度Fe2+下AMEP蛋白对烟草抗灰霉病效果的影响
如图5所示,对照组为在叶片上涂抹低盐溶液后接种灰霉,处理组为在叶片上涂抹不含Fe2+的蛋白溶液后接种灰霉,低Fe2+组为在叶片上涂抹含低浓度Fe2+的蛋白后接种灰霉,中Fe2+组为在叶片上涂抹含中浓度Fe2+的蛋白后接种灰霉,高Fe2+组为在叶片上涂抹含高浓度Fe2+的蛋白后接种灰霉。结果显示,没有蛋白涂抹的对照组叶片透明圈最大,即灰霉侵染最严重,处理组由于涂抹了蛋白溶液,进而增强了叶片的抗病性,透明圈显著缩小。低Fe2+组没有透明圈,即暂时没有被灰霉侵染,说明低浓度Fe2+增强了蛋白的活性。高Fe2+组的透明圈比处理组的大而又比对照组的小,说明高浓度Fe2+并不能增强蛋白的活性,反而会使蛋白溶液活性受到抑制。

图5 灰霉抗病处理组
3 讨论与结论
近年来,金属离子对牛乳中β-乳球蛋白聚合的研究越来越多。有学者在对牛乳中β-乳球蛋白的研究中提出Ca2+参与β-乳球蛋白聚合有3种可能:第1种是二价阳离子与邻近的带负电的基团或羧基结合形成“蛋白-Ca-蛋白”聚合体;第2种是金属离子的加入,降低蛋白分子间的静电斥力,促进其聚合;第3种是金属离子诱导蛋白分子结构的改变,分子间的疏水相互作用随之改变,诱导分子间聚合[15-16]。
本试验主要研究Fe2+浓度对AMEP蛋白活性的影响,通过使用含不同浓度Fe2+的蛋白溶液处理烟草叶片,并分别从过敏性、抗灰霉性、酶活3个方面对烟草进行检测。从试验结果可以看出,低浓度的Fe2+会增强AMEP蛋白的活性,反应如活性氧(H2O2和的产生和防御酶的激发,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL),以及对灰霉病的抗性,高浓度Fe2+则会稍微减弱AMEP蛋白的活性。
谢秀玲[14]发现,不同离子浓度会诱导蛋白质形成不同聚合物。当β-乳球蛋白与金属离子的摩尔比是1∶1时,聚合作用最强,二聚体含量最多。有研究报道,1个β-乳球蛋白分子含有1个游离的巯基,当巯基氧化后,可结合1个金属离子,金属离子进而催化其形成聚合体[17]。因此,1∶1是最佳的金属离子和β-乳球蛋白的摩尔比。本试验据此设置对应浓度Fe2+(即低浓度)与AMEP蛋白进行结合,并在此基础上又设置了2个Fe2+浓度(即中浓度和高浓度),当亚铁离子与蛋白分子发生相遇时,不同浓度的亚铁离子促使AMEP蛋白质形成不同聚合程度的聚合体,造成蛋白质的活性部位暴露程度不同,从而影响蛋白质在烟草过敏反应试验中的活性。最终结果表明,低浓度Fe2+会加强AMEP活性,原因可能是此浓度的Fe2+使AMEP蛋白形成了更多适宜其发挥蛋白性能的多聚体,即保存其能更好地保存酶解位点使其不易被酶分解又能很好地发挥其性能的中间状态。然而,过高浓度的亚铁离子溶液会使得蛋白质聚合程度过大,形成的蛋白质多聚体难以附着在细胞表面,造成AMEP蛋白质对烟草细胞的亲和力下降,从而大大降低了蛋白质的活性。
本研究通过酶活检测得出结论,向蛋白溶液加入不同浓度的Fe2+后,PAL、SOD、POD、PPO酶活均有不同程度的提高,其中低浓度组的酶活提高得更明显。PAL和SOD中高浓度组酶活较对照组低,说明高浓度Fe2+下的蛋白溶液会抑制其活性;POD和PPO中高浓度组的酶活虽然没有低浓度组的高,但是相较于对照组酶活仍有提高,说明高浓度Fe2+下的蛋白溶液不会抑制其活性。又通过过敏反应试验和灰霉抗病试验进一步确定低浓度Fe2+能够提高AMEP蛋白活性,高浓度Fe2+则会抑制AMEP蛋白活性。该结论说明合理的利用Fe2+可以增强AMEP蛋白的功能活性,为今后AMEP蛋白的应用提供基础资料。
