镉胁迫对玉米幼苗光合特性及活性氧代谢的影响
2023-02-18王金香张阿良曹江梅郭瑞瑞
王金香,张阿良,秦 敏,曹江梅,陈 文,郭瑞瑞
(山西大同大学 农学与生命科学学院 山西大同大学设施农业技术研发中心,山西 大同 037009)
由于人类对镉(Cd)的开发、冶炼、加工和利用,大量的Cd不可避免被排放到空气、水和土壤当中,造成严重环境污染。2014年全国土壤调查结果显示,Cd污染超标率达到7%。镉离子(Cd2+)易溶于水、毒性强且不易被降解,会通过根系被植物不断吸收并通过食物链传递积累到不同生物体中,更加剧了对生态系统和人类的威胁。
作为一种植物非必需重金属元素,Cd2+会抑制发芽水稻种子中淀粉酶活性,减少种子萌发所需的物质和能量,降低种子发芽率并影响幼苗的后续生长[1-2]。大蒜根系受到Cd2+胁迫后出现质壁分离现象,细胞壁明显增厚,细胞器严重受损,细胞液泡化程度提高,核质高度凝集[3]。高浓度Cd2+能造成水稻根毛细胞膜的去极化,影响质膜上K+通道开放,导致根系内K+外渗,造成K元素缺失和离子失衡,影响根对水分和矿物质的吸收和运输[4]。Cd2+的存在同样影响叶片的发育,导致气孔数量减少、气孔闭合率发生变化,叶绿素的合成受阻、叶绿体结构破坏,引发叶片枯黄失绿,植株的生长被抑制[5-6]。高浓度Cd2+抑制小麦旗叶的生长,直接或间接影响到开花相关基因的表达,对植物的开花和成花过程产生毒性效应,造成小麦籽粒产量下降和Cd2+含量超标,最终影响植物的产量和品质[2,7]。
玉米是中国北方地区主要的粮食作物,种植范围广、生物量大,具有较强的Cd2+吸附能力。但玉米幼苗生长期对Cd2+十分敏感,是最先受土壤Cd2+污染危害的阶段。宇克莉等[8]报道,高浓度Cd2+处理后玉米幼苗生长受到明显抑制,细胞膜系统破坏明显,细胞器损伤严重。刘建新等[9]研究证实,Cd2+胁迫不仅抑制幼苗的生长发育和干物质积累,而且会影响抗氧化酶活性,打破机体的氧化代谢平衡,引起生物毒性。本研究将进一步探讨玉米苗期Cd2+的积累,叶绿素、净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和叶间CO2浓度(Ci)与Cd2+变化的相关模式,探索不同Cd2+浓度对幼苗叶片抗氧化酶系统及抗氧化物质、活性氧生成、膜脂过氧化的影响,以揭示Cd2+胁迫对玉米光合特性和活性氧代谢的影响。
1 材料与方法
1.1 植物材料与设计
挑选颗粒饱满、大小一致的玉米种子(ZeamaysL.,‘农大108’)经次氯酸钠浸种、清水漂洗后放到培养盘中,在25℃恒温培养箱遮光萌发24 h,选取发芽一致种子放于盛有Hoagland营养液的圆形塑料盆中水培生长,光照强度200μmol·m-2·s-1和温度28℃/22℃(14 h/10 h)(昼/夜)。每盆放置20粒种子,每2 d更换1次营养液。当第3片叶片完全伸展时,幼苗分别用0、100、200、400μmol·L-1CdCl2溶液中处理72 h,每组设3个重复。
1.2 测定方法
将幼苗根部用水冲洗干净后,取根、茎、叶,剪碎后微波消解仪进行消化,用火焰原子分光光度计测定组织中Cd2+含量,生长量测定用烘干称质量法。叶绿素含量测定参照文献[10]。叶片光合特性采用Yaxin-1102便携式光合蒸腾仪测定,在室外对玉米第三片叶Pn、Tr、Gs和Ci测定,每天11:00—14:00进行测定,天气条件:晴天,室外温度为21~23℃,每个处理选3株幼苗测定。
SOD活性、CAT活性和H2O2含量测定采用Jiang等方法[11]。H2O2组织化学染色法采用3,3-二氨基联苯胺(DAB)染色法检测[12];GSH含量测定采用二硫代双二硝基苯甲酸(DTNB)方法[13],MDA含量测定采用硫代巴比妥酸法[14]。
1.3 统计分析
用SPSS22.0统计软件,采用单因素ANOVALSD和Duncan’s多重比较检验法对数据进行分析处理,结果为3次独立试验平均值±标准差,不同小写字母表示P<0.05水平差异显著。
2 结果与分析
2.1 镉在幼苗组织中的积累
如表1所示,与对照相比,处理组根、茎和叶中Cd2+的含量极显著增加。根中,100μmol·L-1处理组Cd2+积累量最大,但处理组间无差异。茎中,3个处理组Cd2+均低于同处理组根的积累,且随Cd2+浓度增加,积累量增加,但组间无显著差异。叶中,Cd2+的积累量均低于同处理组根和茎的量,400μmol·L-1处理组Cd2+的积累量最多,200μmol·L-1处理组最少。
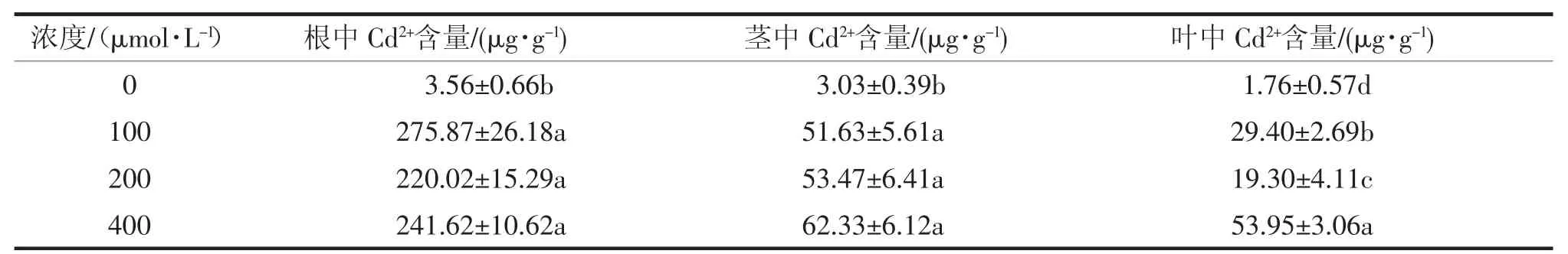
表1 玉米幼苗根、茎、叶中Cd2+的积累(72 h)
2.2 镉对幼苗形态和叶绿素含量的影响
如图1-A所示,对照组幼苗生长旺盛,植株挺立,叶片伸展,叶色鲜绿;100μmol·L-1Cd2+处理后叶片缺水,半数叶片下垂、皱缩,少数叶色发黄;200μmol·L-1Cd2+引起多数叶片下垂、皱缩,叶片失水严重,少数叶色失绿变黄;当Cd2+浓度达到400 μmol·L-1,全部叶片都出现下垂、萎蔫,大多数叶色发黄,整个植株枯萎。从图1-B可以看出,Cd2+处理显著降低叶片中叶绿素含量,其中Cd2+浓度越高、处理时间越长,叶片中叶绿素含量越低;在72 h,3个处理组叶绿素含量显著下降,分别是对照组的68%、40%、29%。由图1-C可知,Cd2+处理后植株干物质积累显著下降,且浓度越高干物质积累越少,但处理组间无差异。
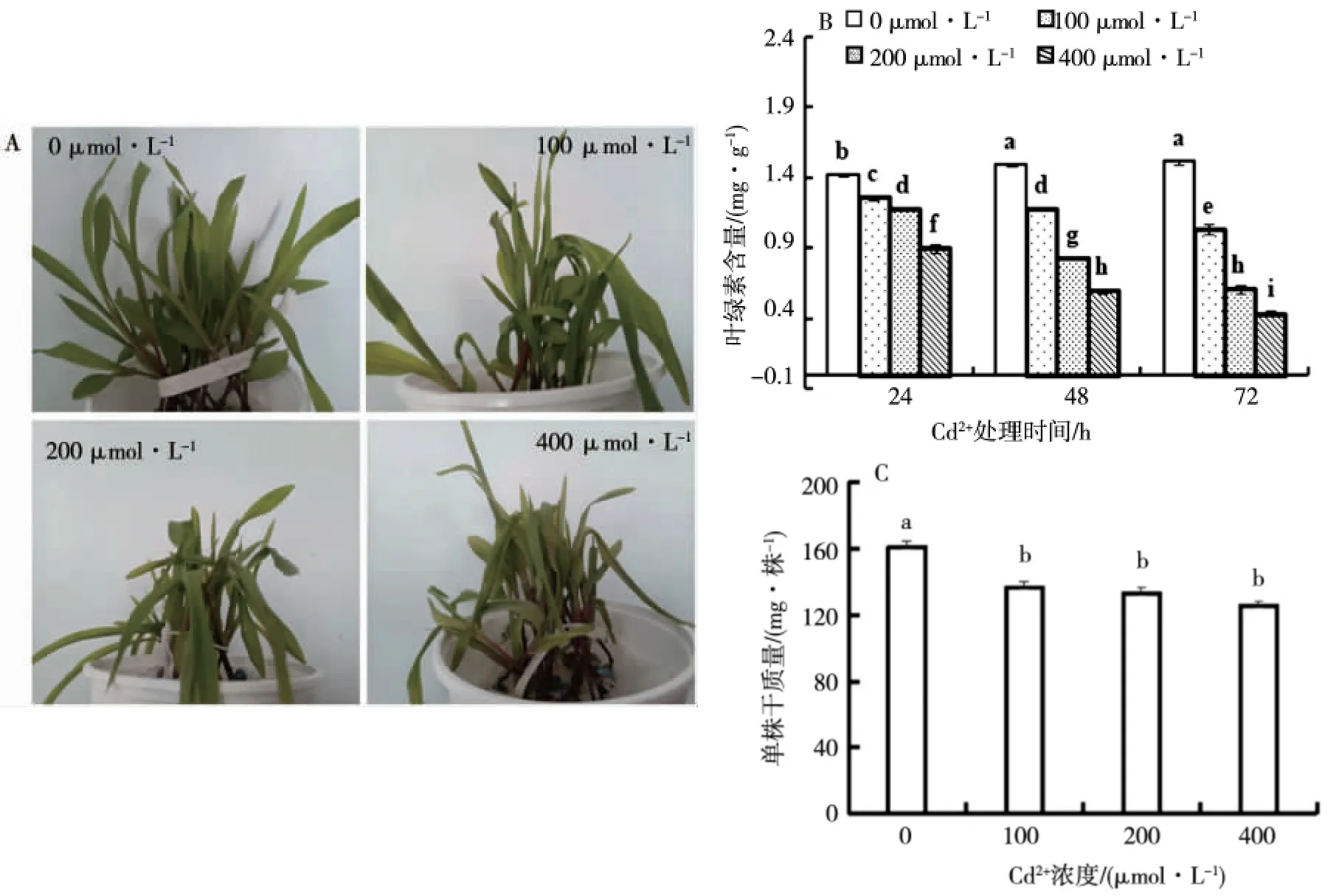
图1 Cd2+处理对玉米幼苗形态、叶绿素含量和单株干质量的影响
2.3 镉对幼苗叶片光合特性的影响
如表2所示,与对照组相比,Cd2+处理后幼苗叶片的Pn、Tr和Gs均显著降低,同时Pn、Tr和Gs与Cd2+浓度和处理时间无明显相关性,400μmol·L-1Cd2+处理72 h后Pn、Tr和Gs仅为对照的2.7%、5.8%、5.1%。叶片Ci变化趋势与Pn、Tr和Gs的变化相反,Cd2+处理后Ci显著增加,但无浓度和时间效应,在400μmol·L-1Cd2+处理72 h后Ci为对照的368%。Cd2+处理引起玉米叶片气孔降低,抑制光合作用和蒸腾作用,叶间CO2浓度升高。

表2 Cd2+处理对幼苗叶片光合特性的影响
2.4 镉对幼苗叶片中抗氧化酶和GSH含量的影响
如图2-A所示,与对照相比,Cd2+处理幼苗24 h后3个处理组SOD活性显著升高,分别是对照组的167%、160%、179%;处理48 h,除低浓度组(100 μmol·L-1)持续保持高活性外,中高浓度组(200、400 μmol·L-1)SOD活性逐渐下降;当处理时间延长至72 h,SOD活性全部低于对照组。由图2-B可知,Cd2+引起叶中CAT活性先升高后降低,低浓度和中浓度处理组CAT活性在48 h达到最大值,为对照的293%、242%,72 h后活性显著下降,中浓度组低于对照;高浓度组CAT活性在24 h到达最高,是对照的208%,之后活性显著下降,在72 h低于对照组。由图2-C可知,与对照相比,Cd2+处理组GSH含量均出现显著降低,且Cd2+浓度越高、处理时间越长,GSH含量越低;在72 h,3个Cd2+处理组GSH含量分别是对照的27%、21%、19%。GSH含量与Cd2+浓度和处理时间呈负相关性。

图2 Cd2+处理对叶片SOD活性(A)、CAT活性(B)和GSH含量(C)的影响
2.5 镉对叶片H2O2和MDA含量的影响
DAB与H2O2反应形成棕色复合物,棕色复合物量与H2O2含量成正比。如图3-A所示,对照组,只在叶的基部有少量棕色沉积物,但Cd2+处理后叶片中棕色复合物沿叶脉大量出现、颜色显著加深,说明正常生长的幼苗,叶片中H2O2含量少,但Cd2+处理后,H2O2大量积累。由图3-B可知,Cd2+处理后叶片中H2O2含量迅速增加,且Cd2+浓度越高、处理时间越长,H2O2含量越多;在72 h,处理组叶片中H2O2含量分别比对照增加163%、169%、185%。从图3-C可以看出,对照组MDA含量在整个试验过程中都处于一个较低的水平,而受到Cd2+处理后叶片MDA含量明显升高,并且具有浓度和时间效应。
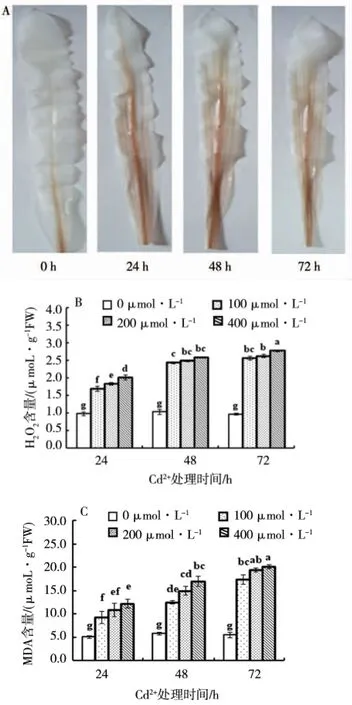
图3 Cd2+处理对叶片中H2O2积累和MDA含量的影响
3 讨论与结论
根是土壤Cd2+进入植物的第一道屏障,它可沿着细胞壁的空隙运输进入木质部,或与膜上的转运蛋白(如Fe2+转运载体、Ca2+通道以及Zn2+/Fe2+调控蛋白ZIP家族中的ZIP8和ZIP14等)结合进入根毛表皮细胞、或与根部分泌的小分子化合物如麦根酸等螯合通过YSL(yellow stripe like)蛋白进入根细胞,之后借助于细胞间的胞间连丝,经皮层、内皮层及周鞘进入根内导管细胞[15]。高溶解性的Cd2+借助于水的流动由地下向地上部分移动并进入到植物的茎和叶中。在本试验中急性Cd2+胁迫后大量Cd2+进入幼苗中,积累量是对照的37~42倍,其中67%以上积累在根部,茎次之,叶中积累最少。这种Cd2+在组织中的分布特点与大豆植株一致,既根系吸收和固定Cd2+能力最强、秸秆次之、叶和果实的吸收最低[16]。水稻幼苗中Cd2+的积累同样主要聚集在根部质外体空间,枝条中Cd2+的量远低于根中的量。Cd2+在组织中的积累特点与根的结构有极大关系,内皮层细胞壁上凯氏带作用导致质外体大部分Cd2+与细胞壁结合滞留在根部,其次根部植物螯合素、GSH、金属硫蛋白等含巯基物质在根中快速积累,共质体中大部分Cd2+与巯基结合,被限制在根部[17]。根系通过沉淀、络合和隔离作用富集大量Cd2+,进而减少Cd2+向地上部分的运输。随着Cd2+胁迫浓度和时间的持续增加,根的负荷超载,细胞内结合态的Cd2+含量占比开始降低,胞内可溶性组分中Cd2+含量占比升高,Cd2+遂由根经茎向叶中运输和积累[18]。
叶片是植物光合、蒸腾作用等重要生命活动发生的主要器官,虽然叶片中Cd2+的积累较少,但叶片对Cd2+的敏感度更高。叶绿体是进行光合作用的场所,叶绿素对光能的捕获和传递是光合作用的关键起始,其含量是植物光合作用能力和光合器官生理状况的重要指标。气孔是植物叶片与大气进行气体交换和水分蒸发的主要通道,其闭合程度直接影响光合作用、蒸腾作用及植物对水分和无机盐的吸收。叶绿素、Pn、Tr和Gs及Ci是幼苗长势和进行产量影响评估的基础。孙亚莉等[19]研究发现,Cd2+胁迫条件下,水稻叶片叶绿素含量、Pn、Gs、Tr和Ci均出现下降趋势。在本试验中Cd2+胁迫幼苗后,整个植株叶片低垂皱缩、叶色变黄,叶绿素含量明显减少且干物质积累减少;光合相关的指标Pn、Tr和Gs都显著下降,不及对照的10%,但与水稻幼苗不同的是Ci反向升高。与玉米表现一致的还有小麦,在受到Cd2+胁迫后其幼苗叶片光合色素含量、叶绿素荧光相关指标都出现下降[20]。惠俊爱等[21]报道,Cd2+影响叶绿素前体的合成,促进更多的ROS在细胞中增加,参与叶绿素的降解,降低叶绿素含量,造成植物失绿变黄。而且Cd2+的存在影响了保卫细胞中的K+、Ca2+等离子浓度和脱落酸,从而影响了气孔的开关,使Gs下降、Tr降低[21]。高浓度Cd2+胁迫下叶绿素含量下降、叶绿体膜结构破坏和类囊体的垛叠程度降低均使电子传递链受阻,PSⅡ光化学效率降低[20,22];同时叶片更通过关闭气孔和减少CO2吸收(碳同化)从而降低了Pn来减缓植物的生长速度,干物质积累减少。由于Cd2+对Pn的高抑制率(95%以上),导致细胞间CO2利用效率降低,胁迫过程中呼吸速率的加快,造成细胞间CO2的累积,使胞间CO2浓度上升。
H2O2积累是重金属毒性的主要原因之一,H2O2积累及随后造成的氧化胁迫和细胞的损伤是Cd2+诱导的生物毒性之一。蚕豆和姜幼苗在受到Cd2+处理时O2·—自由基生成速率和H2O2含量显著升高,膜脂过氧化水平加剧[8,9,23]。SOD催化O2·—自由基歧化生成O2和H2O2,CAT可将H2O2水解,2种酶前后依次作用将ROS清除。螯合肽(PCs)的合成是植物应对重金属胁迫的一种适应性反应,重金属与PCs螯合并转移至液泡中贮存,从而达到解毒效果。GSH是合成PCs的前体,一方面GSH本身携带有巯基,巯基可以和重金属结合降低细胞毒性,或合成PCs起到解毒的功效;同时,GSH中巯基又具有抗氧化作用,可还原自由基,降低对细胞产生的氧化损伤。高Cd2+环境中,SOD和CAT的活性表现及GSH含量的变化直接与细胞中H2O2积累及是否产生氧化胁迫相关,并最终影响个体存活。在本试验中对照组SOD、CAT活性和GSH含量都相对稳定,机体处于一个相对稳定的内环境,ROS水平低,氧化还原状态处于动态平衡。在Cd2+胁迫条件下SOD和CAT活性都出现先升高后下降的变化趋势,而且2种酶活性最大峰值出现时间与Cd2+浓度有紧密关系,低浓度组较高浓度组抗氧化酶活性峰值出现时间晚,并且峰值之后活性下降速度慢,表现为100μmol·L-1Cd2+胁迫组,SOD活性在48 h时达到最大,而200、400μmol·L-1Cd2+胁迫组,活性在24 h即达到峰值;CAT活性峰值出现的时间也随Cd2+浓度升高由48 h(100/200μmol·L-1组)前移至24 h(400μmol·L-1组);并且CAT活性比SOD持续时间更长,即机体在受到胁迫后SOD活性在24 h快速升高(活性提高59%~80%),48 h除低浓度组活性(提高70%)保持略有上升外,其余两个浓度组均快速下降(-42%,-22%),而CAT活性在24 h升高(活性提高30%~100%),48 h活性进一步上升了192%、142%、16%。机体最先启动SOD反应,将O2·—自由基分解产生H2O2和O2;当SOD活性最高时,机体中因SOD作用而产生大量H2O2,此时必须调控机体CAT活性不断升高,才能将大量H2O2分解,实现降低ROS功能。抗氧化物质GSH含量在Cd2+胁迫后出现下降,并且Cd2+处理时间越长、浓度越高GSH含量越低。这可能是Cd2+胁迫促进还原型谷胱甘肽(GSH)转化为氧化型谷胱甘肽(GSSG),激活ASA-GSH循环,在植物对Cd2+的吸收转运、累积与解毒中发挥重要作用[24]。
在正常生理情况下,植物体内活性氧可维持于有利无害的极低水平。短时间低浓度的Cd2+胁迫过程中植物抗氧化酶活性多出现适应性上升,同时抗氧化物质对离子的螯合和协同抗氧作用可以清除因胁迫而产生的多余ROS,维持机体氧化平衡,保持幼苗的正常生长和发育。而Cd2+浓度或胁迫时间一旦超过一定阈值,抗氧化酶活性被抑制,GSH系统抗氧能力下降,则ROS的产生速率大于其清除速率,机体中ROS含量升高,造成生物大分子(如脂类物质等)氧化损伤,进而引起细胞功能紊乱。姜对Cd2+较短期(40 d)胁迫或较低浓度Cd2+胁迫具有适应性,但胁迫120 d或过高浓度的Cd2+胁迫严重损伤了姜叶片抗氧化系统,使活性氧代谢失调,叶片膜系统遭到严重伤害[9]。本研究显示,正常生长的玉米幼苗,叶中H2O2含量都维持在一个相对较低的水平;随着Cd2+胁迫时间延长,叶中H2O2含量迅速增加,且MDA含量增加也说明ROS的积累已引发膜脂过氧化反应,造成膜结构破坏,植物光合作用和蒸腾作用停止。因此,幼苗叶片中MDA大量生成与Cd2+积累量的升高和H2O2积累相伴出现,加剧了幼苗生存的危机。
玉米幼苗在受到Cd2+胁迫后,根、茎和叶中Cd2+快速积累,积累量根>茎>叶;Cd2+引起叶绿素含量、Pn、Tr和Gs急剧降低,Ci显著升高,叶片萎蔫,且Cd2+浓度越高对植株的破坏力越强;机体抗氧化酶(SOD和CAT)及抗氧化物质(GSH)在胁迫早期抗氧化能力增强,;但当Cd2+浓度增加和胁迫持续进行时,叶片抗氧化力下降,叶中H2O2代谢失衡,脂质发生过氧化反应,叶片结构破坏,功能丧失。
