不同剂量托法替布联合甲氨蝶呤治疗类风湿关节炎疗效安全性分析及对血清因子水平的影响
2023-02-17张艳王明杰薛燕徐风金
张艳 王明杰 薛燕 徐风金
哈励逊国际和平医院1风湿免疫科,2全科医学科(河北衡水 053000)
类风湿关节(rheumatoid arthritis,RA)是一种与慢性炎症过程相关的自身免疫性疾病,常伴随多种并发症和严重残疾,可损害关节和关节外器官,包括但不限于心脏、肾脏、皮肤、神经系统和消化系统等[1-2]。目前,美国风湿病学会(American College of Rheumatology,ACR)和欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)指南建议,RA 患者的治疗首先应考虑从传统合成改善病情抗风湿药物(conventional synthetic diseasemodifying antirheumatic drugs,csDMARDs)开始,对csDMARDs 不应答的患者可在csDMARDs用药基础上,联合生物制剂DMARDs(biosimilar DMARDs,bDMARDs)或靶向合成DMARDs(targeted synthetic DMARDs,tsDMARDs)[3-4]。甲氨蝶呤(methotrexate,MTX)作为RA 患者使用最广泛的一种csDMARDs,已被证实在一定比例的患者中可达到良好的临床疗效,从而改善RA 病程[5-6]。然而,并非所有RA 患者都能通过甲氨蝶呤治疗达到病情缓解,单一药物在缓解RA 疼痛方面仍存在较大局限。托法替布作为首个被批准用于治疗RA 的口服小分子Janus 激酶(JAKs)抑制剂,可通过调控机体免疫反应和炎症因子表达缓解病情发展。研究[7-8]表明托法替布对甲氨蝶呤耐受的RA 患者具有一定疗效,且托法替布联合甲氨蝶呤相比较单一甲氨蝶呤治疗可明显改善RA 患者的各项临床症状。然而,目前针对托法替布联合剂量的研究较少,尤其是不同剂量下托法替布的疗效和安全性如何权衡值得深入探究。近期有研究[9]报道了血清细胞因子的变化可能是托法替布治疗RA 的一个重要作用。然而,托法替布治疗前后的RA 患者各种血清细胞因子变化还没有得到广泛的研究。因此,本研究探讨了不同剂量托法替布联合甲氨蝶呤对RA 患者疗效,安全性及血清因子水平的影响,现报告如下。
1 资料与方法
1.1 一般资料 收集2019年7月至2021年4月在衡水市哈励逊国际和平医院就诊的RA 患者90 例。纳入标准:(1)年龄18 ~ 70 岁,诊断符合2010年ACR/EULAR 类风湿关节炎分类标准[10]中RA 的相关诊断标准;(2)近期未接受过生物制剂或其他对本研究结果产生影响的患者;(3)自愿签署知情同意书且研究期间愿意全程配合的患者。排除标准:(1)患者严重心、脑、肝、肾等重要脏器官和神经、血液系统及恶性肿瘤的患者;(2)妊娠期或哺乳期妇女;(3)慢性或复发性感染者;(4)药物过敏者;(5)依从性较差的患者。
所有患者采用随机数表的方式按1∶1 比例将患者分为两组:低剂量联合组和高剂量联合组,每组45 例。低剂量联合组有2 例患者脱落,43 例患者完成治疗;高剂量联合组有3 例患者脱落,42 例患者完成治疗。低剂量联合组男21 例,女22 例;年龄27~67 岁,平均(42.19±1.08)岁;病程1~3年,平均(1.24±0.23)年。高剂量联合组男21 例,女21 例;年龄28~69 岁,平均(42.41±1.13)岁;病程1~3年,平均(1.21±0.21)年。两组患者的年龄、性别、病程等一般资料经对比,差异均无统计学意义(P>0.05),可进行比较。见表1。
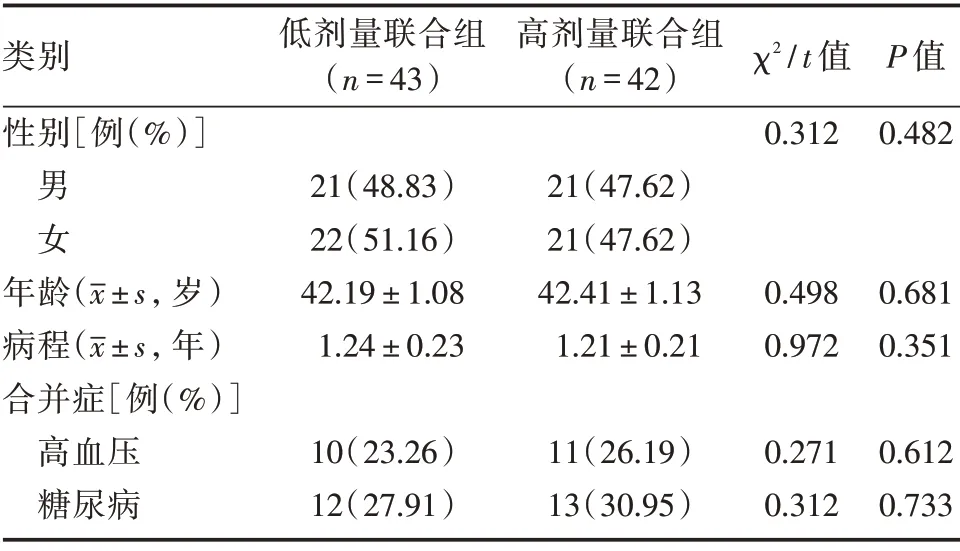
表1 两组患者一般资料比较Tab.1 Comparison of the general data between 2 groups
本研究已经过衡水市哈励逊国际和平医院伦理委员会审核批准(院科伦审:(2019)伦审第(476)号),所有患者均已签署知情同意书。
1.2 治疗方法 所有患者均口服甲氨蝶呤片(上海信谊药厂有限公司,规格2.5 mg/片,国药准字H31020644)10 mg,每周1次。低剂量联合组患者在甲氨蝶呤治疗基础上,口服枸橼酸托法替布(齐鲁制药有限公司,规格5 mg/片,国药准字H20193295)5 mg,每日1 次。高剂量联合组患者在甲氨蝶呤治疗基础上,口服枸橼酸托法替布5 mg,每日2 次。每组患者治疗持续时间均为3个月。
1.3 观察指标
1.3.1 疗效评价指标 参考视觉模拟评分(VAS)[11]来评估患者治疗前后的疼痛度,共计0~10 分,分数越高代表患者疼痛感越强。评分标准:无痛为0 分,轻度疼痛为1~3 分,中度疼痛为4~6 分,重度疼痛为7~10 分。
参照28个关节的肿胀数和压痛数表(DAS28)[12]来评定患者治疗前后的疾病活动度,评分越高代表疾病活动度越高。评分标准:疾病缓解为DAS28<2.6 分;疾病低活动度为2.6 分~3.2 分;疾病中活动度为3.2~5.1分;疾病高活动度为>5.1分。
1.3.2 生化指标 比较两组患者治疗前后ESR 血沉和C-反应蛋白(C-reactive protein,CRP)指标水平。分别在治疗前后采集两组患者在清晨空腹时抽取的5 mL 外周静脉血,取其中的2 mL 血液通过全自动血沉分析仪检测患者ESR 水平,另外的3 mL 血液在3 500 r/min 下离心15 min 后,经离心的血清通过免疫比浊法检测CRP 水平。
1.3.3 血清因子 比较两组患者治疗前后血清因子(IL-35、IL-17、IL-6和IFN-γ)水平。分别在治疗前后采集两组患者清晨空腹4 mL 外周静脉血,经离心(3 500 r/min 下15 min)分离后的血清用ELISA法测定IL-35、IL-17、IL-6 和IFN-γ 蛋白水平(试剂盒由上海碧云天生物科技有限公司提供)。
1.3.4 安全性 记录并观察各组患者在试验期间所产生的包括腹泻、恶心、呕吐等在内的不良反应情况。
1.4 统计学方法 SPSS 23.0 用于数据分析。所有计量资料表示为()。t检验和方差分析分别用于两组间或多组间的比较。所有计数资料表示为例(%),采用χ2或Fisher 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后疗效指标评分比较 治疗后,两组患者疗效指标(VAS 和DAS28)评分相比较治疗前均明显下降,差异具有统计学意义(P<0.05),且高剂量联合组VAS 评分和DAS28 评分均明显低于低剂量联合组。见表2。
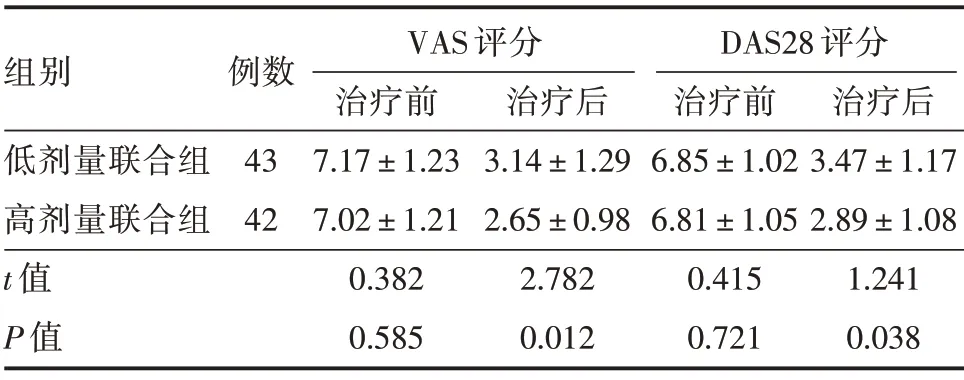
表2 两组患者治疗前后疗效指标(VAS 和DAS28)评分比较Tab.2 Comparison of efficacy index(VAS and DAS28)scores between 2 groups before and after treatments x±s,分
2.2 两组患者治疗前后生化指标水平比较 治疗后,两组患者的ESR 和CRP 水平较治疗前均明显下降,差异具有统计学意义(P< 0.05),且高剂量联合组ESR 和CRP 水平均明显低于低剂量联合组。见表3。
表3 两组患者治疗前后生化指标水平比较比较Tab.3 Comparison of f biochemical indexes between 2 groups before and after treatment ±s
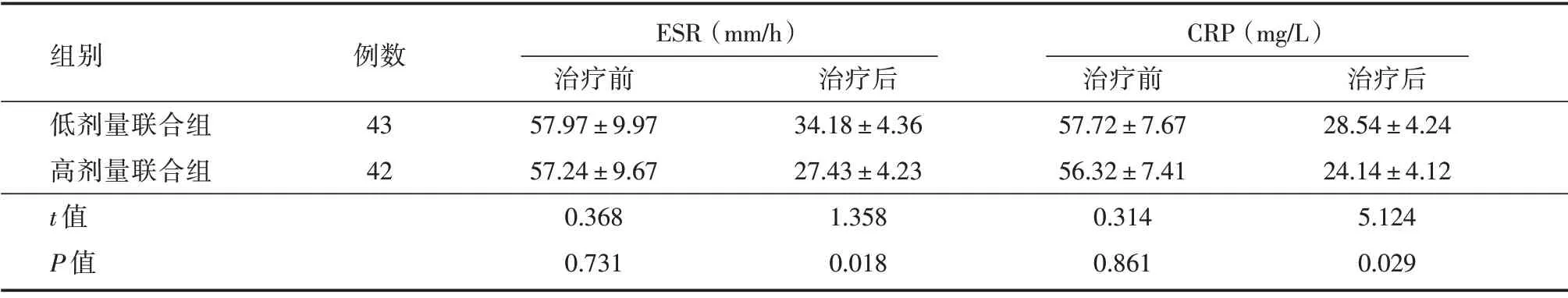
表3 两组患者治疗前后生化指标水平比较比较Tab.3 Comparison of f biochemical indexes between 2 groups before and after treatment ±s
组别低剂量联合组高剂量联合组t 值P 值例数43 42 ESR(mm/h)治疗前57.97±9.97 57.24±9.67 0.368 0.731治疗后34.18±4.36 27.43±4.23 1.358 0.018 CRP(mg/L)治疗前57.72±7.67 56.32±7.41 0.314 0.861治疗后28.54±4.24 24.14±4.12 5.124 0.029
2.3 两组患者治疗前后血清因子水平比较 治疗后,两组患者的IL-17、IL-6 和IFN-γ 水平较治疗前均明显下降,而IL-35水平较治疗前明显升高,差异均有统计学意义(P< 0.05)。此外,高剂量联合组IL-17、IL-6 和IFN-γ 水平均明显低于低剂量联合组,而IL-35水平明显高于低剂量联合组。见表4。
表4 两组患者治疗前后血清因子水平比较Tab.4 Comparison of serum levels of factors between 2 groups before and after treatment ±s,pg/mL

表4 两组患者治疗前后血清因子水平比较Tab.4 Comparison of serum levels of factors between 2 groups before and after treatment ±s,pg/mL
组别低剂量联合组组高剂量联合组组t 值P 值例数43 42 IL-35治疗前10.14±5.22 11.02±4.87 0.461 0.712治疗后21.14±7.87 32.29±8.02 1.187 0.021 IL-17治疗前38.14±8.15 37.22±8.42 0.781 0.652治疗后21.15±4.13 12.54±4.35 3.124 0.029 IL-6治疗前35.21±8.26 34.62±7.78 0.811 0.724治疗后17.14±4.12 10.22±4.56 7.125 0.018 IFN-γ治疗前36.72±8.13 35.87±7.92 0.322 0.521治疗后23.14±4.75 16.24±4.02 5.164 0.041
2.4 两组患者治疗期间不良反应发生情况比较 治疗期间,低剂量联合组共发生不良反应6 例,总发生率为13.33%;高剂量联合组共发生不良反应5例。总发生率为11.11%。两组患者不良反应发生率经对比,差异无统计学意义(P>0.05)。见表5。
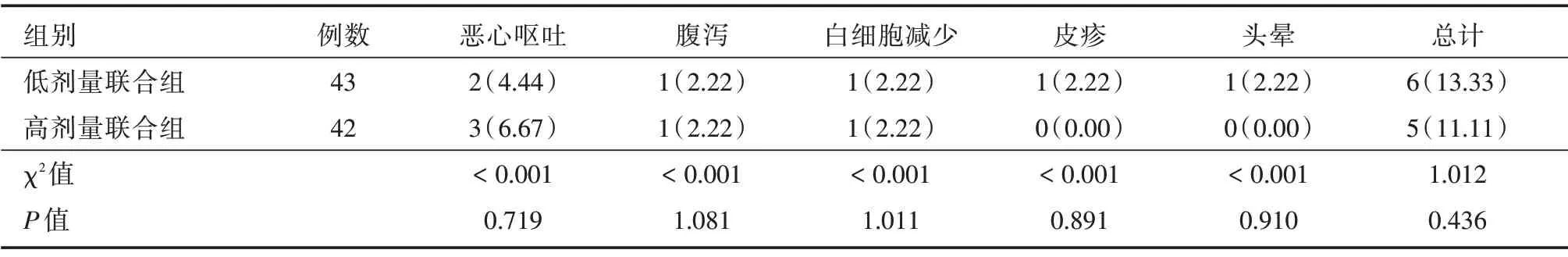
表5 两组患者不良反应发生率比较Tab.5 Comparison of incident of adverse reactions among 2 groups 例(%)
3 讨论
RA 作为一种慢性自身免疫性疾病,以炎性滑膜炎和关节破坏为特征。传统合成的改善病情抗风湿药物csDMARDs(氨甲喋呤、来氟米特和柳氮磺胺吡啶)和bDMARDs(肿瘤坏死因子抑制剂TNFi和IL-6 抑制剂)已成为RA 患者疾病治疗的主要手段[13]。然而,尽管有各种治疗方式和疾病管理手段,许多患者仍没有达到预期的治疗效果,这表明RA 患者仍需要额外的治疗方法或新型药物来进一步缓解病情[14-15]。近年来,随着对各类免疫代谢信号通路的研究深入,针对于这些通路关键分子的小分子tsDMARDs 逐渐被开发出来。研究显示JAK 家族的酪氨酸激酶对于与Ⅰ型和Ⅱ型细胞因子受体结合的细胞因子的信号传递至关重要,其中就包括在RA 发病机制中负责驱动炎症过程的关键细胞因子[13,16]。因此,JAK 被认为是炎症性疾病药物调控的合理靶点,托法替布作为首款治疗RA 的JAK 抑制剂,已被2016年EULAR 指南认定为RA患者的一线靶向治疗药物[17]。临床研究[18]表明,托法替布能有效改善对bDMARDs 耐药进展后的RA 患者临床症状,且托法替布联合甲氨蝶呤能明显增强对甲氨蝶呤反应不足的RA 患者疗效。虽有研究表明托法替布联用甲氨蝶呤对单一使用甲氨蝶呤的RA 患者是有临床获益的,但尚未有证据表明不同剂量的托法替布联合甲氨蝶呤对RA 患者疗效和安全性的影响。本研究结果表明高剂量联合组患者的VAS 和DAS28 评分均明显低于低剂量联合组患者;两组患者在治疗期间的主要不良反应为恶心呕吐、腹泻和白细胞减少等,组间对比差异无统计学意义,表明相比较低剂量托法替布(5 mg/d),高剂量托法替布(10 mg/d)在治疗RA 患者时表现出了更好的临床疗效,且不会增加不良反应发生率。
血清指标作为检测众多疾病的重要诊断指标已被广泛应用,ESR 和CRP 是反映RA 患者病情的常见定量指标,与患者炎症反应紧密相关,对指导患者的后续治疗具有重要意义[19]。CRP 是人体肝脏细胞合成分泌的一种急性时相反应蛋白,当机体或组织细胞受到感染或损伤时,机体内的CRP水平会急剧升高,通常在炎症反应发生后的5~8 h就可能呈现出来[20]。ESR 一般作为许多感染和非感染疾病诊断的辅助性参考指标,反映了红细胞聚集力的大小,当患者发生急性细菌性炎症时,2 ~3 h 后就会出现血沉加快的现象[20]。本研究结果表明两组患者ESR 和CRP 水平均明显低于治疗前,且高剂量托法替布联合甲氨蝶呤能更大程度的降低ESR 和CRP 水平,这可能与较大剂量托法替布能更有效的抑制JAK 信号通路,进而减少下游炎症因子释放有关[19]。
RA 发病机制与血清内的多种细胞因子异常表达密切相关,这些细胞因子受T细胞激活的信号通路的调节,可促进免疫细胞之间的相互作用,是免疫应答的有效标志[21]。根据细胞因子分泌情况,CD4+Th 淋巴细胞可分为Th1 型细胞亚群(IL-2、IFN-γ和TNF-β)和Th2型细胞亚群(IL-4、IL-5、IL-6、IL-10 和IL-13)。除了特性良好的Th1 和Th2 细胞外,幼稚样CD4+T 细胞也可以分化为Th17,这是一种独特的Th 细胞亚群,其特征是表达IL-17。史晓鹏等[22]中表明相比较正常人群,IL-17、IL-6和IFN-γ在RA 患者血清中的表达明显升高,且与CRP 水平呈正相关性,预示了这三种细胞因子的异常表达参与了RA 的发生发展过程。CD4+淋巴细胞的另一个亚群是Tregs,主要包括IL-10、TNF-β 和一种新的细胞因子IL-35。IL-35 属于IL-12 家族的新成员,主要由Tregs 分泌产生,在RA 中发挥抗炎作用[23-24]。值得注意的是,相关研究还表明IL-35 似乎在其他自身免疫性疾病中表现出免疫抑制特性,这类疾病包括系统性红斑狼疮、系统性硬化症、银屑病关节炎和特发性炎症性肌病等[25],这表明IL-35 在自身免疫性疾病研究领域的进展有待进一步挖掘。当前研究检测了一系列血清细胞因子(IL-17、IL-6、IFN-γ 和IL-35)的水平发现两组患者治疗后的IL-17、IL-6 和IFN-γ 水平较治疗前均明显下降,而IL-35 水平明显升高。相比较低剂量,高剂量托法替布联合甲氨蝶呤能更大程度的降低血清IL-17、IL-6 和IFN-γ 水平,提高IL-35 水平,提示了托法替布通过调控IL-17、IL-6、IFN-γ和IL-35 通路,减轻了级联反应程度进而控制了炎性介质的释放,增强了抗炎作用。然而,本研究也存在一定的不足,例如样本量过少,随访时间较短等都可能造成结果的偏倚。本课题组将在此基础上丰富样本数量和检测指标,在后续研究中对本次研究结果进行更为深入的探讨。
综上所述,高剂量托法替布联合甲氨蝶呤相比较低剂量托法替布联合甲氨蝶呤能有效抑制ESR 和CRP 水平,降低IL-17、IL-6 和IFN-γ 表达而促进IL-35 表达,在缓解RA 患者临床症状方面具有更为显著的疗效,且不会增加不良反应发生率。
