颈动脉粥样硬化狭窄的血管周围脂肪密度与脑梗死之间的关系
2023-02-17牛稳邱晓晖刘艺超
牛稳 邱晓晖 刘艺超
亳州市人民医院影像中心(安徽亳州 236800)
颈动脉粥样硬化是脑血管疾病的主要原因之一,以缺血性脑卒中和短暂性脑缺血发作为主要临床表现[1-2]。已知斑块炎症是影响粥样硬化斑块稳定性的重要因素。炎性细胞引发初始病变的形成,易导致新生血管的破裂,炎症介质可能会释放到血管周围的脂肪组织中[3]。虽然C反应蛋白(C-reactive protein,CRP)等血清炎症标志物的水平有助于检测机体炎症反应,但它们不能识别特定区域的血管炎症。既往研究[4-6]提示计算机断层扫描血管造影(computed tomographic angiography,CTA)可以评估冠状动脉周围脂肪炎症,识别责任斑块,从而对心血管事件进行分层和预测。但利用CTA 测定颈动脉血管周围脂肪密度(perivascular fat density,PFD),对颈动脉狭窄患者进行脑梗死风险评估的报道相对较少。本研究旨在评估颈动脉周围脂肪炎症与脑梗死的关系,为脑梗死的预防及临床干预提供参考。
1 资料与方法
1.1 一般资料 回顾性搜集2020年1月至2022年9月因颈动脉粥样硬化疾病接受颈动脉CTA和颅脑MRI 弥散加权成像(diffusion weighted imaging,DWI)检查的患者。根据DWI 结果将纳入患者分为急性梗死(acute cerebral infarction,ACI)组和非急性梗死(non-acute cerebral infarction,NACI)组。本研究患者的纳入标准如下:(1)2 周内相继完成颈动脉CTA 和磁共振颅脑DWI 检查;(2)CTA 结果显示单侧颈动脉狭窄> 50%,且除外同侧颅内动脉狭窄> 50%。排除标准如下:(1)患有颈动脉粥样硬化以外的血管性疾病,如动脉夹层、动脉瘤、动脉炎等;(2)CTA 和DWI 图像质量差以致无法评估;(3)曾接受过颈动脉支架置入术的患者;(4)心、肝和(或)肾功能严重不全的患者。从临床电子病历系统中收集患者临床资料信息,纳入分析的临床变量包括性别、年龄、高血压、糖尿病、冠心病、高脂血症、高同型半胱氨酸血症病史。本研究经过医院伦理委员会批准通过。
1.2 CTA 扫描方案 所有颈动脉CTA 检查均在Revolution CT(GE Healthcare,USA)扫描仪进行。CTA 使用对比剂团跟踪触发(bolus-tracking)技术采集,高压注射器以4 mL/s 的速率注射造影剂(碘佛醇,规格:33.9 g/50 mL,江苏恒瑞医药),剂量1.0 ~ 1.2 mL/kg,然后注射40 mL 生理盐水冲洗。覆盖范围为从主动脉弓到颅顶。颈动脉CTA 扫描参数:管电压120 kV,管电流自动调节,重建层厚0.625 mm,旋转时间0.5 s。
1.3 MRI 扫描方案 颅脑DWI 序列在3.0T MR 扫描仪(Verio,Siemens,Erlangen,Germany;Discovery 750 w,GE Healthcare,USA)进行。西门子Verio 3.0T DWI 序列参数:TR/TE 3 486/88 ms,FOV 240 mm×220 mm,层厚6 mm,层间距1 mm,矩阵160×120,b 值1 000 s/mm2。GE Discovery 750w 3.0T DWI 序列参数:TR/TE 3 486/88 ms,FOV 240 mm×220 mm,层厚6 mm,层间距1 mm,矩阵168×128,b值1 000 s/mm2。
1.4 图像分析 CTA 测量数据包括颈动脉PFD、钙化、狭窄程度。PFD:分别在颈动脉狭窄侧和同层面轴位非狭窄侧测量PFD 的均值和最大值,结果以亨斯菲尔德单位(Hounsfield Units,HU)表示。使用预定义的图像显示设置(窗宽500 HU;窗位100 HU),选出每位患者颈动脉狭窄最严重的层面进行分析,在颈动脉周围脂肪组织中勾画一个圆形感兴趣区(region of interest,ROI)(ROI 的面积为2.5 mm2,距离颈动脉壁外缘至少1 mm)。ROI 勾画时须避开颈动脉壁和周围软组织结构(具体测量方法见图1)。 钙化是CTA 图像上颈动脉狭窄部位斑点状、片状高密度区域(350 ~ 1 300 HU)。根据颈动脉狭窄最严重部位是否伴有钙化,将病例分为非钙化组和钙化组。颈动脉狭窄程度定义为:(1-颈动脉最狭窄处管腔直径/颈动脉狭窄远端的正常管腔直径)×100%。每名患者数据由两名5年以上影像诊断经验的放射科医师分别独立测量,取两名医师测量数据均值,结果存在分歧时讨论后确定。

图1 颈动脉血管周围脂肪密度测量Fig.1 Measurement of carotid artery perivascular fat density
1.5 统计学方法 对符合正态分布的连续变量以均数± 标准差表示,分类变量以例(%)表示。使用t检验和χ2检验比较ACI 组与NACI 组患者的临床资料和颈动脉CTA 数据。使用独立样本t检验分别比较ACI 组与NACI 组患者狭窄侧和对侧颈动脉周围脂肪密度均值及最大值的差异。使用配对t检验比较同一患者左右两侧颈动脉血管周围脂肪密度的均值及最大值。最后将差异变量导入二元logistic 回归分析并绘制接受者操作特征(receiver operating characteristic curve,ROC)曲线评估所选变量的预测效能。P< 0.05 被认为差异有统计学意义。使用SPSS Version 26(IBM Corporation,Armonk,New York,USA)软件进行统计分析。
2 结果
2.1 临床资料比较 本研究共纳入70 例患者,其中包括ACI 组38 例和NACI 组32 例。两组患者在性别之间差异有统计学意义(P< 0.05),在年龄、高血压、糖尿病、冠心病、高脂血症、高同型半胱氨酸血症、颈动脉钙化及狭窄程度之间差异无统计学意义(P> 0.05)。两组患者临床资料对比见表1。

表1 ACI 组和NACI 组临床资料对比Tab.1 Comparison of clinical data between ACI group and NACI group 例(%)
2.2 ACI组与NACI组之间颈动脉PFD比较 ACI组狭窄侧颈动脉周围脂肪密度的均值和最大值均高于NACI 组(P< 0.05),而对侧侧颈动脉周围脂肪密度的均值和最大值,两组患者之间差异均无统计学意义(P> 0.05)。两组患者颈动脉PFD均值和最大值比较见表2。
表2 ACI组与NACI组颈动脉PFD均值和最大值(HU)比较Tab.2 Comparison of mean values and maximum values(HU)of carotid PFD between ACI group and NACI group ±s
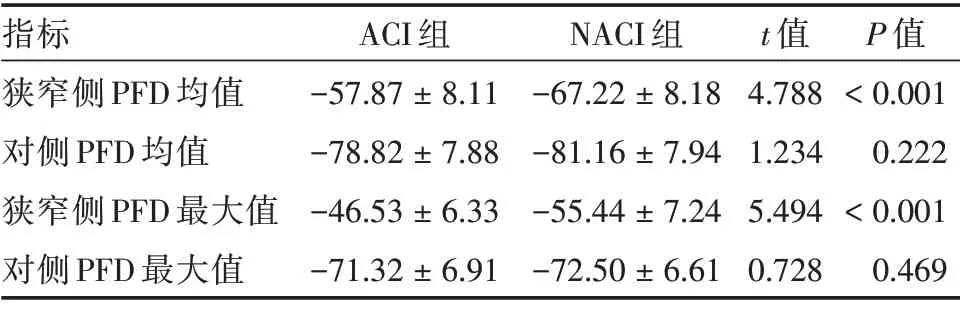
表2 ACI组与NACI组颈动脉PFD均值和最大值(HU)比较Tab.2 Comparison of mean values and maximum values(HU)of carotid PFD between ACI group and NACI group ±s
指标狭窄侧PFD 均值对侧PFD 均值狭窄侧PFD 最大值对侧PFD 最大值ACI 组-57.87±8.11-78.82±7.88-46.53±6.33-71.32±6.91 NACI 组-67.22±8.18-81.16±7.94-55.44±7.24-72.50±6.61 t 值4.788 1.234 5.494 0.728 P 值<0.001 0.222<0.001 0.469
2.3 ACI组与NACI组内颈动脉PFD配对t检验ACI 组狭窄侧颈动脉PFD 的均值[(-57.87 ± 8.11)vs.(-78.82±7.88),P<0.001]和最大值[(-46.53±6.33)vs.(-71.32±6.91),P<0.001]均高于对侧颈动脉。对于NACI 组,两侧颈动脉PFD 的均值[(-67.22±8.18)vs.(-81.16±7.94),P<0.001]和最大值[(-55.44±7.24)vs.(-72.50±6.61),P<0.001]的差异有统计学意义。两组颈动脉PFD 均值和最大值配对t检验结果见图2。
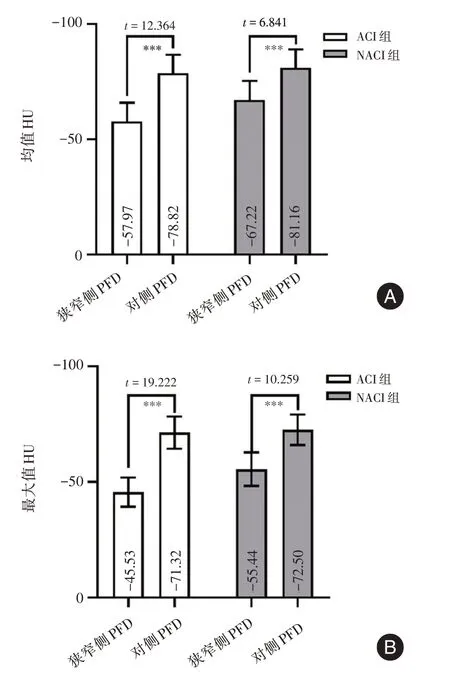
图2 ACI 组与NACI 组内狭窄侧和对侧颈动脉PFD 均值(A 图)、最大值(B 图)之间配对t 检验Fig.2 Paired t-test between mean values(A)and maximum values(B)PFD of stenotic and contralateral carotid arteries in ACI group and NACI group
2.4 颈动脉周围脂肪密度与脑梗死的关系 二元logistic 回归分析显示狭窄侧颈动脉周围脂肪均值和最大值与脑梗死显著相关,未调整PFD均值和最大值的OR值分别为1.160(95%CI:1.072~1.255)、1.213(95%CI:1.103~1.334),差异均有统计学意义(P<0.05);调整年龄、性别、高血压、糖尿病、冠心病、高脂血症、高同型半胱氨酸血症、颈动脉钙化及狭窄程度后PFD 均值和最大值的OR值分别为1.185(95%CI:1.048~1.340)、1.195(95%CI:1.054~1.353),差异有统计学意义(P<0.05,表3)。
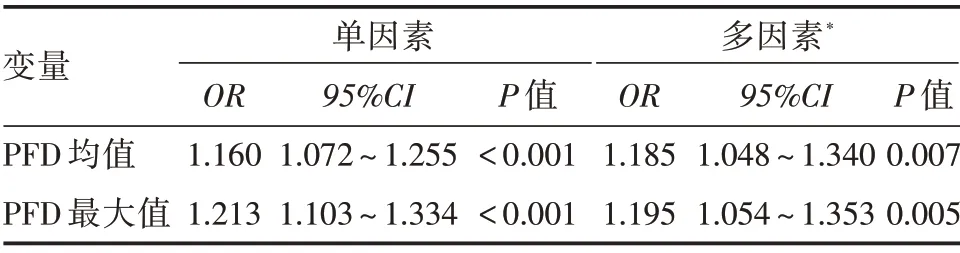
表3 单因素和多因素二元logistic 回归分析Tab.3 Univariate and multivariate binary logistic regression analysis
2.5 ROC 曲线分析 ROC 曲线分析结果显示,颈动脉PFD 均值[ROC 曲线下面积(AUC)为0.792,95%CI:0.678~0.879,P<0.001]与最大值(AUC 为0.812,95%CI:0.701 ~ 0.896,P< 0.001)对脑梗死的发生有较高的预测价值,颈动脉PFD 均值和最大值ROC 分析具体数据见图3。
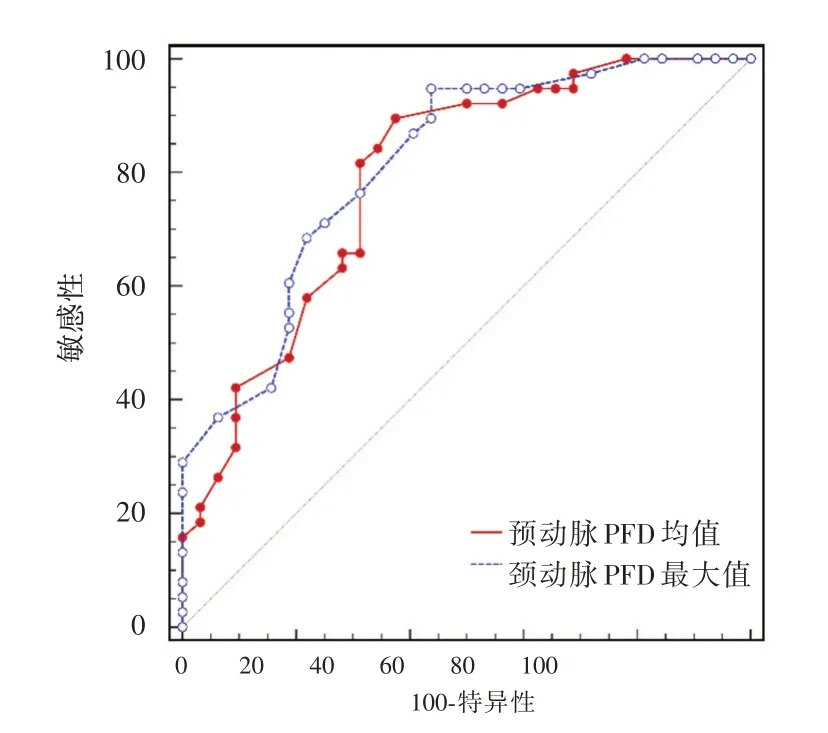
图3 颈动脉周围脂肪密度ROC 曲线分析Fig.3 ROC curve analysis of perivascular fat density
3 讨论
血管周围脂肪组织在调控血管功能、保持血管形态中起着重要作用。部分研究发现血管壁和周围脂肪组织之间以旁分泌效应为主,不是内分泌效应,两者之间的关系是复杂的,并且可能是双向的。当动脉血管发生粥样硬化的情况下,血管壁中会分泌炎性细胞因子,增加局部血管的氧化和炎症。炎症介质也会释放到血管周围的脂肪组织中,诱导局部脂肪分解并抑制新的脂肪形成。反过来,这会促进微血管通透性增加和血管周围水肿。随着血管周围脂肪细胞中脂质含量的降低,动脉周围会形成不同梯度的脂肪密度[7-9],这就改变了血管周围脂肪的组成,导致血管周围脂肪组织具有更高的水/脂比例,造成周围脂肪组织对X 线衰减上升,表现为CT 值的增加。这也解释了本研究中狭窄侧颈动脉周围脂肪密度增加的结果。
虽然血清CRP 和白细胞介素-38 等全身性炎症标志物与脑梗死发生的风险有一定关联,但这些全身性炎症标志物无法确定特定血管床的炎症[10-12]。正电子发射型计算机断层/计算机断层(positron emission computed tomography/computed tomography,PET/CT)显像是一种很有前途的方法,利用2-氟-18-氟-2-脱氧-D-葡萄糖(2-Fluorine-18-Fluoro-2-deoxy-D-glucose,18F-FDG)的摄取能可视化评估动脉管壁炎症和动脉粥样硬化斑块易损性并监测药物治疗的反应[13-15],但该技术使用受限于高暴露、高成本和低临床可用性。本研究通过使用无创CTA 成像技术评估颈动脉周围脂肪密度,可以更准确地评估局部炎症,提供类似于PET/CT的诊断信息,从而为临床早期针对性干预治疗提供了机会。此外,CTA 比PET/CT 更具成本效益和推广价值。
GOELLER 等[16-17]研究表明,与急性冠脉综合症患者的非责任斑块相比,责任斑块周围的冠状动脉周围脂肪密度增加,结合斑块特征可以更可靠地识别冠脉易损斑块,为心血管疾病的早期治疗提供依据。部分研究发现,冠状动脉周围脂肪密度衰减可以预测心肌梗死,当CT 值大于-70.5 HU时,心肌梗死发生率增高[7]。本研究结果显示,与NACI 组颈动脉狭窄患者相比,ACI 组患者的狭窄侧颈动脉PFD 的均值和最大值均明显增加。部分研究[18]证实,大动脉粥样硬化型(large artery atherosclerosis,LAA)卒中患者狭窄颈动脉周围脂肪密度高于对侧,这与本研究结果相符。这些研究表明,动脉周围脂肪密度的变化不仅可以用于缺血性心脏病的评估,也适用于脑缺血性卒中的评估与监测。
本研究结果显示,不仅ACI 组患者狭窄侧颈动脉周围脂肪密度高于对侧颈动脉,NACI 组患者狭窄侧颈动脉周围脂肪密度同样高于对侧,这意味着颈动脉周围脂肪密度的增加不仅发生在脑梗死患者,非梗死患者狭窄颈动脉周围脂肪密度也高于正常范围,该结果提示动脉粥样硬化病变不仅仅局限于颈动脉壁,动脉壁释放的炎性细胞因子也扩散到了血管周围脂肪组织中,此过程明显早于脑梗死事件的发生。虽然ACI 组狭窄侧颈动脉周围脂肪密度高于NACI 组,但两组患者非狭窄侧颈动脉周围脂肪密度并未发现明显差异,这也证明了炎症反应主要局限于颈动脉周围的脂肪组织,与全身性炎症疾病无关。此外,SABA 等[19]研究发现,相对于无症状患者,症状性脑缺血患者颈动脉周围脂肪密度与局部颈动脉斑块强化相关性明显强于无症状者,并建议将PFD 作为评估易损性颈动脉斑块的间接指标。鉴于以上研究结果,可以将颈动脉PFD 作为反映局部颈动脉炎症的敏感标志物,为临床医生及早预测脑缺血事件提供证据。
ZHANG 等[20]通过多变量逻辑分析发现,颈动脉周围脂肪密度与脑缺血性事件显著相关。本研究也发现类似结果,颈动脉周围脂肪密度均值和最大值的增加与脑梗死均有密切关系,对预测脑梗死的发生具有较高的敏感性和特异性。不过,本研究颈动脉PFD 均值和最大值的OR值略高于1.0,这个结果可能是因为样本量相对较少,需要大样本进一步研究。另外,本研究显示两组患者颈动脉狭窄程度未发现显著性差异,这与之前一些报道相符[21],该结果也说明颈动脉周围脂肪密度对于脑梗死发生的预测能力强于颈动脉狭窄程度,这也为临床提供了更有效的评估手段。
另外,本研究存在一些局限性。首先,这是一项回顾性研究,无法确定颈动脉周围炎症和脑梗死的因果关系,未来需要进行前瞻性研究检验这种因果关系。其次,本次研究纳入病例数量有限,未来需要扩大样本量。最后,本研究颈动脉周围脂肪密度的测量沿用了冠状动脉的测量方法,以后的研究可以借助自动化分析软件进一步优化测量方式。
总之,脑梗死患者狭窄侧颈动脉周围脂肪密度较对侧明显增高,说明颈动脉粥样硬化相关的炎症反应已延伸至血管周围脂肪组织内,利用颈动脉CTA 技术可以反映颈动脉周围脂肪组织的炎症反应,为脑缺血性事件的早期预测和风险分层提供了依据。
