Fe3O4/BiOBr/BiOI的制备及降解2,4-D的性能研究
2023-02-16刘家豪张梦朝文斯捷谢剑锋董丽杨代琼党晶晶卢昶雨
刘家豪,张梦朝,文斯捷,谢剑锋,董丽,杨代琼,党晶晶,卢昶雨
(1.河北地质大学 水资源与环境学院 河北省水资源可持续利用与开发重点实验室 河北省水资源可持续利用 与产业结构优化协同创新中心,河北 石家庄 050031;2.河北省生态环境监测中心,河北 石家庄 050031;3.河北省生态环境科学研究院,河北 石家庄 050031;4.长安大学 水利与环境学院,陕西 西安 710016)
2,4-二氯苯氧乙酸(2,4-D)对人和动物有很高的毒性和潜在致癌作用,由于其化学和生物稳定性,难以分解[1-2]。无法仅靠传统方法处理,光催化技术被认为是去除2,4-D的一种突出的绿色技术[3-5]。
碘氧化铋(BiOI)具有窄能带隙(1.7~1.9 eV)、无毒、高稳定性和低成本等优势[6-8]。溴氧化铋(BiOBr)具有匹配的间接带隙和优良的稳定性[9-10],与BiOI形成异质结,引入无毒有磁性的Fe3O4[11-12],合成Fe3O4/BiOBr/BiOI复合材料,可进一步提升稳定性和光催化活性[13-14]。
本文通过溶剂热法合成类花状结构Fe3O4/BiOBr/BiOI复合材料,研究2,4-D在可见光下的催化降解性能,最后,提出该体系的能带结构,以阐明其光催化机理。
1 实验部分
1.1 试剂与仪器
硝酸铋、乙二醇、无水乙醇、溴化钠、碘化钠、三氯化铁、2,4-二氯苯氧乙酸(2,4-D)、乙酸钠、聚乙二醇4000(PEG4000)均为分析纯;实验用水为去离子水。
KH-100E型超声波清洗器;FA-2104型电子分析天平;TG18G型大容量离心机;BL-GHX-V型光化学反应仪;78HW-1恒温磁力搅拌器;TGL-16G高速离心机;DZF-6020MBE真空干燥箱;D8 Advance X射线衍射仪;UV2550紫外可见分光光度计;K-Alpha型X射线光电子能谱仪;7404振动样品磁强计。
1.2 Fe3O4/BiOBr/BiOI复合光催化剂的制备
1.2.1 BiOBr、BiOI的制备 将1.36 g硝酸铋和溴化钠加入盛有40 mL乙二醇的烧杯中,磁力搅拌到完全溶解。将溶液转移至50 mL聚四氟乙烯不锈钢的水热反应釜中,加热至160 ℃反应12 h。取出沉淀,冷却至室温,用去离子水和无水乙醇离心、洗涤3次,在65 ℃下干燥6 h。研磨,得到BiOBr粉末。
用同样的方法将NaBr替换为NaI,即可制备BiOI粉末。
1.2.2 Fe3O4的制备 取1.35 g三氯化铁、3.6 g醋酸钠和1.0 g聚乙二醇,先后加入40 mL乙二醇中,磁力搅拌到其完全溶解。将溶液转移至50 mL聚四氟乙烯不锈钢的水热反应釜中,加热至 200 ℃ 反应12 h。离心、洗涤后,在50 ℃真空干燥12 h后,研磨,得到黑色的Fe3O4。
1.2.3 BiOBr/BiOI的制备 方法与1.2.1节BiOBr的制备方法相同,只是将NaBr替换为质量相同的NaBr与NaI,按照Br∶I=5∶5的质量比进行调整,得到BiOBr/BiOI=5∶5复合光催化剂。
1.2.4 Fe3O4/BiOBr/BiOI复合光催化剂的制备 在BiOBr/BiOI复合光催化剂中,按照质量比Fe3O4/Br/I=1∶5∶5的比例加入Fe3O4,得到三元复合光催化剂Fe3O4/BiOBr/BiOI。
1.3 样品表征
使用X射线衍射(XRD)分析材料内部分子结构。采用扫描电子显微镜(SEM)表征材料表面形貌。采用紫外可见漫反射光谱表征材料的光吸收范围。采用X射线光电子能谱仪(XPS)表征分析材料的化学元素。
1.4 光催化性能测试
催化测试是在光催化反应器中进行,装入的石英管容量为50 mL。称取30 mg的光催化材料,分散在50 mL 2,4-D水溶液中(10 mg/L),先在黑暗条件中磁力搅拌30 min,使其达到吸附-解吸平衡。随后打开氙灯(300 W,λ>420 nm)进行光照。每隔10 min取3 mL溶液,经离心、分液去除光催化材料之后,用UV-Vis光度计在波长为281 nm处测定记录其浓度,并计算光催化降解率。
降解率=[(C0-Ct)/C0]×100%
其中,C0为2,4-D溶液初始吸光度,Ct为光照t时刻后吸光度。
2 结果与讨论
2.1 样品的表征
2.1.1 XRD分析 图1为纯相、两相和三相复合材料的XRD图谱。

图1 Fe3O4、BiOBr、BiOI、BiOBr/BiOI=5∶5 及Fe3O4/BiOBr/BiOI的XRD图谱Fig.1 XRD patterns of Fe3O4,BiOBr,BiOI,BiOBr/BiOI=5∶5 and Fe3O4/BiOBr/BiOI
由图1可知,BiOBr与JCPDS No.09-0393相对应[15],在10.9°(001)、25.2°(101)、31.7°(102)、32.2°(110)、46.2°(200)、57.1°(212)处存在特征峰;BiOI与JCPDS No.10-0445相对应[16],在9.7°(001)、29.6°(102)、31.7°(110)、45.4°(200)、55.2°(212)处出现特征衍射峰;Br、I比例为5∶5的两相复合材料在混合过程中形成了异质结,没有出现其它杂质衍射峰,结晶度良好;Fe3O4与JCPDS No.65-3107相对应,在 30.1,35.4,43.0,56.9,62.6°处出现与(220)、(311)、(400)、(511)和(440)晶面相似特征衍射峰,在Fe3O4/BiOBr/BiOI三元复合材料中占比较少,峰型尖锐而峰强较弱,且基本看不到Fe3O4的特征衍射峰,所以三相复合光催化剂结晶度良好[17]。
2.1.2 SEM表征 图2的SEM图像显示了样品的微观形貌。

图2 样品的SEM图谱Fig.2 Sample of SEM spectrum a.BiOBr;b.BiOI;c.Br∶I=5∶5;d.Fe3O4/BiOBr/BiOI
由图2a可知,合成的BiOBr样品在大约 1 μm 范围内呈现出由错综复杂的纳米片堆积而成的层次化微米球花状结构。由图2b可知,BiOI材料在4~5 μm范围内展现出由无数致密的纳米片堆积而成的微米球。由图2c可知,BiOBr/BiOI=5∶5复合材料的交错纳米片堆积得更加蓬松,尺寸为1~2 μm。由图2d Fe3O4/BiOBr/BiOI复合光催化剂的SEM图可知,尺寸在200~300 nm范围内的Fe3O4纳米粒子附着在BiOBr/BiOI微米球表面上,并且由更加疏松的纳米薄片堆叠而成的类花状结构[18],形成微米球的纳米薄片距离更远,空隙相对较多,可以提高光生载流子的分离,从而进一步提高其光催化活性。
2.1.3 UV-Vis分析 材料的UV-Vis漫反射光谱(DRS)见图3a。
由图3a可知,对于纯BiOBr样品,有效吸收发生在440 nm处的弱可见光区域;对于纯BiOI样品,由于带间隙较小,有效吸收延伸到690 nm处的可见光区域。当BiOBr和BiOI发生复合后,BiOBr/BiOI=5∶5复合材料吸收带边则出现红移,可见光响应范围更宽,吸收带边拓展至618 nm。黑色的Fe3O4对光有很强的吸收性,其吸收边缘大约为 715 nm。Fe3O4/BiOBr/BiOI三相复合材料的吸收带边发生显而易见的红移,有效吸收带边在670 nm处的可见光区域。由此可见,Fe3O4的加入,扩展了复合光催化剂的可见光响应范围,进一步提升了光催化活性。

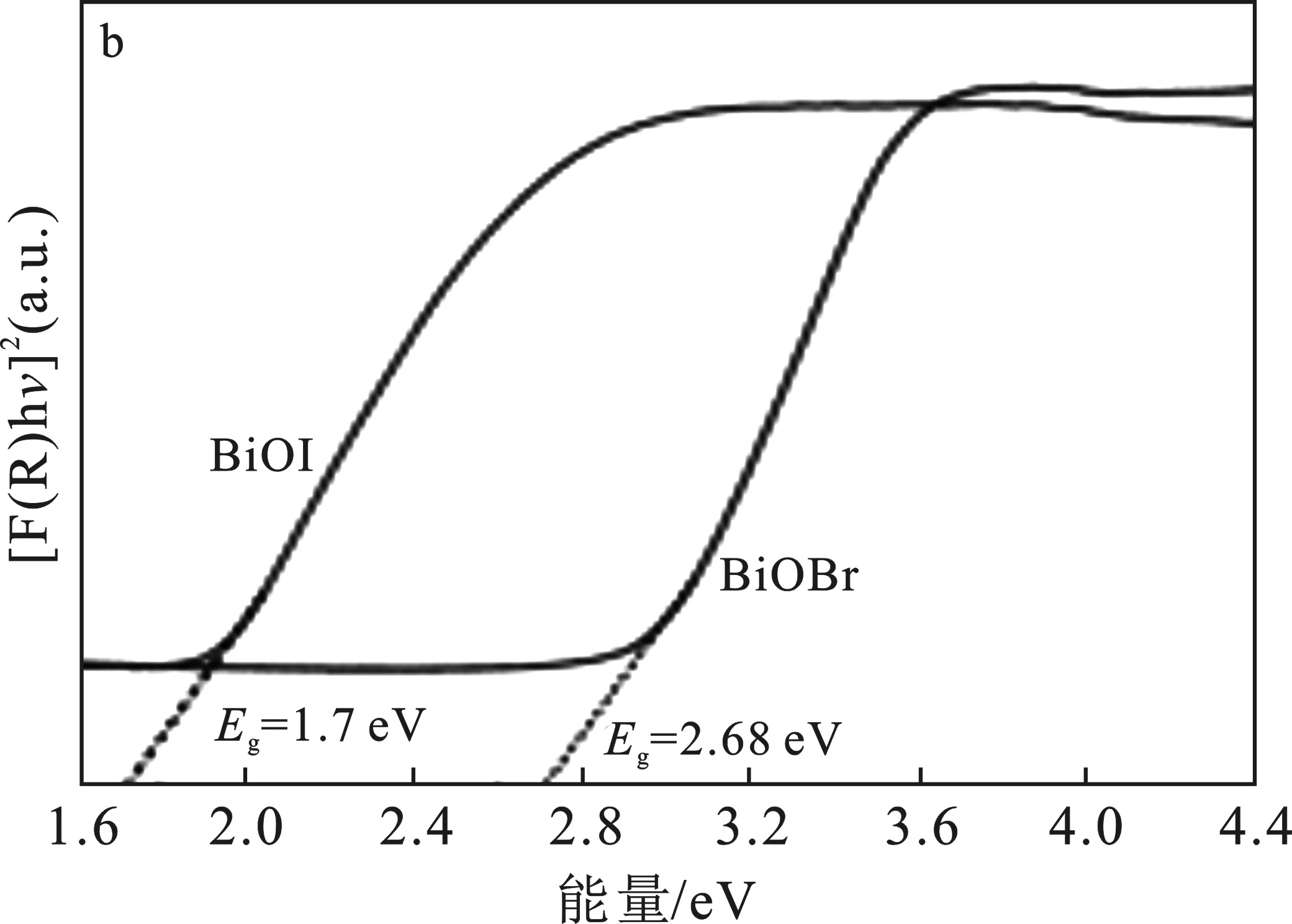
图3 样品的紫外可见DRS反射光谱(a)和 BiOBr和BiOI的Tauc曲线图(b)Fig.3 UV-Vis DRS reflectance spectra of samples(a) and Tauc curves of BiOBr and BiOI(b)
此外,可以通过Tauc公式,αhv=A(Eg-hv)n/2计算出材料的带隙。其中α、h、ν和Eg分别为吸收系数、普朗克常数、光频率和带隙[19]。另外两个参数A和n为常数,其中n的值与半导体的本征光学跃迁性质有关。将(αhv)n/2与hv作图,通过线性拟合曲线作切线,估算材料的带隙,结果见图3b。
由图3b可知,BiOBr的带隙为2.68 eV,BiOI的带隙为1.7 eV,这与BiOBr和BiOI的光吸收特性非常吻合。此外,根据Mulliken电负性理论[20],进一步计算出BiOBr的VB和CB分别约为3.29 eV和0.61 eV,而BiOI的VB和CB分别为2.56 eV和0.86 eV。
2.1.4 XPS分析 图4为Fe3O4/BiOBr/BiOI复合材料、纯BiOBr和纯BiOI的XPS谱图,用于表征样品的表面化学价态。


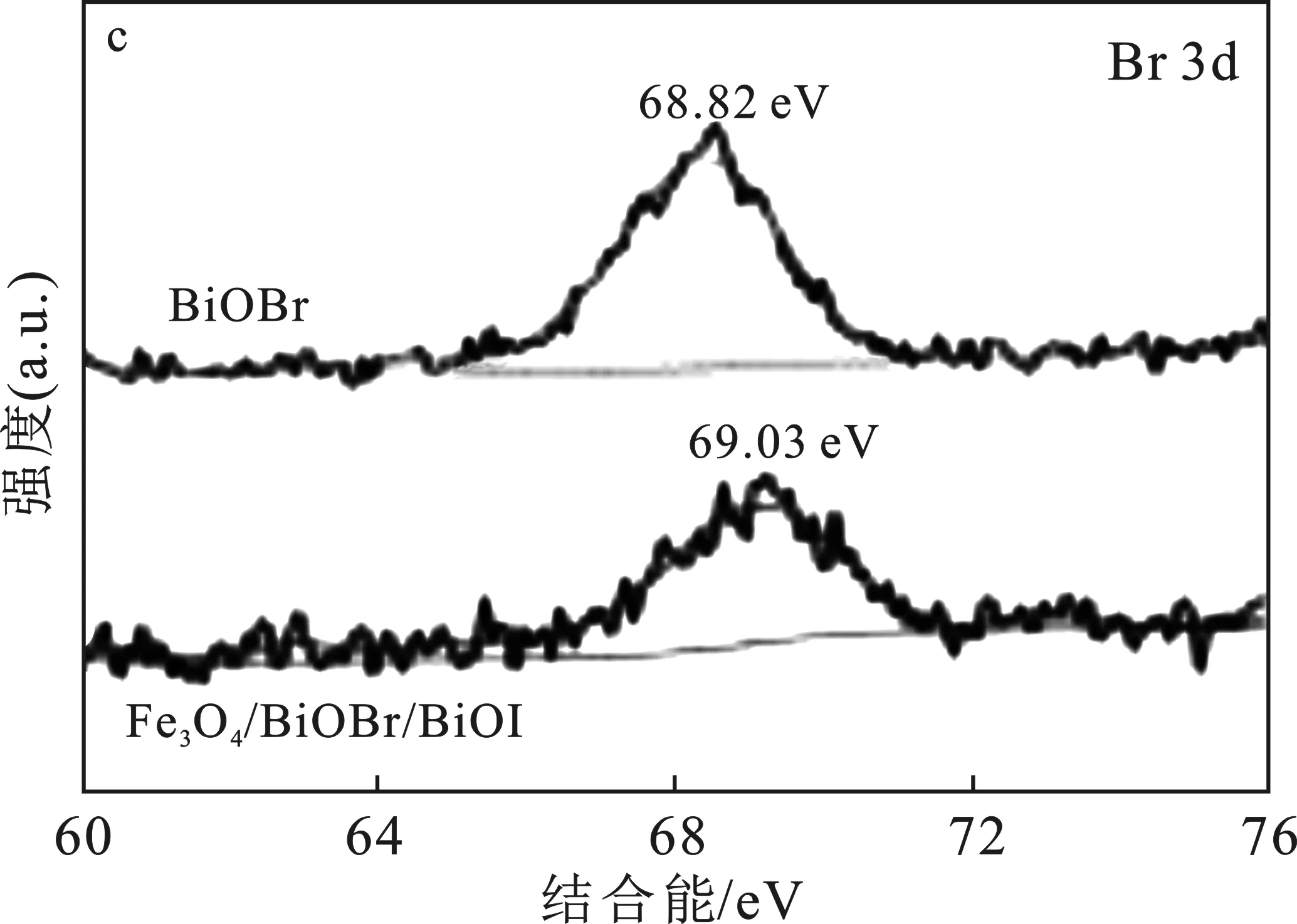


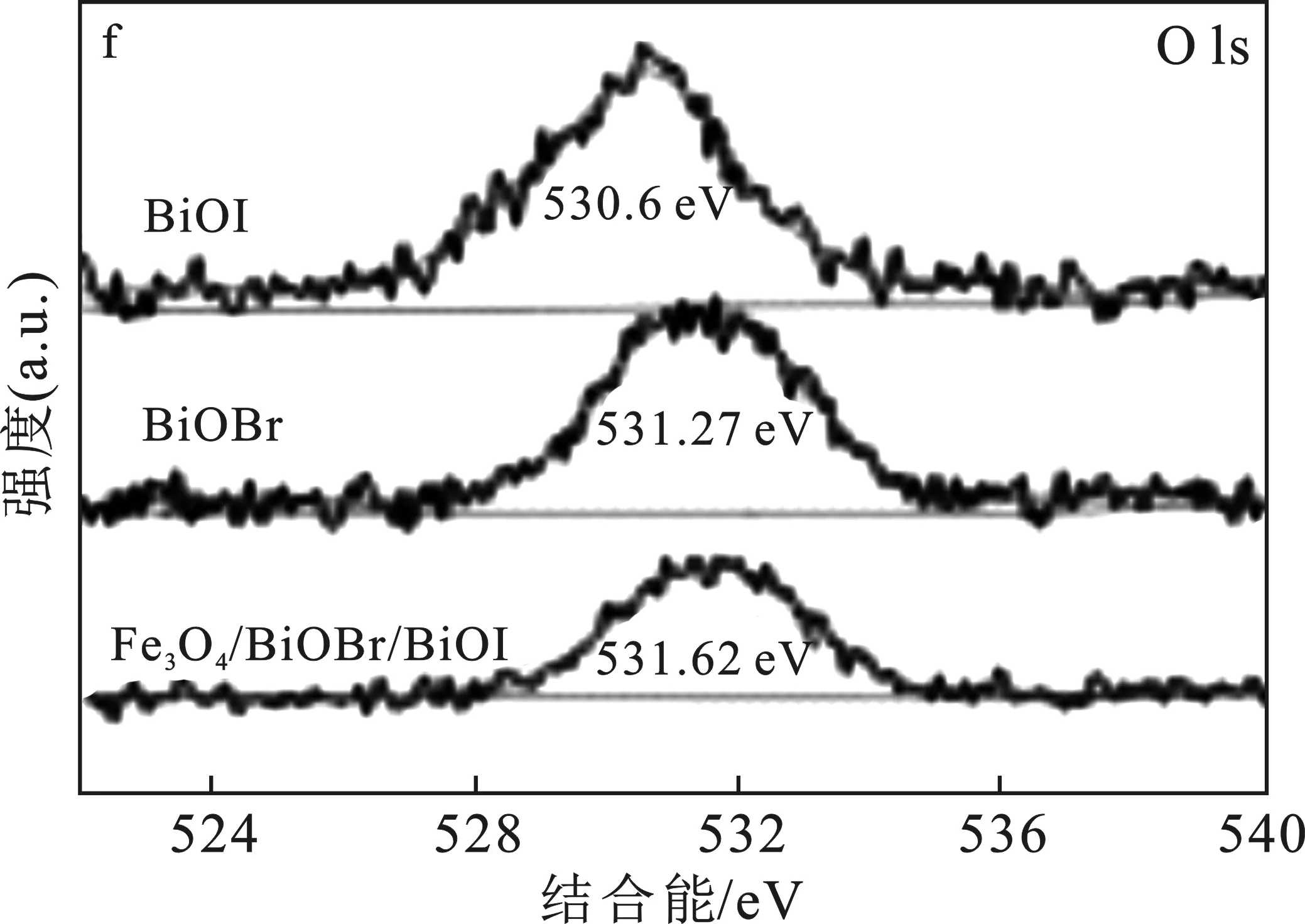
图4 不同样品的XPS图谱Fig.4 XPS spectra of different samples
由图4a可知,Br、Bi、C、O、I和Fe的存在。由图4b可知,159.13,164.42 eV(BiOI),159.51,164.85 eV(BiOBr)和 159.75,165.1 eV(Fe3O4/BiOBr/BiOI)处的两个特征峰分别对应于Bi 4f7/2(Bi3+)和Bi 4f5/2(Bi3+)[21]。由图4c可知,Br 3d XPS光谱在结合能69.03 eV处呈现单峰,证明产物中Br-的存在[22]。由图4d可知,在619.38 eV和630.66 eV处的峰表明BiOI中存在 I 3d,与I 3d5/2和I 3d3/2相匹配。由图4e可知,Fe 2p谱包括两个特征峰,709.43 eV对应于 Fe 2p3/2,723.62 eV对应于Fe 2p3/2,没有发现卫星峰,表明Fe3O4在复合材料中以Fe3+与Fe2+的形式存在[23]。此外,由图4f样品的O 1s谱图可知,530.6 eV(BiOI)、531.27 eV(BiOBr)和531.62 eV(Fe3O4/BiOBr/BiOI)的特征峰对应于Bi—O键[24]。综上所述,该分析与XRD结果保持高度的一致,再次证明Fe3O4/BiOBr/BiOI复合材料成功制备。
2.2 光催化性能测试
2,4-D光催化降解实验结果见图5。
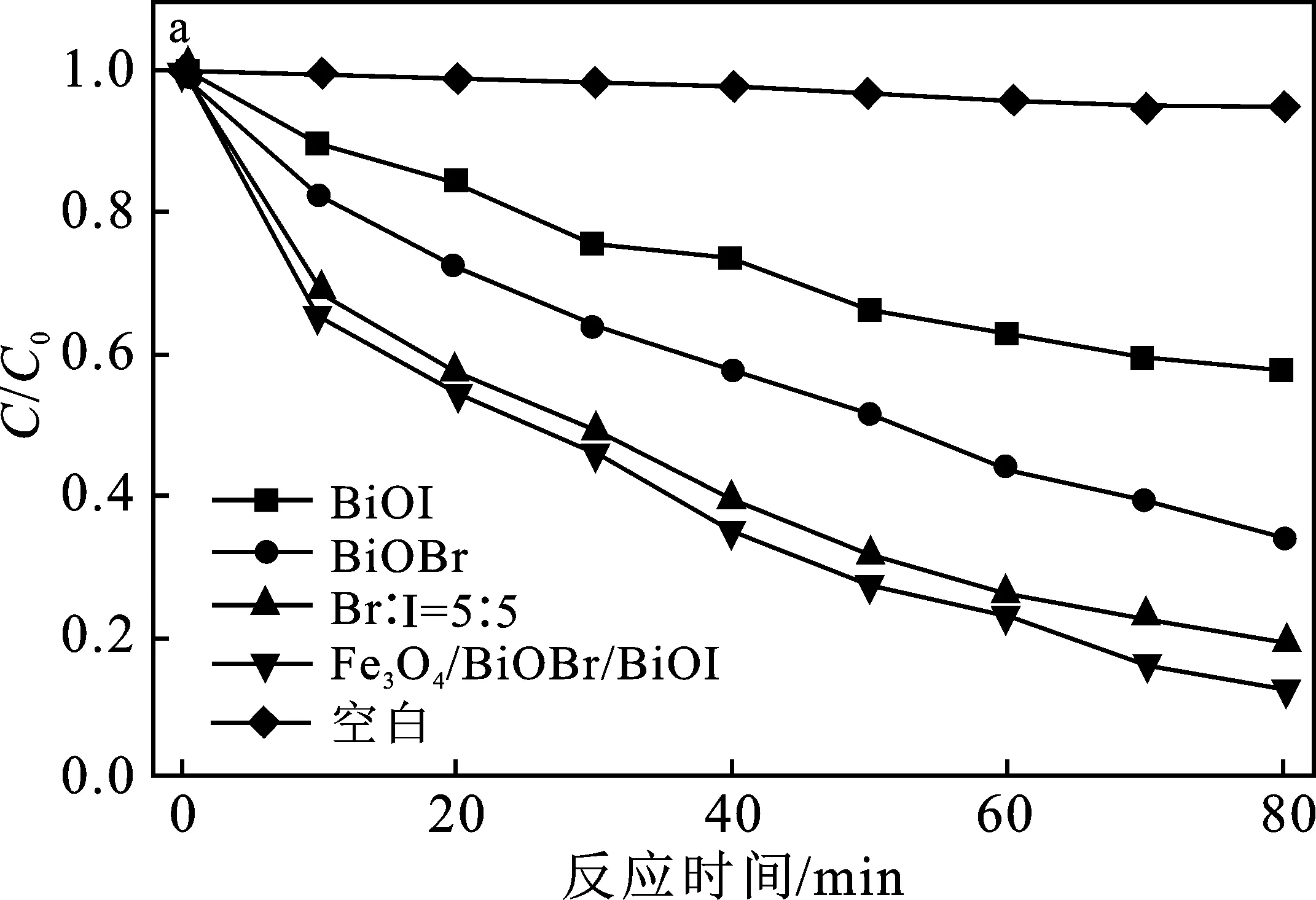



图5 不同样品的光催化性能曲线Fig.5 Photocatalytic performance curve of different samples a.光催化降解2,4-D的降解曲线;b.一级动力学拟合曲线;c.降解速率常数(K);d.Fe3O4/BiOBr/BiOI循环降解2,4-D
由图5a可知,可见光下反应80 min后,在没有光催化剂的情况下,只有5%的2,4-D被降解,说明2,4-D本身不发生自解。加入Fe3O4/BiOBr/BiOI、Br∶I=5∶5、BiOBr及BiOI光催化材料后,对2,4-D的降解率分别达88%,80.9%,65.7%及42.6%。Fe3O4/BiOBr/BiOI对2,4-D的降解活性最好,分别是Br∶I=5∶5、BiOBr和BiOI的1.09倍、1.4倍和 2.07 倍。这主要是由于在BiOBr/BiOI上加载了Fe3O4[25],增加了BiOBr/BiOI的电荷转移,从而提高了其光催化活性。整个2,4-D降解过程遵循准一级动力学(图5b),速率常数的比较如图5c所示,Fe3O4/BiOBr/BiOI(K=2.498×10-2min-1)的降解速率是Br∶I=5∶5(K=2.004×10-2min-1)、BiOBr(K=1.289×10-2min-1)和BiOI(K=6.98×10-3min-1)的1.25倍、1.94倍与3.58倍。这是由于Fe3O4的存在,具有较高的吸附位点。由图5d可知,经过5次循环后,Fe3O4/BiOBr/BiOI对 2,4-D的降解率仅下降了5.1个百分点,表明材料的稳定性比较好。
2.3 光催化机理
基于以上这些实验结果和计算的能带结构,图6 给出了Fe3O4/BiOBr/BiOI纳米复合材料对 2,4-D降解的可能机制。

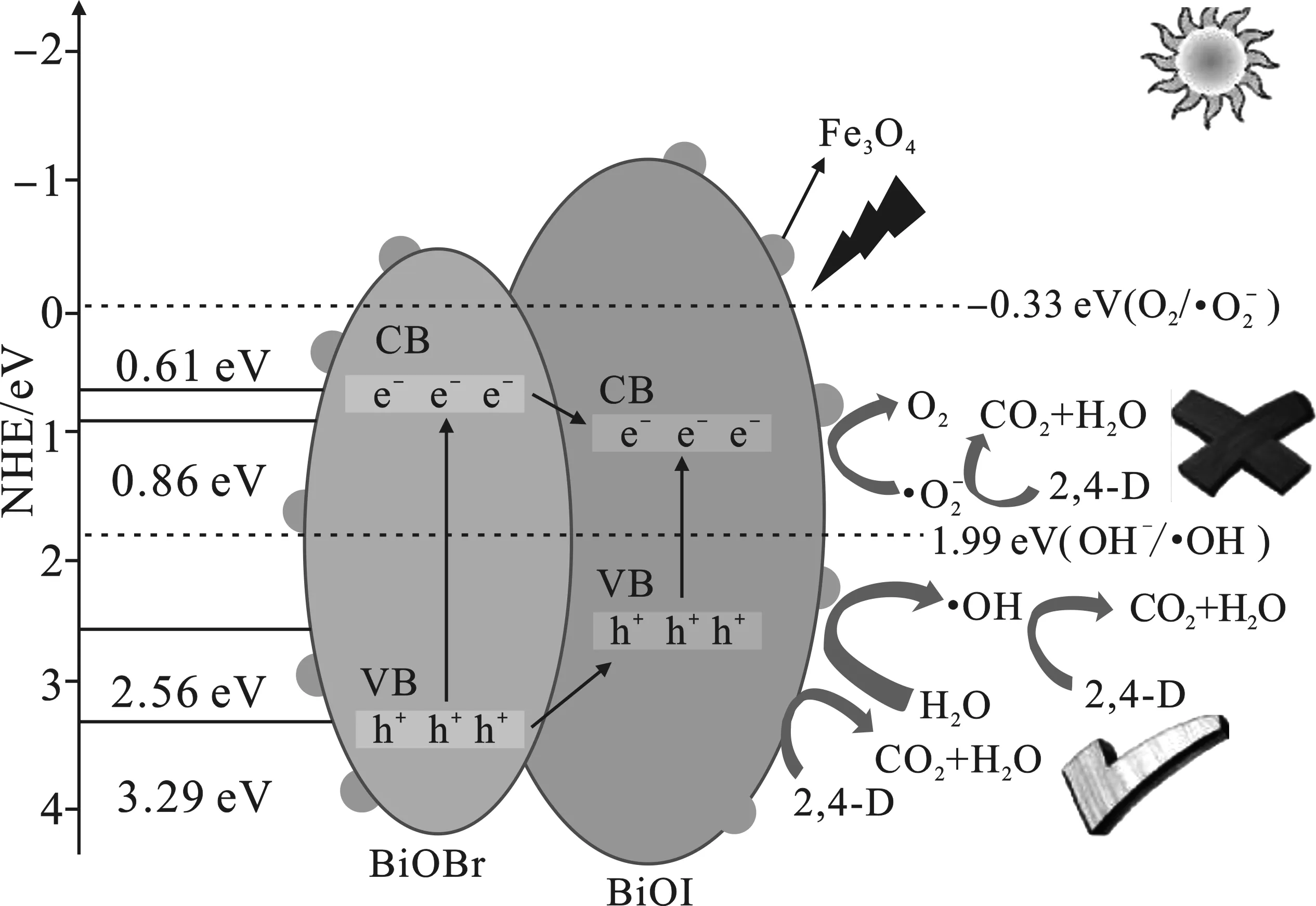
图6 Fe3O4/BiOBr/BiOI复合光催化剂降解 2,4-D可能性机理示意图Fig.6 Schematic diagram of possible mechanism of 2,4-D degradation by Fe3O4/BiOBr/BiOI composite
3 结论
(1)合成了一种具有磁性和高比表面积的微米球花状结构的Fe3O4/BiOBr/BiOI复合材料,在Vis照射下促进2,4-D的光降解,当K=2.498×10-2min-1时,80 min内2,4-D降解率为88%,其降解效率远高于Br/I=5∶5(80.9%)、BiOBr(65.7%)及BiOI(42.6%)催化的反应。
(2)利用Fe3O4,用磁体对复合材料进行快速分离,第5次循环后,降解效率保持在82.9%,表明该材料具有良好的稳定性和重复使用性。
