基于电子顺磁共振法对枸杞提取液的抗氧化活性研究
2023-02-16郑坚强王悦赵宇许家宝张丽黄天琪朱亚娟司俊玲
郑坚强,王悦,赵宇,许家宝,张丽,黄天琪,朱亚娟,司俊玲
(郑州轻工业大学 食品与生物工程学院,郑州 450001)
枸杞(Lyciumchinense)是茄科、枸杞属植物[1],具有药用价值、饮用价值和食用价值[2]。在食品加工的各个领域,枸杞可用于提高产品的营养成分,改善产品的色泽、风味和营养价值等[3]。枸杞具有调节机体免疫力、抑制肿瘤生长和细胞突变、延缓衰老的作用[4-5],含有花青苷、花青素、甜菜碱、类胡萝卜素、枸杞多糖和黄酮等活性物质[6]。成熟的枸杞中含有丰富的类胡萝卜素,类胡萝卜素可以减轻自由基过氧化损伤,因而具有良好的抗氧化性能,类胡萝卜素共轭双键的数目会影响其颜色,最常见的颜色为红色[7]。研究表明食物自身的颜色会影响比色法测定抗氧化活性结果的准确性,例如水果本身的颜色能影响紫外分光光度法对样品抗氧化活性检测的准确性[8]。郭学文等[9]发现,番茄红素与DPPH在517 nm处都具有较强的吸收值,使得紫外法所测结果不准确。电子顺磁共振(electron paramagnetic resonance,EPR),是一种快速、简单、直接的方法,能以谱图的形式直接反映自由基的种类及数量,相比于常见的紫外法,能排除枸杞自身颜色对抗氧化活性的影响,提高试验结果的准确性[10-11]。
类胡萝卜素的提取方法主要有微波萃取法、超声萃取法、溶剂萃取法、脉冲电场萃取法、超临界流体萃取法和酶辅助萃取法[12-13]。由于类胡萝卜素对光、热、氧等条件比较敏感且稳定性差[14-15],超声波提取是一种有效的提取方法,超声波产生的空化现象可以破坏植物的细胞壁和细胞膜,并辅助溶剂传质,从而提高提取效率,减少类胡萝卜素的损失[16-18]。本文通过单因素和均匀试验,以枸杞提取液对DPPH自由基清除率和β-胡萝卜素提取含量为指标,优化超声提取的条件,并测定枸杞提取液中常见的抗氧化活性以及枸杞提取液对羟基自由基、羧基自由基的清除能力,为枸杞的开发和应用、丰富天然抗氧化剂的提取方式和抗氧化活性检测方式提供了参考依据。
1 材料设备与方法
1.1 材料与设备
1.1.1 材料
枸杞(产地:宁夏荣平):购于郑州市丹尼斯超市;无水乙醇、氢氧化钠、石油醚、浓硫酸、甲醇、双氧水(30%过氧化氢):AR,烟台市双双化工有限公司;1-1-二苯基-2-三硝基苯肼(DPPH)、葡萄糖、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO):AR,上海麦克林生化科技有限公司;二甲基亚砜(DMSO):AR,天津市富宇精细化工有限公司;硫酸亚铁:AR,天津市化学试剂三厂;β-胡萝卜素:AR,梯希爱上海化成工业发展有限公司;芦丁:AR,上海源叶生物科技有限公司;亚硝酸钠、硝酸铝:AR,天津市科密欧化学试剂有限公司。
1.1.2 仪器与设备
高速多功能粉碎机 永康市铂欧五金制品有限公司;SQP电子天平 赛多利斯科学仪器(北京)有限公司;E-scan Bruker电子顺磁共振波谱仪 德国布鲁克科技(北京)有限公司;KQ3200DA型超声波清洗器 昆山市超声仪器有限公司;YR-PTB真空泵、RE-52AA旋转蒸发器 上海亚荣生化仪器厂;耐洁聚砜瓶顶过滤器 Thermo Fisher Scientific Inc.;HH-1智能型数显恒温油浴槽 巩义市予华仪器有限责任公司;Tecan Spark 20M多功能微孔板读数仪;索氏抽提装置。
1.2 试验方法
1.2.1 原料处理
取适量枸杞于高速粉碎机中,将枸杞粉碎并过60目筛(孔径0.3 mm),-20 ℃避光储藏。
1.2.2 单因素试验
1.2.2.1 提取液配比的选择
称取5份1.0 g枸杞粉,按照料液比1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)分别加入1∶50的石油醚-无水乙醇有机溶剂,充分摇匀,设定超声清洗机的功率为60 W,超声30 min,冷却,抽滤,旋蒸至干,最后定容到10.0 mL容量瓶中,采用电子顺磁共振波谱仪测定枸杞中类胡萝卜素自由基的清除率。
1.2.2.2 料液比的选择
称取5份1.0 g枸杞粉,按照料液比1∶50(g/mL)分别加入1∶1、1∶50、1∶100、1∶150、1∶200的石油醚-无水乙醇有机溶剂,设定超声清洗机的功率为60 W,超声30 min,冷却,抽滤,旋蒸至干,最后定容到10.0 mL容量瓶中。
1.2.2.3 提取时间的选择
称取5份1.0 g枸杞粉,按照料液比1∶50(g/mL)分别加入1∶50的石油醚-无水乙醇有机溶剂,充分摇匀,固定功率60 W,时间分别设定为10,20,30,40,50 min,其余操作同上。
1.2.2.4 提取功率的选择
称取5份1.0 g枸杞粉,按照料液比1∶50(g/mL)分别加入1∶50的石油醚-无水乙醇有机溶剂,充分摇匀,超声清洗机的超声功率分别设定为40,50,60,70,80 W,超声30 min,按1.2.3的方法测定枸杞中类胡萝卜素自由基的清除率。
1.2.3 抗氧化活性的测定
将0.2 mL样品溶液和1.00 mL DPPH溶液(浓度0.5 mmol/L)于棕色带盖离心管中混匀并反应20 min。使用电子顺磁共振波谱仪测定抗氧化活性,用DPPH·谱图的二重积分值表示DPPH·的含量。
(1)
式中:As为试验二重积分值,Ac为对照组二重积分值。
EPR的测定条件:频率9.79 GHz,功率5.00 mW,中心磁场3 487 G,扫描宽度100 G,调制幅度2.27 G,调制频率86.00 kHz,时间常数40.96 ms,扫描时间83.88 s(20.97 s×4次),横坐标点数512,接收机增益为3.17×103。
1.2.3.1 DPPH标准曲线的绘制
以无水乙醇作为溶剂,配制0.1,0.15,0.3,0.45,0.6 mmol/L的DPPH溶液,按照1.2.3的方法进行测定,积分区域为(3 450±0.01) G~(3 525±0.01) G,并建立DPPH浓度与EPR二重积分值的标准曲线。
1.2.3.2 暗反应时间的确定
用移液枪吸取0.2 mL样品溶液和1.00 mL DPPH(浓度0.5 mmol/L)混匀并吸入毛细管中,放入核磁腔内。将参数改成按时间扫描,单次扫描时间20.97 s,扫描间隔时间99.03 s(即每隔2 min扫描一次),扫描总次数60次,并记录第一峰峰高,其余参数与1.2.3所述一致。
1.2.4β-胡萝卜素的测定
特征吸收峰的确定:吸取0.1 mL 0.1 mmol/L的β-胡萝卜素放入96孔板中,使用多功能孔板读数仪测定其在400~600 nm处的OD值,并绘制吸收曲线。
准确称取β-胡萝卜素2.5 mg,加入1∶50石油醚-无水乙醇有机溶剂,定容至25 mL容量瓶中,振荡摇匀,得到0.1 mg/mL的β-胡萝卜素溶液,分别取上述溶液0,0.25,0.5,1,1.5,2 mL于10 mL容量瓶中,使用多功能孔板读数仪在450 nm处测其吸光度。绘制标准曲线,并将优化结果带入曲线方程,算出优化结果的β-胡萝卜素含量。
1.2.5 均匀试验
选取超声提取时间、超声功率、枸杞和提取液料液比、无水乙醇和石油醚溶剂比作为研究因素,以DPPH自由基(DPPH·)清除率和β-胡萝卜素为指标(为更好地放大各因素水平组之间的抗氧化活性差异,提高均匀试验结果的精确度,将枸杞提取液与DPPH反应量提高1倍,即0.4 mL提取液和1 mL DPPH混合),并采用 U6(64)均匀试验,因素水平见表1。
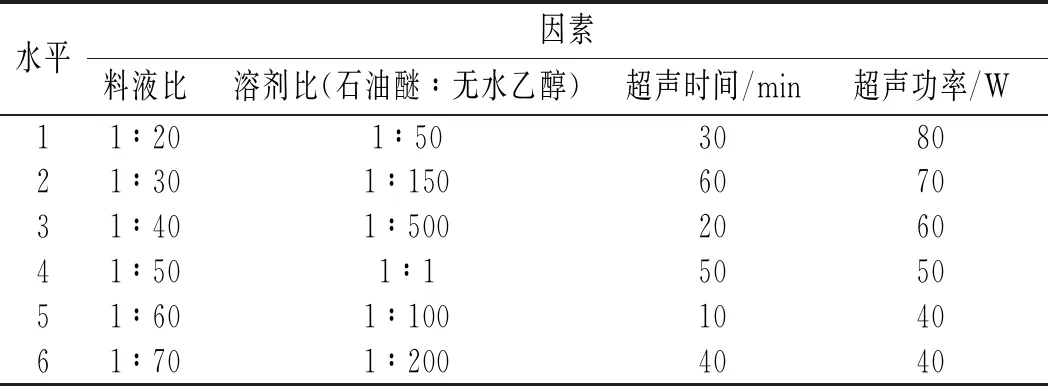
表1 U6 (64)均匀试验因素水平表Table 1 Factors and levels of U6(64) uniform test
1.2.6 最优提取条件下枸杞提取液活性的测定
1.2.6.1 羧基自由基清除率的测定
参考Tong等[19]的方法制备磁性Fe3O4/MoS2纳米复合材料,取5 mg复合材料、150 μL 30% H2O2溶于5 mL DMSO中,超声溶解后用0.22 μm尼龙膜过滤,于2.5 mL离心管中依次加入10 μL DMPO、200 μL过滤样品液、100 μL枸杞提取液(空白组用提取溶剂代替)、10 μL H2O2并用涡旋仪振荡30 s。样品于4 min开始测定,实际测定量为23.77 μL(d=0.93 mm,h=35 mm),并记录其二重积分值,空白组记为As,试验组记为Ac,清除率见公式(1)。
测量参数:频率9.791 555 GHz,调制幅度1.80 G,时间常数40.96,扫描时间20.97 s,接收机增益为3.17×103,其余参数同1.2.3。
1.2.6.2 羟基自由基清除率的测定
参考芬顿反应[20]及Aleksandra等[21]的研究方法,于2.5 mL离心管中依次加入20 μL DMPO、420 μL去离子水、50 μL枸杞提取液(空白组用提取溶剂代替)、20 μL 5 mmol/L FeSO4,随后添加20 μL 50 mmol/L H2O2并计时,用涡旋仪振荡40 s。实际测定量为23.77 μL(d=0.93 mm, h=35 mm),样品于4 min开始测定,记录第二条主峰峰高[22],空白组记为As,试验组记为Ac,清除率见公式(1)。
测量参数:频率9.790 245 GHz,调制幅度1.01 G,时间常数20.48,单位扫描时间10.49 s,接收机增益为1.00×103,其余参数同1.2.3。
1.2.6.3 类胡萝卜素含量的测定
参考郑坚强的研究结果,按公式(2)计算类胡萝卜含量:
(2)
式中:M为提取的类胡萝卜素含量(mg/100 g);A为450 nm处提取液的吸光度;v为样品定容体积(mL);n为稀释定容后的倍数;m为枸杞质量(g);2 480为1 cm光程的比色杯1 g/L枸杞样品萃取液的理论吸收值(按玉米黄素计)。
1.2.6.4 枸杞多糖与黄酮的测定
参考张自萍等的测定方法[23]。
1.2.7 数据处理
所有的试验均做3次平行,采用WinEPR-Processing、Origin 8.0、Mathematics 4.0及其相关方法进行处理,并用SPSS软件进行显著性分析(P<0.05表示差异显著)。
2 结果与讨论
2.1 DPPH浓度与暗反应时间的确定
不同DPPH浓度与波谱强度的标准曲线关系图见图1。
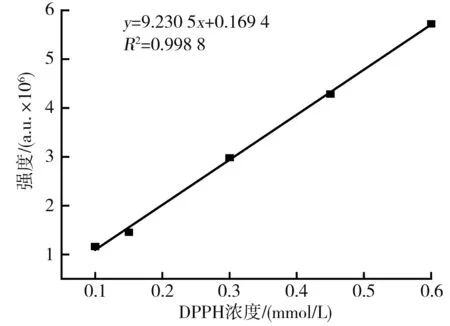
图1 不同DPPH浓度与波谱强度的标准曲线关系图Fig.1 Standard curve relationship diagram between different DPPH concentrations and spectral intensity
由图1可知,在0.1~0.6 mmol/L 区间内DPPH浓度与DPPH·谱图的二次积分值具有良好的线性关系,线性方程为y=9.230 5x+0.169 4,相关系数R2=0.998 8。DPPH·清除的过程实质上是DPPH·含量减少的过程。因此,可以通过DPPH自由基的谱图的二次积分值来反映DPPH浓度的变化[24]。经过试验发现0.5 mmol/L的DPPH清除率趋于20%~50%之间,得到的EPR谱图杂峰少,结合李辉等[25]优化EPR测定DPPH试验,选定DPPH浓度为0.5 mmol/L进行测定能更好地提高测定结果的准确性。
DPPH特征峰强度随反应时间变化的关系图见图2。
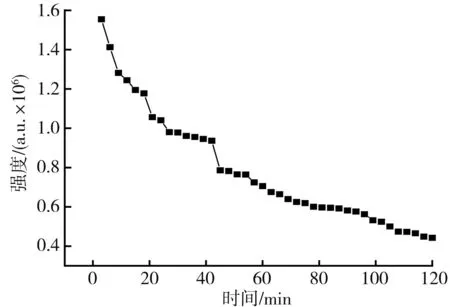
图2 DPPH特征峰强度随反应时间变化的关系图Fig.2 Relationship diagram of change of DPPH characteristic peak intensity with reaction time
由图2可知,随着反应时间的延长,DPPH·不断被枸杞提取液中抗氧化活性物质消耗,在前20 min内反应速率较为迅速,20~40 min内有一段平稳期。目前大多数检测枸杞提取液抗氧化活性的方法是采用紫外分光光度计对比暗反应30 min空白组和试验组OD值的变化[26],首先该方法易受枸杞自身颜色的影响,其次应该准确控制每个测定样品暗反应时间以此提高上述测定方法的准确性。本文采用计时暗反应20 min进行DPPH·清除率测定。
2.2 单因素试验(电子顺磁共振法测定枸杞提取液对DPPH·的清除率)
单因素试验中溶剂体积比、料液比、超声时间和超声功率对DPPH·清除率的影响见图3。

图3 不同有机溶剂配比对DPPH自由基清除率的影响Fig.3 Effect of different organic solvent ratios on DPPH free radical scavenging rate
由图3可知,在其他提取条件一致时,不同的提取溶剂配比对类胡萝卜素自由基清除效果存在显著差异,石油醚与无水乙醇的溶剂比为1∶50时,DPPH·清除效果最好,清除率为36.39%。使用石油醚-无水乙醇有机溶剂提取类胡萝卜素时,适当增加无水乙醇的体积有利于类胡萝卜素提取更完全,但当持续加大无水乙醇的量时,提取效果下降,这可能是枸杞中黄酮溶于乙醇经过旋转蒸发后被损耗所致。
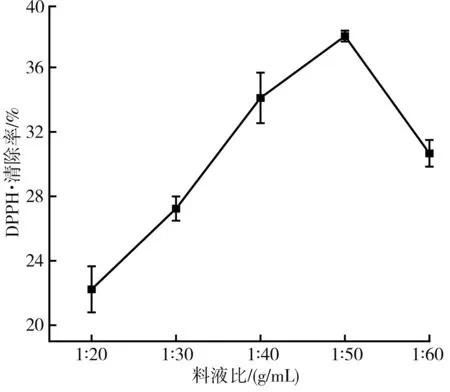
图4 不同料液比对DPPH自由基清除率的影响Fig.4 Effect of different solid-liquid ratios on DPPH free radical scavenging rate
由图4可知,料液比在1∶50 (g/mL)时枸杞提取液的抗氧化活性最强,适量的有机溶剂能增加与枸杞的接触面积,提高提取效果,但当料液比增加到1∶50~1∶60 (g/mL)时,枸杞提取液对DPPH·的清除率反而降低,这可能是枸杞提取液中抗氧化活性物质达到饱和,且随着有机溶剂的增加,容易造成提取液挥发损失。
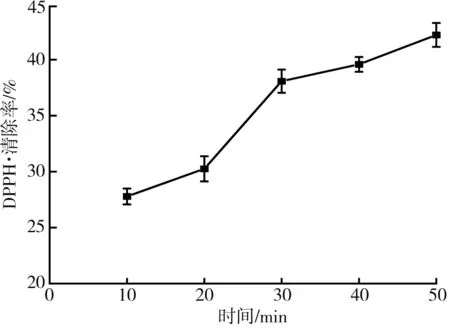
图5 不同提取时间对DPPH·清除率的影响Fig.5 Effect of different extraction time on DPPH free radical scavenging rate
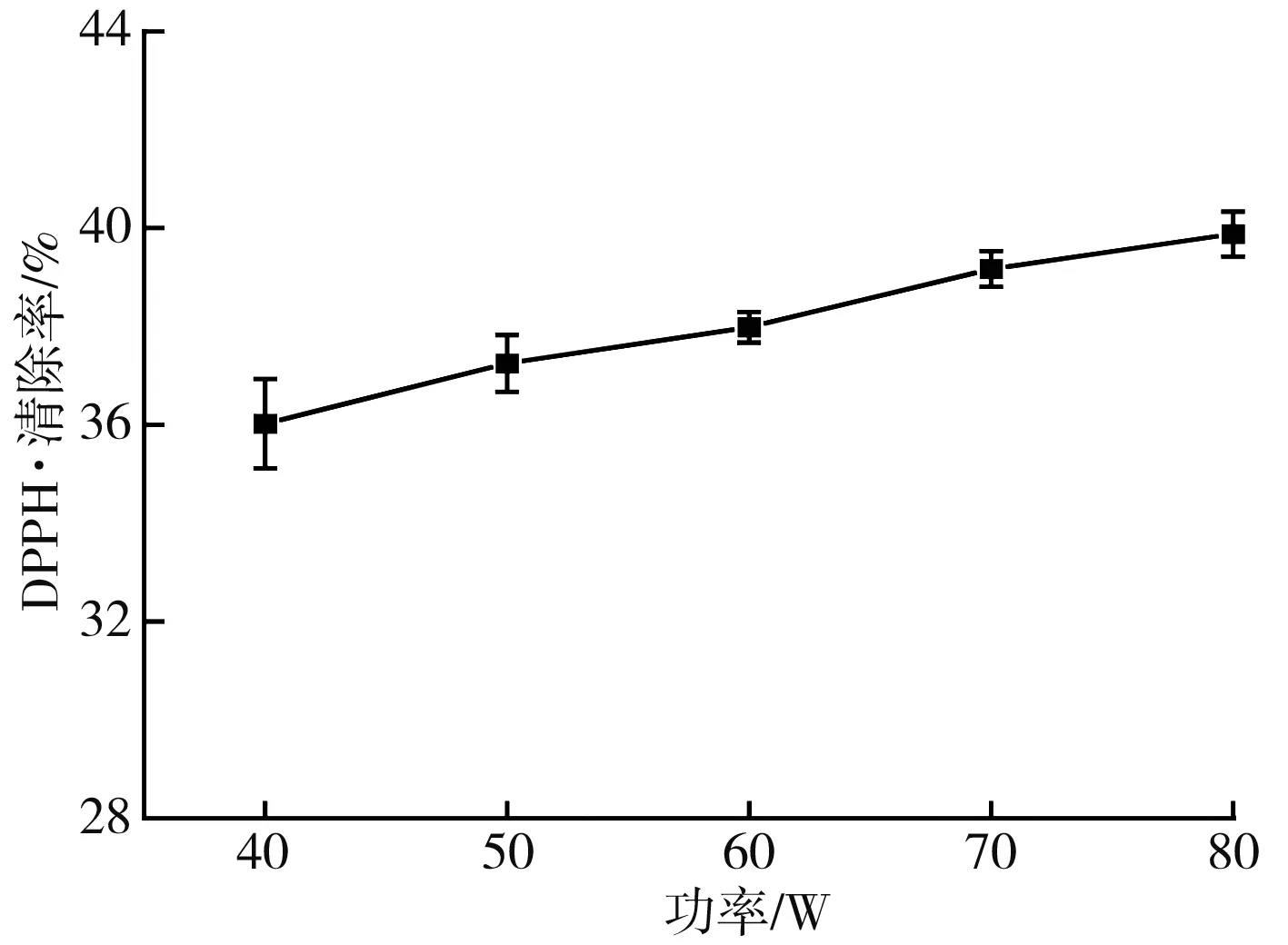
图6 不同提取功率对DPPH·清除率的影响Fig.6 Effect of different extraction power on DPPH free radical scavenging rate
由图5和图6可知,随着超声时间和功率的增加,枸杞提取液对DPPH·的清除率逐渐增加,主要原因是超声的机械效应、空化作用和热效应等能加速枸杞中具有抗氧化活性的有效物质例如黄酮、胡萝卜素、枸杞多糖等的释放、扩散和溶解,显著提高提取效率[16-18]。
2.3 均匀试验结果
2.3.1β-胡萝卜素最大吸收峰的确定及标准曲线的建立
β-胡萝卜素吸收曲线及标准曲线见图7。
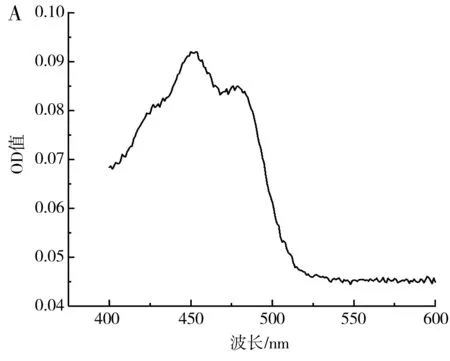
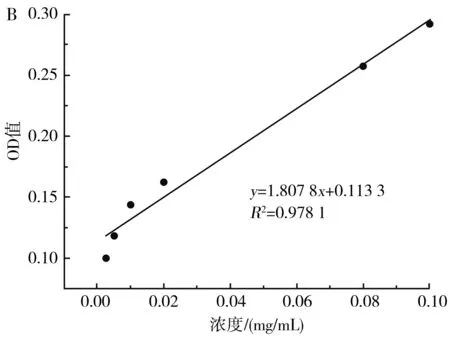
图7 β-胡萝卜素吸收曲线(A)及标准曲线(B)Fig.7 β-carotene absorption curve (A) and standard curve (B)
由图7可知,β-胡萝卜素在400~600 nm的波长处存在两个特征吸收峰,最大吸收峰在450 nm处,在此波长下,不同浓度的β-胡萝卜素与吸光度值具有良好的线性关系,线性方程为y=1.807 8x+0.113 3,R2=0.978 1。因此,可用450 nm处的OD值表示β-胡萝卜素的含量。
2.3.2 均匀试验结果
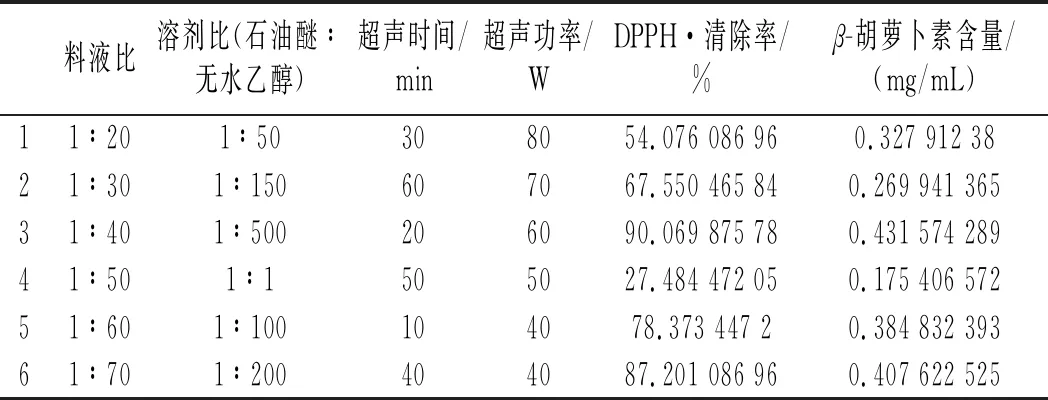
表2 均匀试验结果Table 2 Results of the uniform test
以DPPH·清除率为考察指标,优化结果如下:
均匀试验采用Mathmatics 4.0软件分析:以DPPH自由基清除率为考察指标Y,料液比(X1)、溶剂比(X2)、超声时间(X3)、超声功率(X4)为影响因素进行回归分析,得到回归方程:
Y=108.03-123.42X1-2 994.75X2+58.81X2X3-0.009 563X3X4。
从回归分析的显著性分析可以看出,溶剂比(X2)对DPPH·清除率具有显著的影响,P值为0.033 5;超声时间(X3)与溶剂比(X2)和超声功率(X4)具有显著的交互作用,对DPPH·清除率具有显著的影响,P值分别为0.034 2和0.036 7。由回归程求极值结合研究实际,得到最优水平:料液比(X1)1∶50,溶剂比(X2) 1∶50,超声时间(X3)30 min,超声功率(X4)50 W,在此条件下,DPPH·清除率为95.21%,远远高于试验中的最大值90.07%,综合优化试验结果可靠。
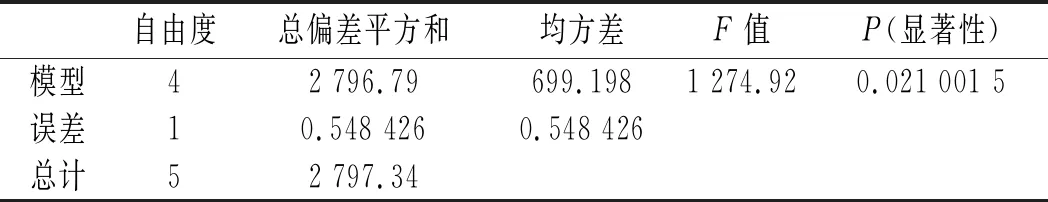
表3 方差分析表Table 3 Analysis of variance
以β-胡萝卜素含量为考察指标,优化结果如下:
均匀试验采用Mathmatics 4.0软件分析:以β-胡萝卜素含量为考察指标Y,料液比(X1)、溶剂比(X2)、超声时间(X3)、超声功率(X4)为影响因素进行回归分析,得到回归方程:
Y=0.993 8-12.82X2+0.249 7X2X3-0.000 090 2X3X4。
从回归分析的显著性分析可以看出,超声时间(X3)与超声功率(X4)具有显著的交互作用,对DPPH·清除率具有显著的影响,P值为0.046 3。
由回归方程求极值,结合研究实际得到最优水平:料液比(X1)可任意取值,溶剂比(X2)1∶500,超声时间(X3)30 min,超声功率(X4)40 W,在此条件下,β-胡萝卜素含量为0.424 mg/mL,接近试验中的最大值0.431 mg/mL。
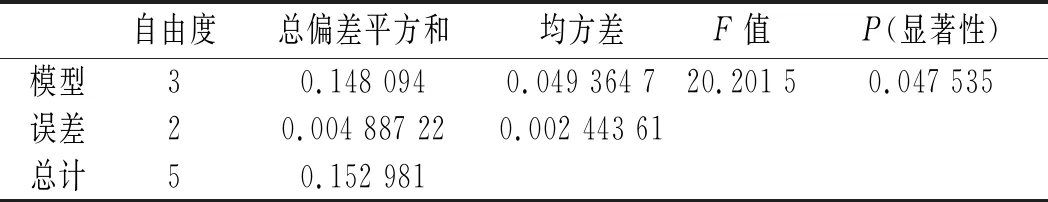
表4 方差分析表Table 4 Analysis of variance
结合两者指标,优化结果为料液比(X1)1∶50,溶剂比(X2)1∶500,超声时间(X3)30 min,超声功率(X4)40 W,在此条件下得到的枸杞提取液对DPPH·的清除率为92.34%,β-胡萝卜素含量为0.424 mg/mL。
2.4 最优提取条件下枸杞提取液活性测定结果
2.4.1 羟基自由基和羧基自由基清除能力测定结果
由图8可知,枸杞提取液对DPPH自由基、羟基自由基、羧基自由基均具有清除作用。最优条件下的枸杞提取液对DPPH自由基的清除率为92.34%,对羧基自由基的清除率为79.11%,对羟基自由基的清除率为45.54%。在添加枸杞提取液后,羟基自由基的EPR谱图出现了除羟基自由基之外的特征峰(图中1,2,3,4为羟基自由基EPR特征峰[21]),其原因可能是添加枸杞提取液后导致DMPO氧化开环,或枸杞提取液和H2O2反应产生了其他自由基,这一猜想需要进一步研究。
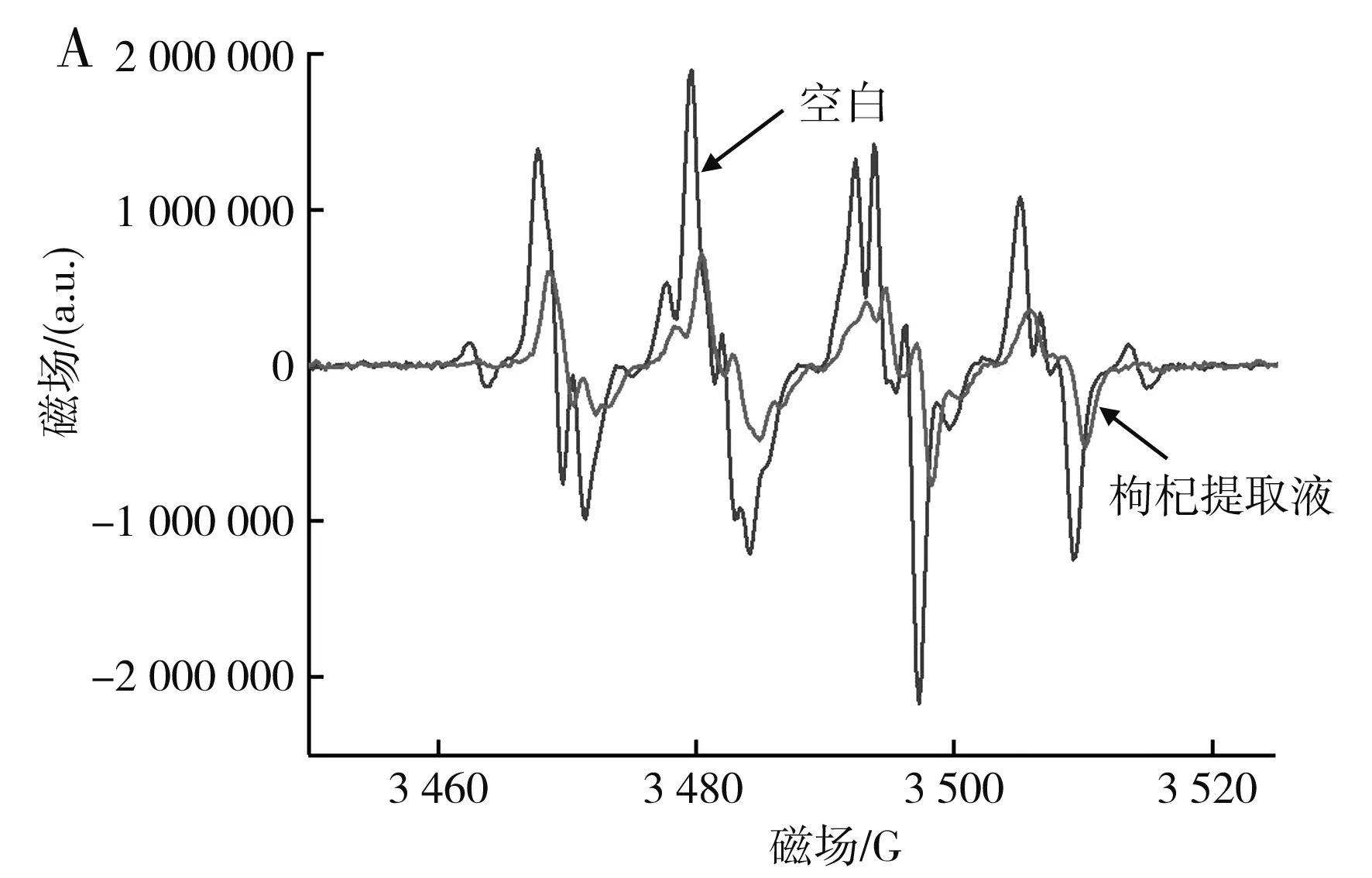
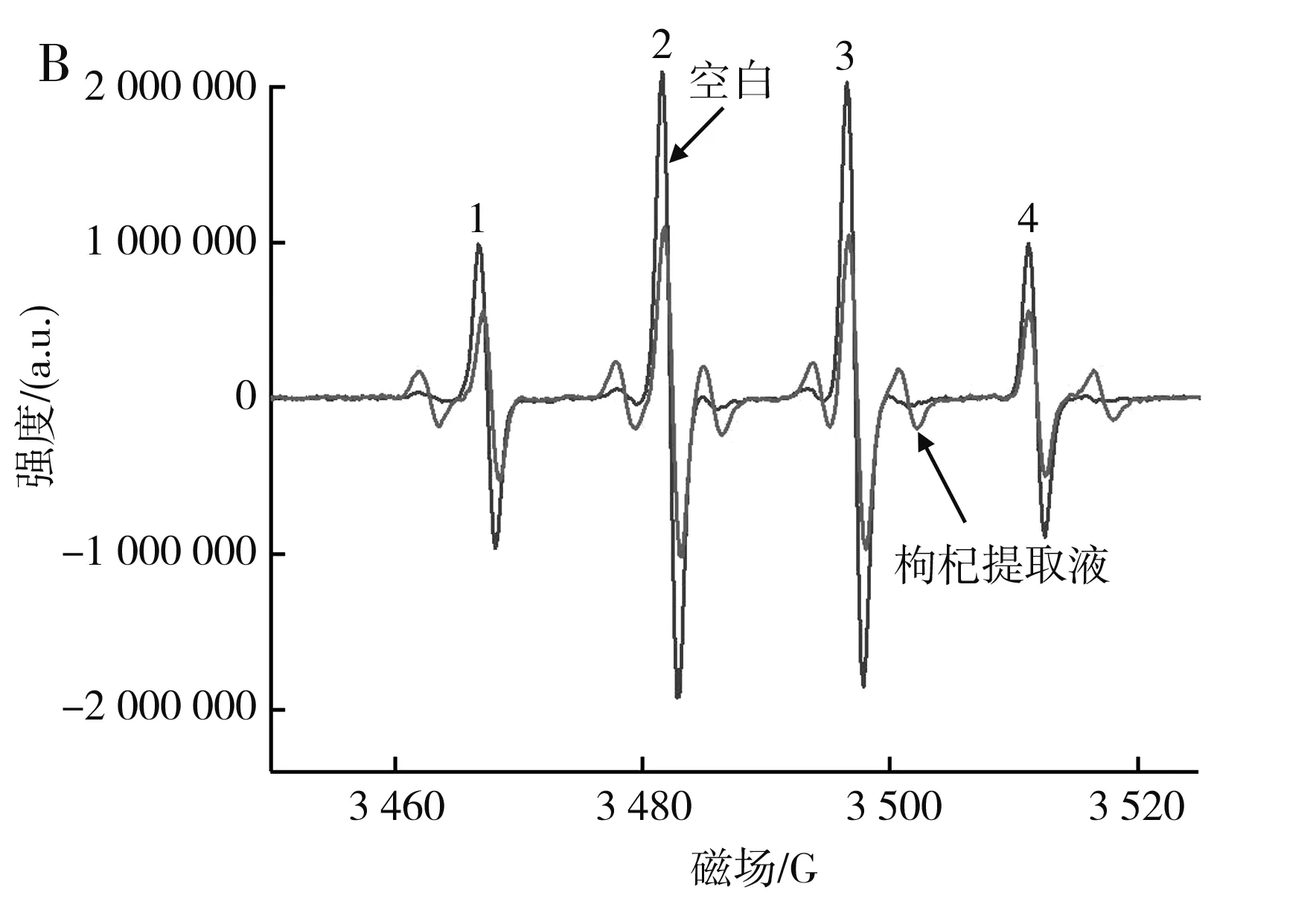
图8 最优条件下的枸杞提取液对羧基自由基(A)与羟基自由基(B)影响的EPR谱图Fig.8 EPR spectra of effect of wolfberry extract on the carboxyl radical (A) and hydroxyl radical (B) under the optimal condition
2.4.2 总黄酮(以芦丁计)的吸收曲线及标准曲线的建立
总黄酮(以芦丁计[23])的吸收曲线及标准曲线见图9。
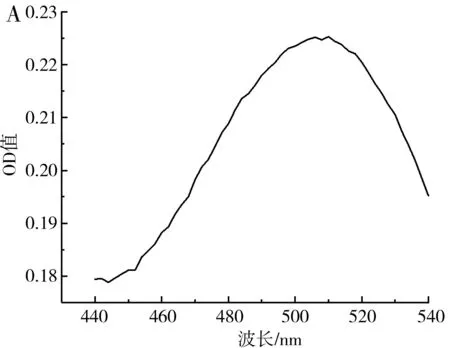
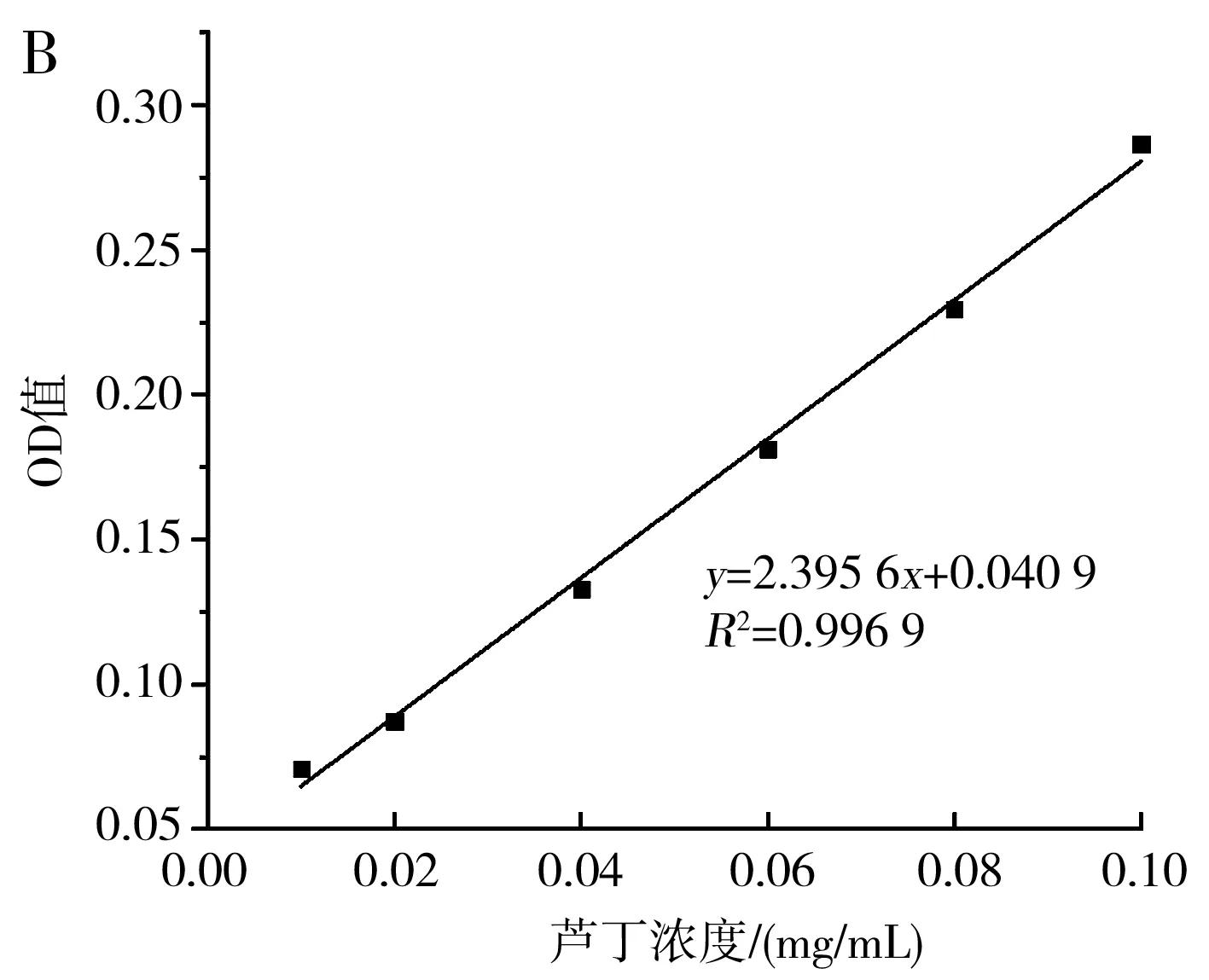
图9 总黄酮的吸收曲线(A)及标准曲线(B)Fig.9 Absorption curve (A) and standard curve (B) of total flavonoids
由图9可知,按1.2.6处理芦丁后的显色溶液在440~540 nm的波长处存在一个特征吸收峰,最大吸收峰对应的波长为510 nm,在此波长下,0.01~0.1 mg/mL的芦丁与吸光度值具有良好的线性关系,线性方程为y=2.395 6x+0.040 9,R2=0.996 9。在优化条件下枸杞提取液的黄酮含量为0.039 2 mg/mL,在相同条件下未经超声处理的枸杞提取液中黄酮含量为0.032 5 mg/mL,在优化条件下黄酮提取率相比空白组提高了20.62%。
2.4.3 枸杞多糖(以葡萄糖计[23])的吸收曲线及标准曲线的建立
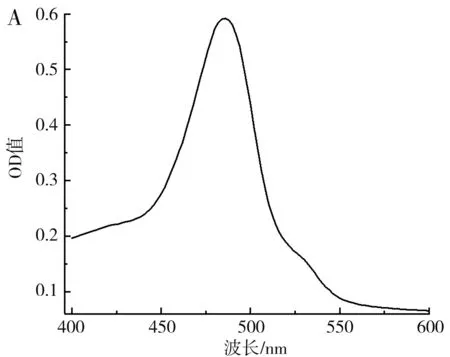
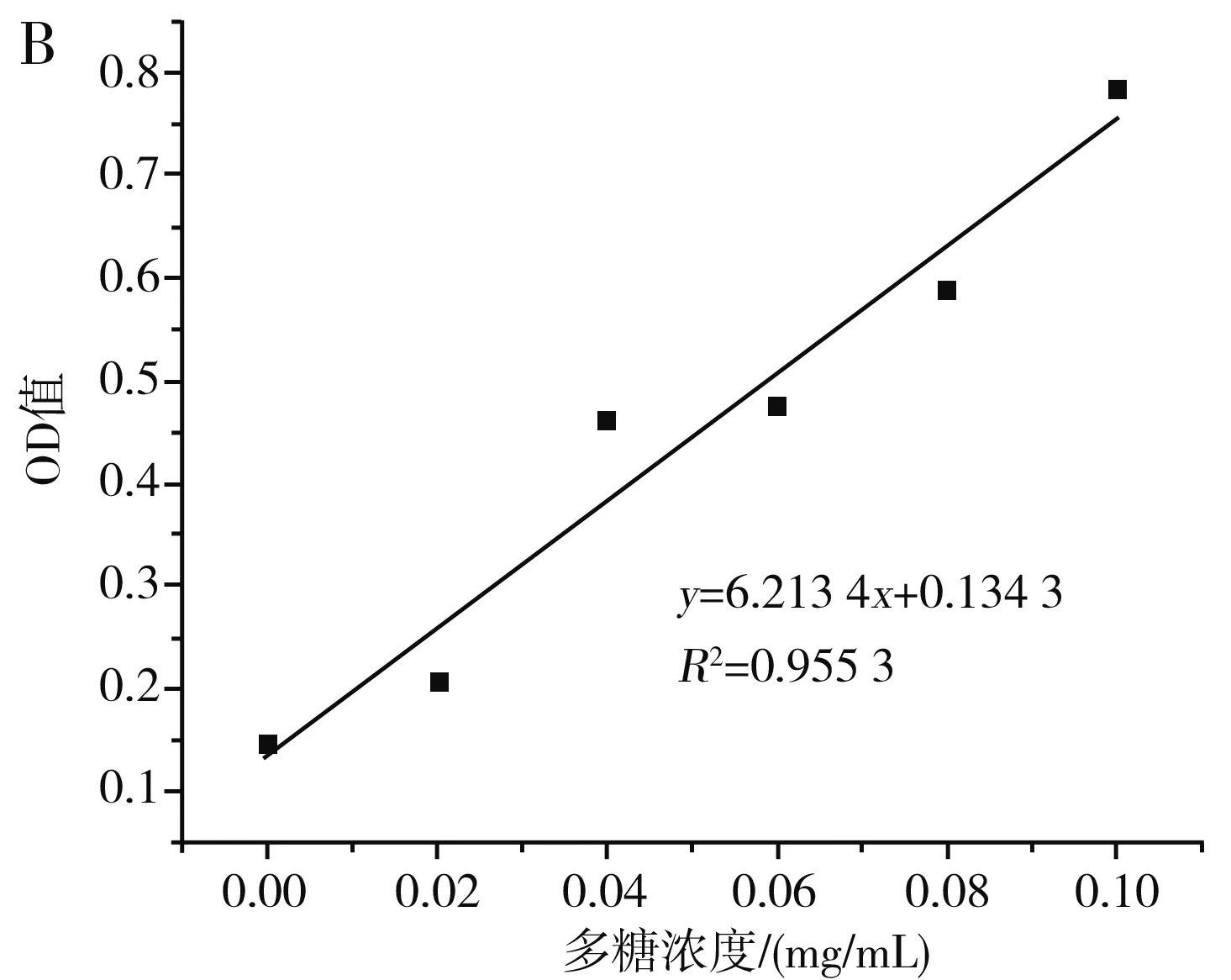
图10 枸杞多糖的吸收曲线(A)及标准曲线(B)Fig.10 Absorption curve (A) and standard curve (B) of wolfberry polysaccharides
由图10可知,按1.2.6处理多糖的显色溶液在400~600 nm的波长处存在一个特征吸收峰,最大吸收峰对应的波长为485 nm,在此波长下,0.00~0.1 mg/mL的多糖与吸光度值具有良好的线性关系,线性方程为y=6.213 4x+0.134 3,R2=0.955 3。在优化条件下枸杞提取液的多糖含量为0.066 7 mg/mL,在相同条件下未经超声处理的枸杞提取液中多糖含量为0.058 55 mg/mL,在优化条件下多糖提取率相比空白组提高了13.92%。
3 结论
超声处理有利于枸杞中抗氧化活性物质的提取,采用EPR技术研究枸杞提取液的抗氧化活性可以避免枸杞提取液颜色的干扰,提高测定结果的准确性。通过芬顿反应和自制合成材料的引用可以丰富枸杞提取液抗氧化活性清除指标。均匀试验优化结果为料液比1∶50、溶剂比1∶500、超声时间30 min、超声功率40 W,在此条件下得到的枸杞提取液对DPPH·的清除率为92.34%,β-胡萝卜素含量为0.424 mg/mL,类胡萝卜素含量为141.6 mg/100 g,黄酮含量为0.039 2 mg/mL,枸杞多糖含量为0.066 7 mg/mL。超声辅助可以提高枸杞提取液的抗氧化活性以及黄酮、枸杞多糖等具有抗氧化功能的活性物质。
