生姜汁对LPS诱导肺炎小鼠肠道菌群的调节作用
2023-02-16刘子铭王文静朱鹏超朱锦璐丁宇航韩明洋王晓龙
刘子铭,王文静,朱鹏超,朱锦璐,丁宇航,韩明洋,王晓龙,2
(1山东中医药大学,济南 250355;2山东中医药大学实验中心,济南 250355)
急性肺损伤(ALI)是临床常见的呼吸系统疾病[1],目前研究主要在与ALI的发展和进展有关的血浆和分子生物标志物上,但因其发病机制较为复杂,目前治疗效果尚不理想。研究发现,肠道菌群失调能够诱导多种疾病产生[2-3],而肺部疾病也会导致肠道菌群的失调,进而影响肠黏膜结构与功能[4]。生姜汁(ZOS)可以调节肠道菌群结构、丰富菌群丰度、增加菌群多样性,以缓解炎症、恢复肠道微环境[5-6]。因此,本研究基于16S rDNA技术,探讨ZOS对脂多糖(LPS)诱导急性肺损伤小鼠肠道菌群影响,进而分析肠道菌群对急性肺损伤的影响。
1 材料
1.1 实验动物
取SPF 级Balb/c雄性小鼠,6~8 w龄,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0006。饲养于山东中医药大学 SPF 级动物房,观察小鼠生长情况,按时更换垫料、饲料及饮用水。本实验经山东中医药大学医学与实验动物伦理委员会审查通过。
1.2 药物与试剂
ZOS(自制,由鲜生姜榨汁后,进行过滤制备而成);异氟烷(深圳市瑞沃德生命科技有限公司,货号R510-22-16);LPS(美国sigma公司,货号L2880);磷酸盐缓冲液(PBS)(上海源培生物科技股份有限公司,货号B310KJ)。
1.3 仪器
电子天平(EX225ZH/AD),奥豪斯仪器有限公司;榨汁机(型号KP60SB),广东科嘉霖电器制造有限公司;增强型小动物麻醉机(型号R540IE),深圳市瑞沃德生命科技有限公司;Illumina MiSeqPE300测序平台,由上海美吉生物医药科技有限公司提供。
2 方法
2.1 ZOS制备
取适量新鲜生姜,去皮洗净,切成小块,加入适量生理盐水榨汁,4层纱布过滤,制成3 g/mL的ZOS,每日现榨现用。
2.2 动物分组及给药
将Balb/c小鼠按体重分为对照组、LPS模型组、ZOS组。ZOS组通过灌胃方式给予ZOS 3 g/mL,对照组、LPS模型组灌胃生理盐水,连续灌胃给药14 d。
2.3 LPS诱导急性肺损伤小鼠模型建立
电子天平称取适量LPS粉末,以无菌PBS稀释为2.5 mg/mL,采用异氟烷呼吸麻醉的方式将小鼠麻醉,对照组小鼠鼻腔滴入20 μL生理盐水,其余组小鼠鼻腔滴入2.5 mg/mL的LPS 20 μL,完成造模。
2.4 粪便收集及肠道菌群检测
实验动物造模后禁食不禁水12 h。轻轻抓握小鼠刺激排便,并迅速用无菌EP管接取粪便,每只小鼠取2粒,迅速转移至-80 ℃保存。获得粪便样本共15个,每组5个,DNA提取及Illumina Miseq PE300测序由上海美吉生物医药科技有限公司完成。
2.5 肺指数
小鼠取粪便后处死,摘取全肺,剔除结缔组织,万分之一电子天平称定质量并计算肺指数(肺重/体重)。
2.6 测序分析
测序数据通过美吉公司云平台微生物多样性QIIME2流程进行分析。根据扩增子序列变异(ASV)对肠道菌群进行Alpha 多样性分析等。为研究不同样本间的差异关系,找出不同组间在丰度上的差异物种,进行 Beta 多样性、LEfSe 分析等。
2.7 统计学分析
数据分析采用单因素方差分析,使用Graphpad Prism 8.0.2软件,P<0.05具有统计学意义。
3 结果与分析
3.1 ZOS对急性肺损伤小鼠肺指数的影响
相比于对照组,模型组肺指数显著升高(P<0.05)。与模型组相比,ZOS组肺指数明显下降(P<0.05),表明给予ZOS后,可改善肺损伤情况(图1、附表)。

附表 ZOS对急性肺损伤小鼠肺指数的影响

图1 ZOS对急性肺损伤小鼠肺指数的影响
3.2 数据质控及ASV分析
粪便样本共15个,共获得优化序列710 298条,所测样本中最高序列条数55 641,最低序列条数36 286。使用DADA2方法降噪后共生成822个ASV,按样本最低序列条数进行抽平处理,得到822个ASV。在ASV水平上对不同样本间的异同进行统计,并通过Venn图展现不同样本之间共有或特有的ASVs。对照组ASV 506个、模型组ASV 584个、ZOS组ASV 556个,这提示,LPS感染小鼠菌群多样性升高,给予生姜汁治疗后,小鼠菌群多样性降低;对照组与模型组非共有的ASV 340个,表明LPS感染小鼠粪便菌群组成发生显著变化;ZOS组与模型组非共有ASV 358个,对照组与ZOS组非共有ASV 334个,表明给予ZOS后可以降低粪便菌群多样性(图2)。
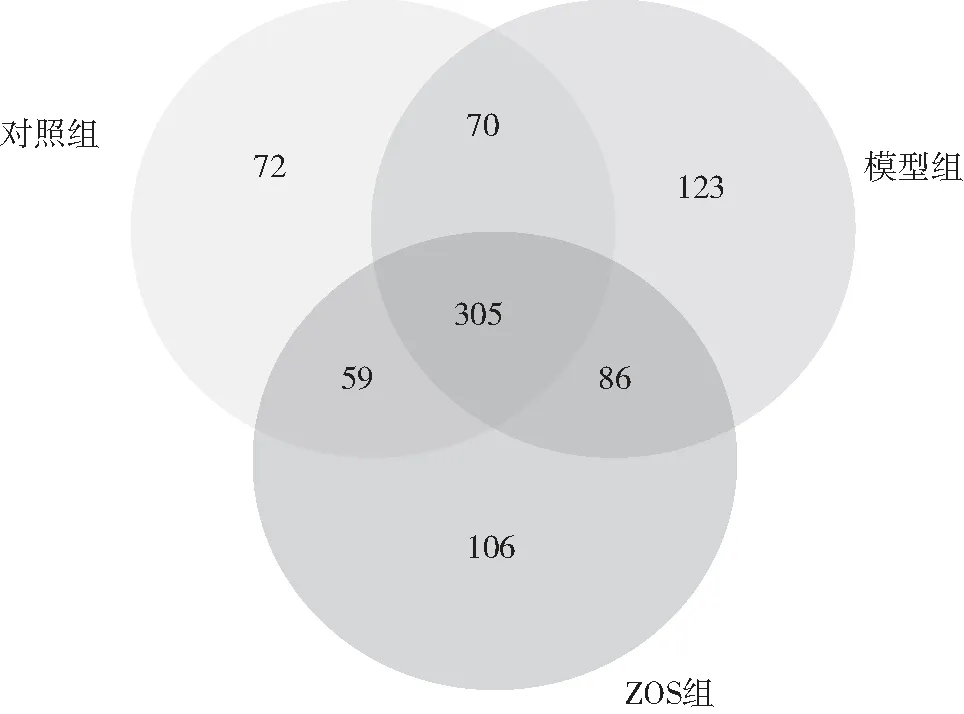
图2 各组菌群的ASV分布
3.3 Alpha多样性分析
3.3.1 稀释性曲线分析 随机抽取样本,计算并作图,其中 X 轴代表每个样本随机抽取的序列条数、Y 轴代表Sobs指数,当曲线趋向平坦时,说明测序数据量合适。图3结果表明,每个样本随机抽取的序列条数与Sobs指数曲线均趋向于平坦状态,表明各组小鼠粪便样本取样数量合理。
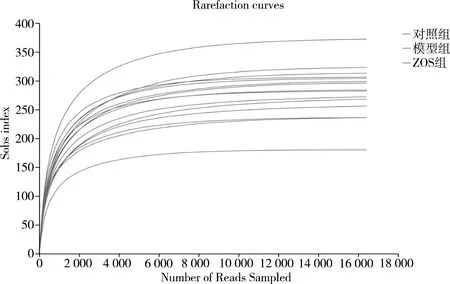
图3 稀释性曲线分析图
3.3.2 Alpha多样性指数分析 相比于对照组,模型组群落丰富度有上升趋势;而相比于模型组,ZOS组群落丰富度下降。结果提示,ZOS具有改善急性肺损伤小鼠肠道菌群的多样性的作用(图4、图5)。
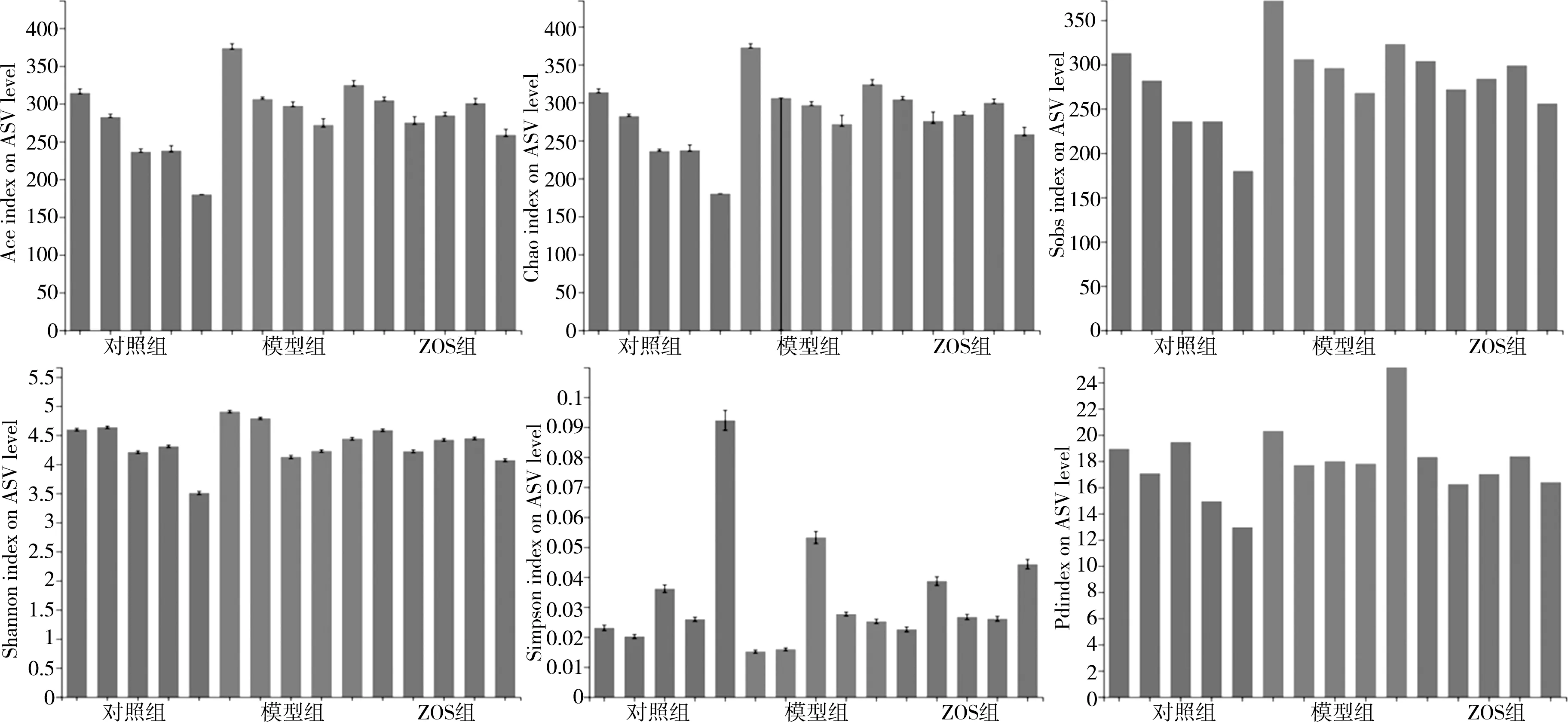
图4 Alpha多样性指数柱形图
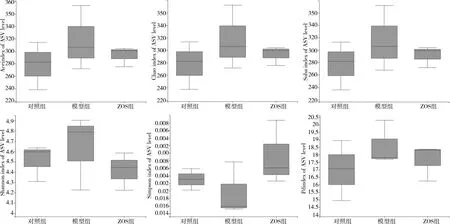
图5 Alpha多样性指数组间差异检验箱式图
3.4 Beta多样性分析
3.4.1 PCA与PCoA分析 如图6所示,模型组与对照组、ZOS组距离均较远,认为模型组与其余2组的肠道菌群种类具有明显差异;并且ZOS组与对照组菌群结构距离相近,表明在给予ZOS治疗后,可明显改善急性肺损伤小鼠肠道内菌群,使之趋于正常。

图6 PCA与PCoA分析
3.4.2 Hcluster分析 图7结果显示,与对照组相比,模型组小鼠肠道菌群发生明显变化,而ZOS可以改善急性肺损伤小鼠肠道菌群的结构,使之趋于对照组。

图7 UPGMA层次聚类分析图
3.5 物种分析
3.5.1 门水平(Phylum)物种组成分析 图8结果显示,各样本在门水平上相比,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)的菌群表现出较高的丰度。相比于对照组,LPS模型组肠道菌群中有2种菌群丰度有较为明显变化,厚壁菌门菌群丰度上升,拟杆菌门菌群丰度降低。而ZOS组中表现出与模型组截然相反的情况,厚壁菌门丰度降低,拟杆菌门菌群丰度上升。上述结果表明,ZOS可以改善LPS诱导急性肺损伤小鼠肠道中厚壁菌门和拟杆菌门的菌群丰度。
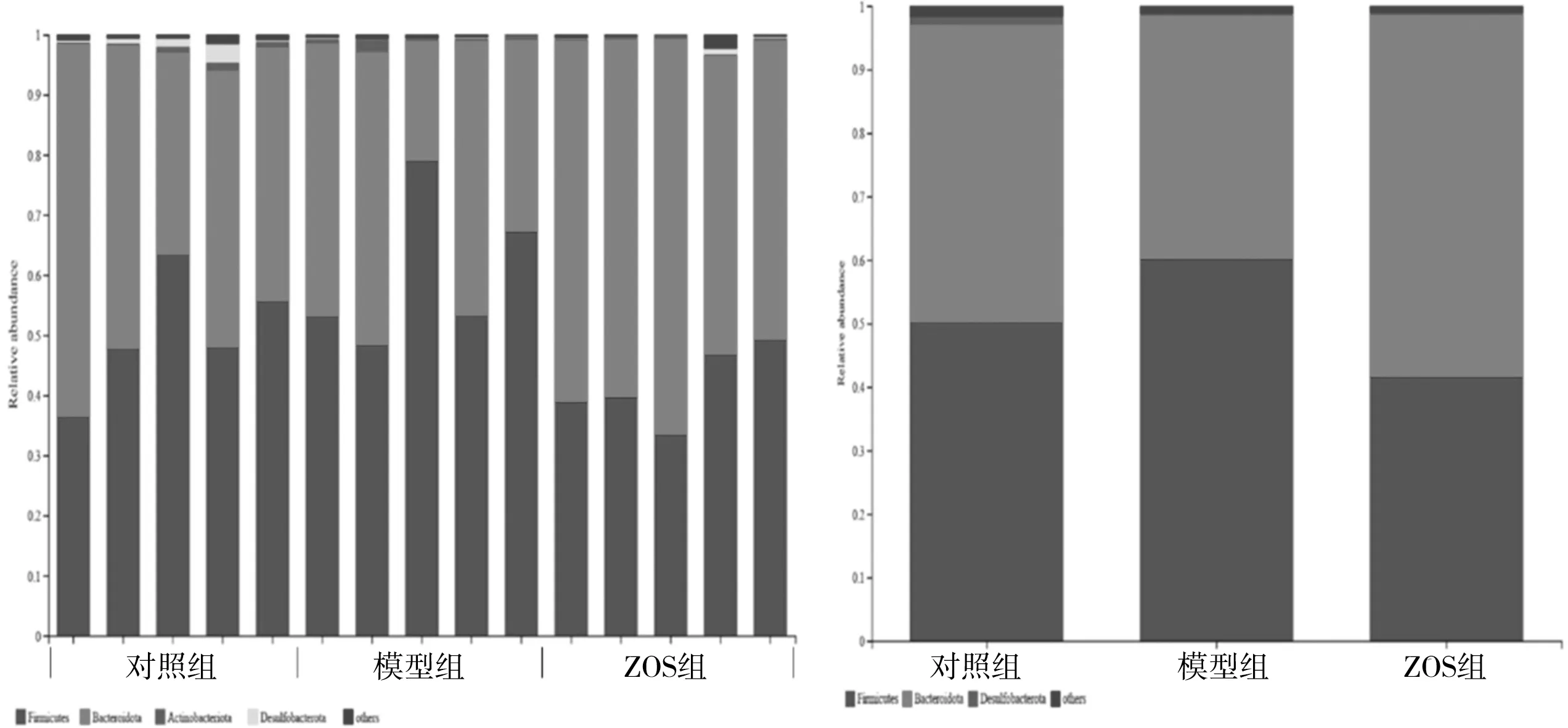
图8 粪便菌群门水平相对丰度图
3.5.2 目水平(Order)物种组成分析 图9结果显示,各组样品中主要包括7个目,分别是拟杆菌目(Bacteroidales)、乳螺目(Lachnospirales)、梭菌目UCG-014(Clostridia_UCG-014)、振螺目(Oscillospirales)、乳杆菌目(Lactobacillales)、Clostridia_vadinBB60_group、脱硫弧菌目(Desulfovibrionales),其中排名前4位的是拟杆菌目、乳螺目、梭菌目UCG-014和振螺目。与对照组相比,模型组小鼠中拟杆菌目、乳螺目菌群丰度降低,梭菌目和振螺目菌群丰度升高;给予ZOS后,小鼠粪便中拟杆菌目菌群丰度升高,梭菌目菌群丰度降低。
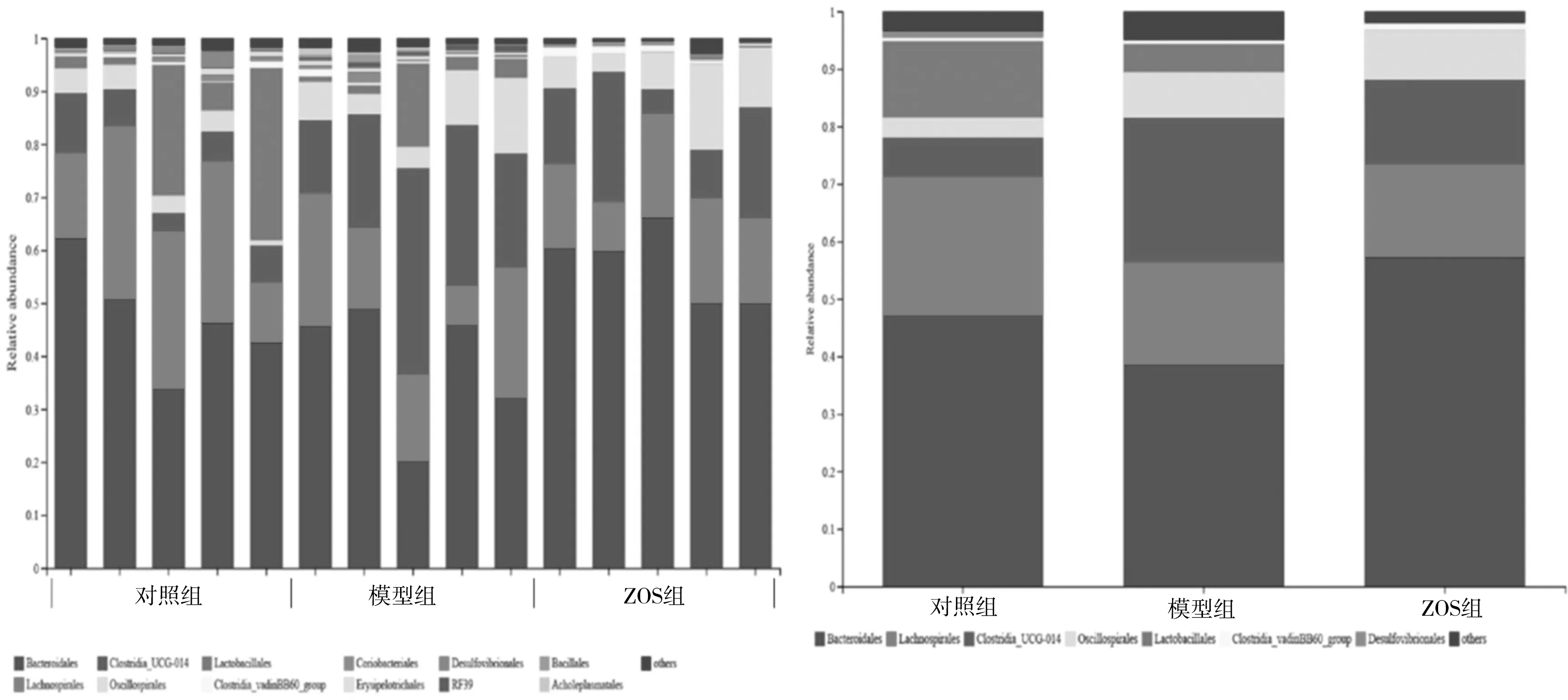
图9 粪便菌群目水平相对丰度柱状图
3.5.3 属水平(Genus)物种组成分析 图10结果显示,样本中细菌群落组成中包括的菌属有19种,分别为Muribaculaceae、Clostridia_UCG-014、Lachnospiraceae、乳杆菌属(Lactobacillus)、普雷沃氏菌属UCG-001(Prevotellaceae_UCG-001)、拟杆菌属(Bacteroides)、毛螺菌属NK4A136(Lachnospiraceae_NK4A136_group)、拟普雷沃氏菌属(Alloprevotella)、Oscillospiraceae、另支菌属(Alistipes)、罗氏菌属(Roseburia)、Muribaculum、Oscillospiraceae、Lachnospiraceae、Clostridia_vadinBB60_group、Ruminococcaceae、理研菌科RC9_gut_group(Rikenellaceae_RC9_gut_group)、嗜木聚糖真杆菌(Eubacterium_xylanophilum_group)、脱硫弧菌属(Desulfovibrio)。与对照组相比,模型组中Muribaculaceae、Lachnospiraceae、乳杆菌属、拟杆菌属、毛螺菌属NK4A136、Muribaculum、Lachnospiraceae、Lachnospiraceae、脱硫弧菌属菌群丰度有较为明显的下降趋势,Clostridia_UCG-014、拟普雷沃氏菌属、Oscillospiraceae、Eubacterium_xylanophilum_group菌群丰度有明显上升趋势。与模型组相比,ZOS组Muribaculaceae、Lachnospiraceae、普雷沃氏菌科UCG- 001、拟杆菌属、拟普雷沃氏菌属、Oscillospiraceae、Clostridia_vadinBB60_group、Ruminococcaceae菌群丰度有上升趋势,Clostridia_UCG-014、毛螺菌科NK4A136、罗氏菌属、Lachnospiraceae、嗜木聚糖真杆菌的菌群丰度有明显下降趋势,提示给予ZOS后,可明显改善急性肺损伤小鼠肠道菌群丰度,使之趋于对照组。

图10 粪便菌群属水平相对丰度图
3.5.4 Heatmap分析 菌群Heatmap分析结果表明,对照组与模型组菌群结构有明显不同,提示肺损伤可改变菌群结构,造成肠道菌群失调,与模型组相比,ZOS组小鼠的肠道菌群结构有所改善(图11)。

图11 水平菌群 Heatmap 分析
3.6 LEfSe分析
该方法设定 LDA 得分值>4找到组间丰富度存在显著差异的物种。图12结果表明,与对照组相比,模型组的差异物种主要为厚壁菌门、颤螺旋菌科(Oscillospiraceae)、Clostridia_UCG-014;与模型组相比,ZOS组差异主要表现在拟杆菌纲(Bacteroidia)、拟杆菌门、拟杆菌目、Muribaculaceae、普雷沃氏菌科。

图12 LEfSe分析
4 讨论
生姜对肠道菌群具有多种调节作用。生姜提取物能显著抑制金黄色葡萄球菌、枯草芽孢杆菌等[7]菌群的繁殖。生姜中的6-姜酚对幽门螺杆菌具有显著抑制作用[8]。干姜对肠道菌群也具有调控作用[9],如对肠杆菌的抑制作用、对肠道乳酸杆菌的促进作用等[10]。本研究通过小鼠滴鼻LPS构建急性肺损伤模型,造模后小鼠肺重及肺指数明显增加,肠道菌群多样性及丰度发生明显改变,Muribaculaceae、Lachnospiraceae、乳杆菌属、拟杆菌属、毛螺菌属NK4A136、Muribaculum、Lachnospiraceae、Lachnospiraceae、脱硫弧菌属菌群丰度明显下降,Clostridia_UCG-014、拟普雷沃氏菌属、Oscillospiraceae、Eubacterium_xylanophilum_group菌群丰度明显上升。经ZOS治疗后,小鼠的肺重、肺指数显著降低,肠道菌群的多样性及丰度有所改善,Muribaculaceae、Lachnospiraceae、普雷沃氏菌科UCG-001、拟杆菌属、拟普雷沃氏菌属、Oscillospiraceae、Clostridia_vadinBB60_group、Ruminococcaceae菌群丰度呈上升趋势,Clostridia_UCG-014、毛螺菌科NK4A136、罗氏菌属、Lachnospiraceae、嗜木聚糖真杆菌的菌群丰度有明显下降趋势,菌群结构更加稳定。提示调节肠道菌群可能是治疗肺损伤的方法之一。
肠道菌群在抵抗病原体,提高机体免疫功能方面能发挥重要作用[11-12]。肠-肺轴(GLA)具有复杂相互作用及局部和深远免疫效应的特点[13-14]。Muribaculaceae存在于小鼠肠道中涉及复杂的碳水化合物降解[15],在降解碳水化合物方面发挥作用。Lachnospiraceae被认为在代谢性疾病[16]、肝脏疾病[17]、肾病[18]、肠炎[19]及与肠脑轴相关的肠胃失调疾病[20-21]中发挥重要作用。拟杆菌属与多种疾病发生有密切联系,如结肠炎[22]、结肠癌[23]等。本研究未明确的部分菌群仍需进一步验证。
