甜酒曲根霉的筛选及发酵特性研究
2023-02-16王家胜肖钧文周海波程应春邱燕翅方尚玲陈茂彬
王家胜,肖钧文,周海波,程应春,杨 倩,邱燕翅,方尚玲,陈茂彬
(1.湖北工业大学生物工程与食品学院,湖北省酿造工艺与装备工程技术研究中心,湖北武汉 430068;2.孝感亲亲生物科技有限公司,湖北孝感 432100)
在中国传统酿造过程中,酒曲是不可或缺的核心材料,是酿造微生物和功能酶的主要载体,直接决定着酿造酒体的品质和风格特性[1]。酒曲有着上千年的历史,经过长时间的选择或自然淘汰,弱势菌株被淘汰,优势菌株被保留下来。前人的大量研究表明,酒曲中主要有三大类微生物,即酵母菌、霉菌和细菌。酒曲中含有丰富的霉菌资源,酒药中起主要作用的微生物是根霉[2-3]。
根霉是米酒曲中最常见的霉菌之一[4]。它不但有较强的糖化作用,能将原料中的淀粉转化为可发酵性糖,而且还有一定的酒化作用,能将糖转化为乙醇,还能产蛋白酶、酒化酶和脂肪酶等一系列酶系[5]。甜酒曲中根霉菌株的优劣一般从两个方面进行评估[6-10]:菌株的理化指标方面,液化力、糖化力是判断菌株优劣的两项重要衡量标准;发酵产品的质量方面。
本实验对市场上公认较好的2 个地区的特色酒曲中的根霉进行分离纯化以及特性研究,以优良菌株Q303 作为对照,筛选出2 株优质根霉,研究其发酵性能及发酵产物。丰富了米酒曲根霉菌库,提高了出酒率,降低了生产成本,亦可为后期开发多菌种复合甜酒曲提供实验依据。
1 材料与方法
1.1 材料、试剂及仪器
酒曲:江西酒曲、贵阳酒曲;糯米:孝感市朱湖农场。
马铃薯琼脂固体培养基(PDA):土豆200 g,葡萄糖20 g,蒸馏水1000 mL,pH 值自然。固体培养基需加入2%的琼脂,115 ℃灭菌20 min。
试剂:硫酸铜、酒石酸钾钠、氢氧化钠、冰醋酸、醋酸钠、亚甲基蓝、碘化钾,国药集团化学试剂有限公司。
仪器与设备:LRH-250 恒温生化培养箱,上海智城分析仪器有限公司;HH-6数显恒温水浴锅,浙江金坛市富华仪器有限公司;LDZX-50KBS 高压蒸汽灭菌锅,上海申安医疗器械厂;5977B-7890B气相色谱质谱联用仪,美国安捷伦公司。
1.2 实验方法
1.2.1 菌种的分离与纯化
在无菌条件下,将贵阳土曲、江西酒曲粉碎,分别称取10 g 样品,倒入装有90 mL 无菌生理盐水的三角瓶中,35 ℃摇床振荡20~30 min,用纱布过滤滤液,对其进行适当稀释后用涂布平板法涂于PDA固体培养基中。30 ℃下培养36~48 h,检查菌落情况。菌丝生长较为明显时,用接种针挖掘一小块菌丝移植于另一PDA 平板培养基中。从平板培养基中挑选出单菌落转接到PDA 培养基,30 ℃培养48 h 后,进一步挑取单菌落转接和镜检,多次分离纯化根霉。将分离的根霉转入PDA 斜面上培养,长出菌丝后即可放入4 ℃冰箱中保存备用[11]。
1.2.2 测定霉菌糖化酶活力
糖化酶活力定义:1 g 干曲,40 ℃、pH4.6、1 h 内水解可溶性淀粉为葡萄糖的毫克数(mg/h·g)。
1.2.2.1 米粉曲的制备
米粉曲的制作采用生料制曲。将籼米进行粉碎,紫外杀菌20 min 待用。按称取米粉量的40 %无菌水量,先用无菌水对斜面进行孢子洗脱,后倒入米粉中搅拌均匀,压实后,保持湿度80 %,温度32 ℃恒温培养72~90 h。期间每隔12 h 翻曲一次。培养完成后置于40 ℃烘箱烘干备用。
1.2.2.2 粗酶液的提取
取1g 米粉曲磨碎后加入18 mL 水和2 mL 乙酸-乙酸钠溶液,40 ℃水浴锅中浸提1 h,间隔5 min搅拌一次,补水至25 mL后过滤得粗酶液[12]。
1.2.2.3 糖化酶活力的测定
取12.5 mL、2 %的淀粉溶液(现用现配)于60 ℃水浴锅中预热10 min,加入1 mL 粗酶液,在40 ℃水浴锅中反应1 h 后,加入7.5 mL、0.1 mol/L NaOH 中止反应,定容至25 mL,即得样品。取1 mL样品于试管中,再加入2 mL 3,5-二硝基水杨酸,水2 mL,摇匀,置于沸水浴中加热5 min,将其移出,冷却到室温,然后用蒸馏水定容到25 mL。摇匀,在540 nm波长下对其进行比色,并测量吸光度。
计算公式如下:
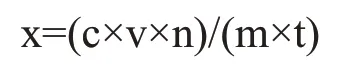
式中:x——糖化酶活力,mg/h·g;
c——由葡萄糖标准曲线查得的葡萄糖含量,mg/mL;
v——糖化酶原液总体积,mL;
n——酶液稀释倍数;
m——干曲质量,g;
t——糖化时间,h。
1.2.3 液化酶活力的测定
1.2.3.1 标准颜色的配制
在50 mL 试管中加入5 mL 稀碘液,再滴入1~2滴糊精溶液,摇匀。
1.2.3.2 固体曲浸出液的制备
取5 g 酒曲粉(精确至0.0001 g),用少量磷酸缓冲液充分溶解,于40 ℃水浴锅中浸取2 h,每隔15 min 搅拌1 次(保证酶液完全浸取出来,并将酒曲自身的淀粉消耗殆尽),将上清液小心倾入容量瓶中,若有剩余残渣,再加少量磷酸缓冲液充分研磨,最终样品全部移入100 mL 容量瓶中,用磷酸缓冲液定容至刻度,摇匀。4 层纱布过滤,滤液待用。
吸取25 mL 20.0 g/L 可溶性淀粉溶液和5 mL磷酸缓冲溶液于100 mL 试管中,35 ℃水浴保温10 min,加入固体曲浸出液2 mL 及10 mL 水,充分摇匀,开始计时。于40 ℃保温,定时取出1 滴反应液加入装有稀碘液的试管内,观察颜色变化。当碘液颜色与标准颜色一致时即反应终点,立即记录液化时间t(min)[13]。
1.2.3.3 计算
固体曲液化力的定义:在35 ℃,1 g 酒曲1 h 液化可溶性淀粉的质量。
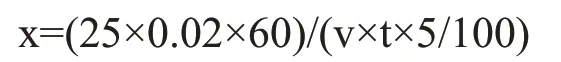
式中:x——液化力(可溶性淀粉),g/g·h;
25.0——可溶性淀粉溶液用量,mL;
0.020——可溶性淀粉溶液浓度,g/mL;
v——加入的固体曲浸出液的体积,mL;
60——1 h换算成的分钟数,min;
t——液化时间,min。
1.2.4 GC-MS对根霉菌发酵产物的对比分析
顶空固相微萃取气相色谱质谱(GC-MS)联用技术具有分离高效、定性准确、灵敏度高等优点[14-15],已成为研究香气成分的有效手段并被广泛应用[16-18]。
根霉菌发酵液的培养:将前期分离纯化好的根霉菌取一环接入配制好的PDA 固体培养基中,30 ℃培养箱中培养2 d,待长出孢子后,将3 株根霉菌各取一环分别接种于PDA 斜面上,30 ℃条件下培养3 d。根霉长出明显的菌丝之后,取1~2 环孢子于10 mL 的无菌生理盐水中,采用血球计数板计数的方法将其稀释成108cfu/g。取1 mL 孢子悬液接种于100 mL PDA 液体培养基中(pH 值自然),在30 ℃、138 r/min下培养5 d,即得根霉发酵液。
1.2.4.1 样品处理方法
准确移取发酵液清液6 mL 于30 mL 顶空瓶中,准确称取3 g NaCl,加入搅拌子,将顶空瓶密封好,于60 ℃的恒温磁力搅拌器上平衡10 min,转速为300 r/min;将装有萃取纤维的进样手柄插入顶空瓶,推出萃取纤维(纤维与液面保持1 cm),在同样温度、转速条件下吸附40 min。萃取完成后,取出萃取纤维插入进样口解吸3 min,进样口温度为260 ℃,然后用GC-MS分析[19]。
1.2.4.2 仪器处理方法
气相色谱条件:CP-WAX57CB 色谱柱(50 m×0.25 mm×0.20 μm);载气为高纯氦气(He),恒定流速为0.7 mL/min,采用不分流模式;色谱柱初始温度45 ℃保持1.5 min,以6 ℃/min 升至85 ℃不保持,再以4 ℃/min升至225 ℃保持15 min。
质谱条件:电子电离(electron ionization,EI)源,四极杆温度为150 ℃,传输线温度为250 ℃,离子源温度为230 ℃;电子能量70 eV,全扫描模式,扫描质量范围30~550 aum。
1.2.5 根霉曲试饭发酵特性的研究
酒酿样品的制备:将用分离的2 株根霉制作而成的根霉米曲按1.0%的比例接种到煮熟的糯米饭中,34 ℃培养箱中发酵。发酵24 h、32 h、40 h、48 h、60 h 分别取样,测定所得酒样的糖化酶活力、液化酶活力、总糖以及总酸的含量。
总糖的测定方法:根据黄酒的国家标准,采用廉爱农法测定总糖的含量[20],以每1000 mL 中糖的质量表示米酒中总糖的含量。
总酸的测定:采用国标GB/T 12456—2008《食品中总酸的测定》,用酚酞作为滴定的指示剂,以0.1 mol/L(精确至0.0001)的氢氧化钠为标准溶液对样品进行滴定,以每百毫升样品中酸的质量表示其总酸含量,以每1000 mL 中酸的质量表示米酒中总酸的含量。
2 结果与分析
2.1 根霉的分离与纯化
在马铃薯琼脂固体培养基(PDA)中经过多次分离与纯化后,从两个地区酒曲中共分离出2 株根霉菌,经鉴定后均为少根根霉(Rhizopus arrhizus),编号为Rhi-1(贵阳)和Rhi-2(江西)。
2.2 根霉不同形态下的观察
将分离所得的Rhi-1和Rhi-2菌株采用PDA培养基30 ℃培养3 d 后,发现Rhi-1 根霉由营养菌丝体产生匍匐菌丝向四周蔓延,菌落浓密,有放射状沟纹,棉花状,呈白色,上半部分为黑褐色,菌丝与培养基连接紧密,生长较旺盛;Rhi-2 菌丝较为疏松,有放射状沟纹,亦呈现出棉絮状,较为浓密,整体呈黑褐色,菌丝与培养基连接紧密,生长较旺盛。3种根霉显微镜下形态的观察结果见图1。

图1 3株根霉显微镜下形态(10×40)
2.3 根霉发酵能力对比
糖化、液化能力是衡量发酵能力的重要指标[21],3株根霉(干曲)的糖化力、液化力对比见表1。
由表1 可知,液化力Rhi-1>Q303>Rhi-2,糖化力Rhi-1>Q303>Rhi-2,Rhi-1 与Q303 发酵性能较优异,Rhi-2 相对较弱。因此,后续实验选择Rhi-1菌株与Q303菌株做发酵产物的比较分析。
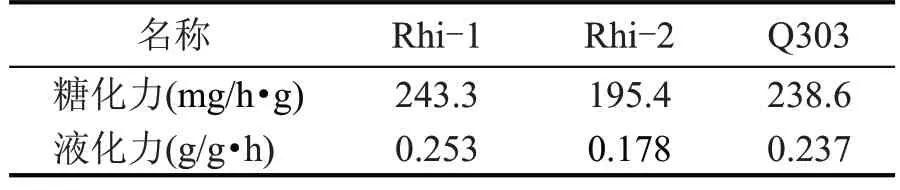
表1 根酶曲的酶活力测定结果
2.4 根霉发酵产物分析
使用GC-MS 技术对2 种不同根霉的发酵产物进行检测,主要成分的GC-MS 色谱图见图2,相对含量的分析结果见表2。
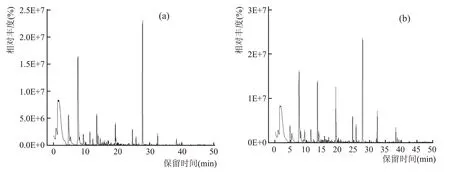
图2 根霉Q303(a)、Rhi-1(b)发酵产物主要风味成分GC-MS分析总离子流色谱图
由表2 可知,2 种不同发酵液共检测到22 种主要风味化合物,且2 株根霉产生最多的均是醇类。其中Q303醇类8种,Rhi-1醇类8种,两种根霉发酵产物差异不明显,但其相对含量有较明显区别。Q303 和Rhi-1 发酵产物中相对含量最多的醇类是异戊醇,其次是β-苯乙醇,Rhi-1 的β-苯乙醇相对含量约为Q303 的2 倍。β-苯乙醇不仅具有良好的抗菌性能,且香味浓烈,有玫瑰花香和木香[22]。Rhi-1 中也检测出含量高于Q303 的3-羟基-2-丁酮(乙偶姻),乙偶姻具有特殊的奶香味、蜂蜜般的甘甜味,是调香过程中极为重要的一种物质,也是酒中一种主要的香气成分,在名酒中的含量尤其高。Rhi-1 检测出特有的物质异己酸乙酯,若酒中含有微量的α-羰基(或羟基)异己酸乙酯时,与异戊醇共存会使酒的香气更为强烈,能丰富酒体的香气成分。醇类化合物是具有芳香气味的化合物,具有蜜香玫瑰味。Rhi-1在风味化合物的丰度和含量上较Q303有一定的优势。
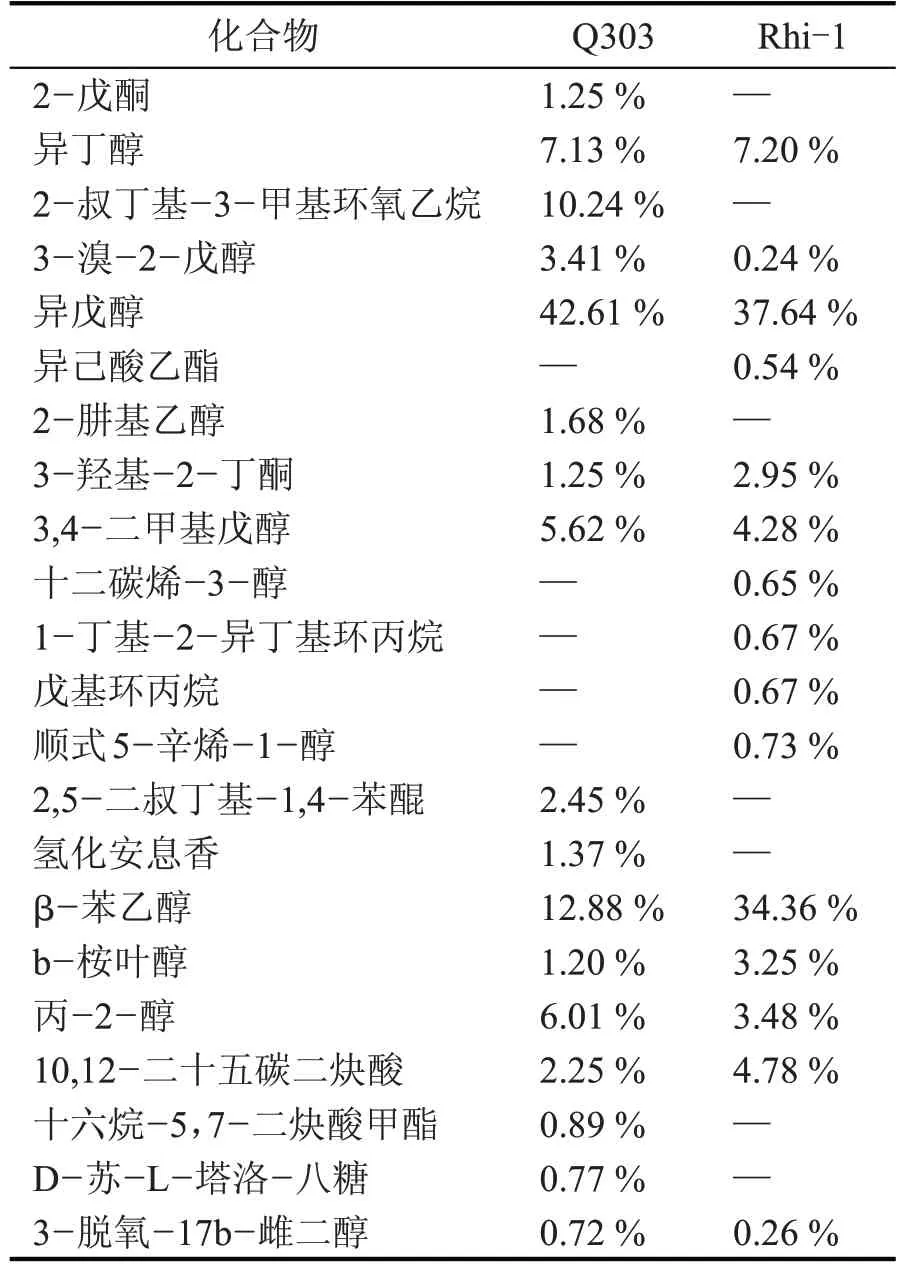
表2 根霉主要发酵产物种类及相对含量
2.5 根霉曲试饭发酵特性的研究
利用Q303、Rhi-1 两株根霉制作好的根霉曲,对蒸熟的糯米进行糖化发酵试验,在34 ℃恒温条件下培养,分别取24 h、32 h、40 h、48 h、60 h的米酒样品。对得到的米酒样品分别测定糖化酶活力、液化酶活力、总糖、总酸,探究2 株根霉的发酵特性。实验结果见图3。
由图3(a)可知,Q303 根霉曲在24 h 时糖化酶活力较高,随着发酵的进行,糖化酶活力呈增长的趋势,在32 h 时糖化酶活力达到256 mg/h·g,随后有下降的趋势,发酵时间在40~48 h 时糖化酶活力下降较快,两个时间段差值达到了102.5 mg/h·g,最后在48~60 h 时趋于平稳。Rhi-1 根霉曲在32 h时糖化酶活力高于Q303,达到了278.3 mg/h·g,后期下降并趋于稳定。说明Rhi-1 是一株有着良好糖化力的根霉,Q303 与Rhi-1 的变化趋势大致相同。
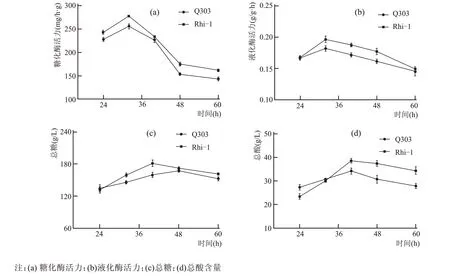
图3 两种曲不同发酵阶段米酒的各项指标
由图3(b)可知,Rhi-1 根霉曲在24 h 时,液化酶活力与Q303 根霉曲差距不明显,但在32 h 时,液化酶活力最强且高于Q303 根霉曲,此时,Rhi-1 根霉曲的液化酶活力达到0.197 g/h·g。Q303 根霉曲和Rhi-1 根霉曲的液化酶活力呈先增后降的趋势,均在32 h 最高。证明Rhi-1 根霉曲是一株液化能力非常好的甜酒曲。
由图3(c)可知,Rhi-1 根霉曲所得发酵酒的总糖含量是2 种发酵酒中最高的,在40 h 时达到了181.5 g/L,此时由Q303 根霉曲制成的发酵酒总糖为159.6 g/L。2株根霉菌曲所得发酵酒的总糖含量呈先增加后下降趋势,均在40 h 达到峰值。印证了Rhi-1 根霉曲和Rhi-2 根霉曲的糖化力在32~40 h阶段是最高的,在这一时间段,大量的淀粉被转化为葡萄糖。在发酵后期两者总糖含量均有不同程度的下降,可能是一些酒化酶将还原糖转化为乙醇的缘故。
由图3(d)可知,在发酵初期,Q303 根霉曲产酸能力强于Rhi-1,其中Q303 根霉曲所得发酵酒总酸为27.2 g/L,Rhi-1 为23.3 g/L。Q303 根霉曲和Rhi-1 根霉曲所得发酵酒的总酸含量变化趋势接近,均在40 h 含量最高,在该时间段Rhi-1 根霉曲所得发酵酒的总酸含量高于Q303,分别为38.5 g/L、34.1 g/L。2 株根霉制曲所得发酵酒的总酸在整个发酵过程中变化较小,可能与单一的根霉菌种有关。
3 结论
从贵州土曲和江西酒曲中分离筛选出2 株根霉菌Rhi-1、Rhi-2,经菌落形态观察和显微观察,初步鉴定为根霉种。将其与传统优秀菌株Q303 做比对,经初步筛选,Rhi-1 是一株糖化力、液化力性能良好的根霉。将Rhi-1 与Q303 进行发酵产物及根霉曲试饭发酵特性研究。结果表明,这两株根霉在发酵产物、理化特性、以及酒酿的各项指标方面都有差异,但在产酸能力上差异较小。Rhi-1 液化能力、糖化能力均高于Q303,是一株发酵性能良好的根霉菌株,后期可寻求方法以进一步提高其发酵性能。纯种根霉菌制曲发酵所得米酒稳定安全,但其风味较单一,酒体没有层次感,可能是菌种单一,酶系丰度不够。有研究发现,多种酵母与霉菌复配发酵米酒可产生独特香味成分[23],况启生等[24]用不同菌种混合制曲生产多种风味的米酒;张新武等[25]从客家糯米酒药曲中分离出两株根霉和酵母,通过复配开发得到了强化曲。后期可围绕根霉Rhi-1 进行更深层次的研究,探究提高其发酵性能的方法以及多菌种复合制造酒曲的可能性以丰富米酒的风味及口感。
