鉴别牛结节性皮肤病病毒双重荧光定量PCR 检测方法的建立及应用
2023-02-15赵钟毅闭璟珊尹德玮吕荞吴健皓韦正吉邹联斌苏姣秀汪伟辛佳亮彭久青李文静郑敏胡传活
赵钟毅,闭璟珊,尹德玮,吕荞,吴健皓,韦正吉,邹联斌,苏姣秀,汪伟,辛佳亮,彭久青,李文静,郑敏,胡传活
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西动物疫病预防控制中心,广西南宁 530000;3.温州大学病毒学研究所,浙江温州 325035;4.四川农业大学动物医学院,四川成都 611130)
牛结节性皮肤病(lumpy skin disease,LSD)是由牛结节性皮肤病病毒(lumpy skin disease virus,LSDV)引起牛的一种急性热性传染病,临床表现为发热、皮肤水肿及局部有坚硬结节块或溃疡[1-2]。LSDV 同绵羊痘病毒(sheeppox virus,SPPV)、山羊 痘病 毒(goatpox virus,GTPV)共同组成痘病毒科羊痘病毒属(Capripoxvirus,CaPV)。LSD暴发流行可造成养牛业严重经济损失,因此被世界动物卫生组织(WOAH)列为须报告动物疫病,被我国划定为二类动物疫病。2019年8 月,LSD 疫情在我国新疆首次暴发,随后蔓延到其他多个地区[3]。
接种疫苗和精准诊断是有效防控LSD 的重要措施[4]。目前,我国主要通过接种GTPV 弱毒活疫苗预防LSD。由于LSDV、GTPV 和SPPV 的基因组和编码蛋白质高度相似,在血清学上尚无法有效鉴别,因此临床上有必要建立一种能同时检测并有效鉴别LSDV 和CaPV 其他成员的快速检测方法。荧光PCR 具有特异性强、灵敏度高、快速高效、操作便捷等特点,已成为实验室广泛使用的诊断技术。本研究针对LSDV010基因保守区域设计特异性引物及TaqMan 探针,与文献[5]设计的CaPV068基因通用引物及探针组合,通过优化反应体系和条件,建立了一种可同时检测并鉴别LSDV 和CaPV 其他成员的双重荧光定量PCR 检测方法,以期为优化LSDV 临床诊断和日常监测提供技术支撑。
1 材料与方法
1.1 病毒与疫苗
GTPV 疫苗(AV41 株)、痘苗病毒(vaccinia virus,VACV)天坛株,由军事兽医研究所病毒学及免疫学实验室惠赠;水牛匈奴病毒(buffalo hunnivirus,BufHuV)、牛肠道病毒(bovine enteroviruses,BEV),由广西大学动物科学技术学院预防与传染病实验室黄伟坚课题组惠赠;口蹄疫(foot-and-mouth disease virus,FMDV)O 型、A 型二价灭活疫苗(OHM/02 株+AKT-Ⅲ株),购自内蒙古必威安泰生物科技有限公司(批号:HAC220715);小反刍兽疫(peste des petits ruminants virus,PPRV)活疫苗(Clone9 株),购自天康生物制药有限公司(批号:2022004-1);禽痘病毒(fowlpox virus,FWPV)疫苗(282E4株)、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)、羊口疮病毒(orf virus,ORFV)、LSDV 阳性样品核酸、GTPV 阳性样品核酸、542 份临床样品,均由本实验室保存。
1.2 主要试剂
TIANamp Virus DNA/RNA Kit(批 号:MLLTU8428),购自天根生化科技(北京)有限公司;PrimeScriptTMII 1st Strand cDNA Synthesis Kit(批号:AL61653A)、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver 4.0(批 号:AK1801)、TaKaRa MiniBEST Plasmid Purification Kit Ver 4.0(批号:AL61448A)、E.coliDH5α Competent Cells(批 号:AK71028A)、T-Vector pMDTM19(Simple)(批 号:AIF1958A)、PremixTaqTM(TaKaRaTaqTMVersion 2.0 plus dye)(批 号:AI81195A)、Premix ExTaqTM(Probe qPCR)(批 号:AL20582A)、dNTP Mixture(批 号:AM10727A),均购自宝生物工程(大连)有限公司。
1.3 引物和探针
下载GenBank 中NI-2490(AF325528.1)、Russia/Saratov/2017(MH646674.1)、China/GD01/2020(MW355944.1)、HongKong/2020(MW732649.1)等流行毒株和疫苗毒株Neethling/OBP(KX764645.1)等38 个LSDV 毒株及15 个SPPV、GTPV 毒株的全基因组序列。利用Mega 软件进行序列分析比对,Oligo7 软件针对LSDV010保守区域设计1 对特异性引物及TaqMan 荧光探针。根据文献[5],合成CaPV 通用型引物和MGB 探针(表1)。引物和探针均由生工生物工程(上海)股份有限公司合成。
1.4 病毒核酸提取
根据TIANamp Virus DNA/RNA Kit 试剂盒说明书抽提样品中病毒总核酸,-20 ℃保存备用。根据PrimeScriptTMII 1st Strand cDNA Synthesis Kit试剂盒说明书将抽提的BVDV、BufHuV、BEV、FMDV 和PPRV 的RNA 反转录为cDNA,-20 ℃保存备用。
1.5 重组质粒标准品制备
以抽提的LSDV 基因组为模板,应用设计的引物分别进行PCR 扩增,建立25.0 μL PCR 反应体系:PremixTaqTM12.5 μL、上游引物(10 pmol/μL)1.0 μL、下游引物(10 pmol/μL)1.0 μL、DNA 模板1.0 μL、ddH2O 9.5 μL。LSDV010-F/R 反应条件:95 ℃ 5 min;95 ℃ 30 s,49 ℃ 30 s,72 ℃ 20 s,35 个循环;72 ℃ 10 min,4 ℃保存。CaPV068-F/R反应条件:95 ℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 20 s,35 个循环;72 ℃ 10 min,4 ℃保存。分别回收纯化PCR 产物,与T-Vector pMDTM19(Simple)载体进行连接并转化DH5α感受态细胞。挑取单菌落培养后提取质粒,将PCR 鉴定和测序正确的阳性重组质粒pLSDV-010、pCaPV-068 作为标准品,置于-80 ℃保存备用。利用NanoDrop 分光光度仪(Thermo Fisher,USA)测定重组质粒的D260 nm/D280 nm比值和浓度,选择比值范围在1.8~2.0的重组质粒。根据公式将质粒标准品浓度换算成拷贝数,质粒拷贝数=质粒浓度×10-9× 6.02×1023/(660×质粒长度)[6]。
1.6 反应条件优化和标准曲线建立
1.6.1 反应条件优化 将2 对引物和探针在同一反应体系中进行双重荧光定量PCR 扩增。采用方阵试验分别对引物终浓度(0.10~0.25 pmol/μL)、dNTP 终浓度、探针终浓度(0.10~0.25 pmol/μL)及退火温度(56~61 ℃)进行筛选优化。
1.6.2 标准曲线绘制 通过拷贝数计算公式,将2 种重组质粒标准品pLSDV-010 和pCaPV-068 的拷贝数浓度均调整为1.50×1010copies/μL,并以1:1 的比例混合在一起,之后进行10 倍梯度稀释,选择1.50×109~1.50×101copies/μL 9 个稀 释梯度的混合标准质粒作为模板,利用建立的双重荧光定量PCR 反应体系绘制扩增曲线和标准曲线。
1.7 特异性试验
以FWPV、IBRV、VACV、ORFV 的基因组DNA,BVDV、BufHuV、BEV、FMDV 和PPRV的cDNA 为模板,以LSDV、GTPV 基因组DNA为阳性对照,ddH2O 为阴性对照,应用建立的双重荧光定量PCR 方法进行检测,分析其特异性。
1.8 灵敏性试验
以1.50×109~1.50×100copies/μL 10 个梯度的混合标准质粒为模板,应用建立的双重荧光定量PCR 方法进行检测,检验其灵敏性。
1.9 重复性试验
以拷贝数浓度 为1.50×108、1.50×106、1.50×104copies/μL 的混合标准质粒为模板,应用建立的双重荧光定量PCR 方法扩增,进行组内重复性试验;用同样方法在不同时间对同批次提取的重组质粒进行组间重复性试验。通过评估组内与组间的变异系数(coefficient of variation,CV),评价该方法的重复性水平。
1.10 临床样品检测
应用本试验建立的双重荧光定量PCR 方法对2017年10 月至2022年11 月在广西各地区采集的542 份临床样品进行检测。以特异性结果为判定依据,若检测样品仅有FAM 通道出现典型扩增曲线且Ct ≤35,则判定为CaPV 成员病毒核酸阳性;若检测样品在FAM 和VIC 通道均出现典型扩增曲线且Ct ≤35,判定为LSDV 核酸阳性。同时采用《牛结节性皮肤病诊断技术》(GB/T 39602—2020)[7]及WOAH 推荐[8-9]方法对上述样品进行检测和结果判定。比较本研究所建方法与国家标准和WOAH 推荐方法的符合率。
1.11 统计分析
采用SPSS 21 软件对试验数据进行统计分析,应用χ2检验对临床样品的检测数据进行差异性比较。
2 结果
2.1 重组质粒鉴定
分别利用LSDV010-F/R 和CaPV068-F/R 对构建的重组阳性质粒pLSDV-010 和pCaPV-068 进行PCR 扩增。结果(图1~2)显示,目的DNA 片段分别约为96 bp 和64 bp,与预期大小相符。将阳性重组质粒测序结果与NCBI 公布的CaPV 序列进行比对分析,确认为含有目的基因片段的重组阳性质粒,表明重组质粒构建成功。
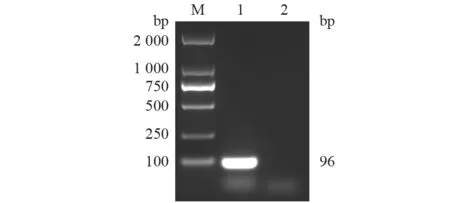
图1 pLSDV-010 PCR 鉴定结果
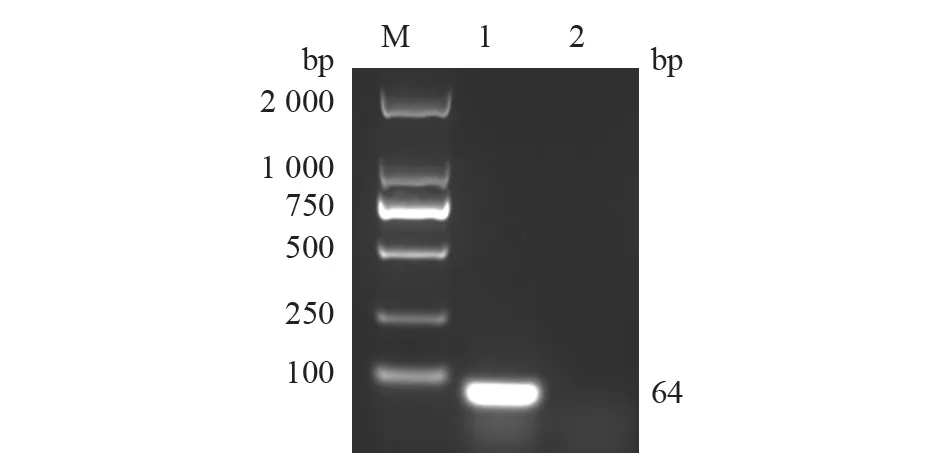
图2 pCaPV-068 PCR 鉴定结果
2.2 双重荧光定量PCR 反应条件优化
在优化退火温度、引物和探针浓度后,确定了双重荧光定量PCR 方法的最佳反应体系(表2)。反应程序:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 30 s,40个循环,在每个循环结束时收集荧光信号。
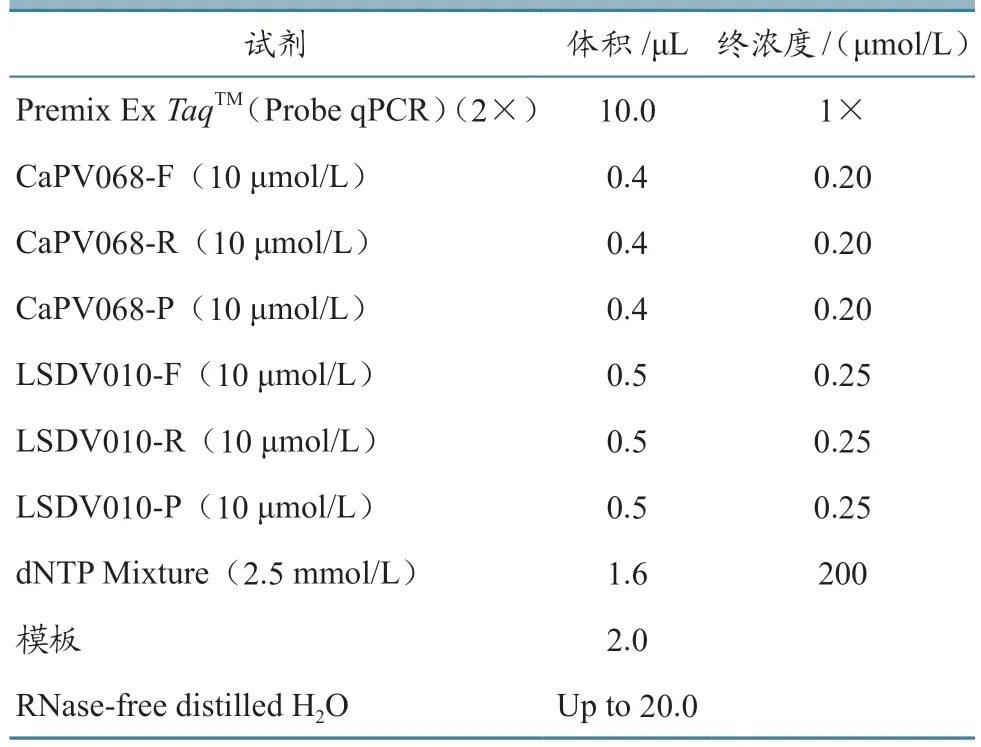
表2 双重荧光定量PCR 最佳反应体系
2.3 双重荧光定量PCR 标准曲线建立
以1.50×109~1.50×101copies/μL 等9 个稀释梯度的混合标准质粒为模板,进行双重荧光定量PCR 扩增,得到扩增曲线和标准曲线。结果(图3)显示,2 种标准曲线的Ct 值和稀释滴度对数值在1.50×109~1.50×101copies/μL拷贝数浓度范围内具有良好的线性关系,且阴性对照未出现特异性扩增曲线。相应的方程斜率、相关系数(R2)和扩增效率:pLSDV-010 分别为-3.259,0.998 和102.7%;pCaPV-068 分别为-3.201,0.998 和105.3%。
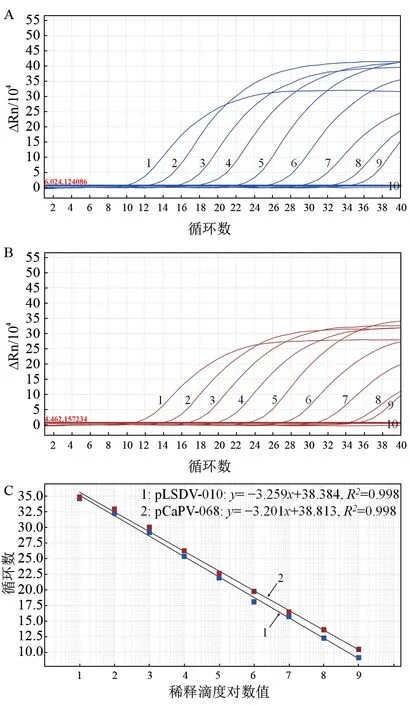
图3 双重荧光定量PCR 的扩增曲线和标准曲线
2.4 特异性试验
以FWPV、IBRV、VACV、ORFV 的基因组DNA,BVDV、BufHuV、BEV、FMDV 和PPRV的cDNA 为模板,以LSDV、GTPV 基因组DNA为阳性对照,ddH2O 为阴性对照,采用建立的双重荧光定量PCR 进行特异性检验。结果(图4)显示:只有LSDV 在FAM、VIC 这2 个荧光通道产生阳性扩增曲线,分别对应CaPV068基因和LSDV010基因;GTPV 仅有FAM 荧光通道产生阳性扩增曲线,对应CaPV068基因;而其他病毒没有产生扩增曲线。结果说明,建立的双重荧光定量PCR 方法可以特异性鉴别出LSDV,并与CaPV 的其他成员做区分。
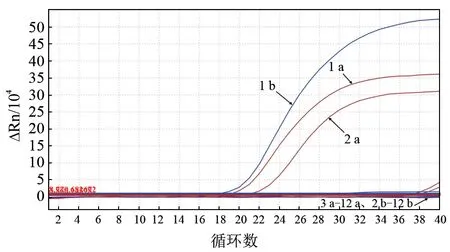
图4 双重荧光定量PCR 特异性试验结果
2.5 灵敏性试验
以1.50×109~1.5×100copies/μL 等10 个稀释梯度的混合标准质粒为模板,用于确定双重荧光定量PCR 的最低检出限。结果(图5)显示,pLSDV-010 与pCaPV-068 的最低检出限均为15 copies/μL,表明该方法灵敏性良好。
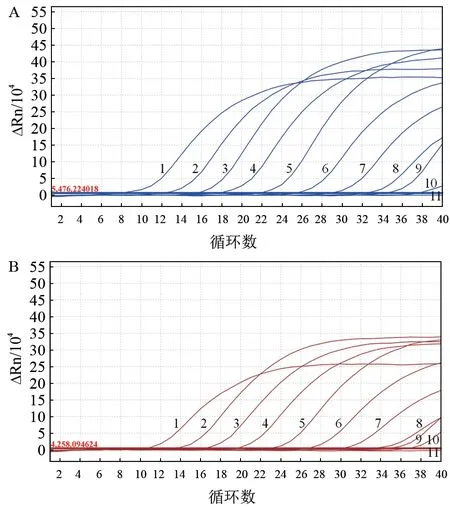
图5 双重荧光定量PCR 灵敏性试验结果
2.6 重复性试验
选取3 个拷贝数浓度的混合质粒(1.50×108、1.50×106、1.50×104copies/μL)评估建立的双重荧光定量PCR检测方法的重复性。结果(表3)显示,2 种阳性质粒标准品的组内CV 为0.10%~1.34%,组间CV 为0.30%~1.75%,表明建立的双重荧光定量PCR 方法具有良好的重复性。
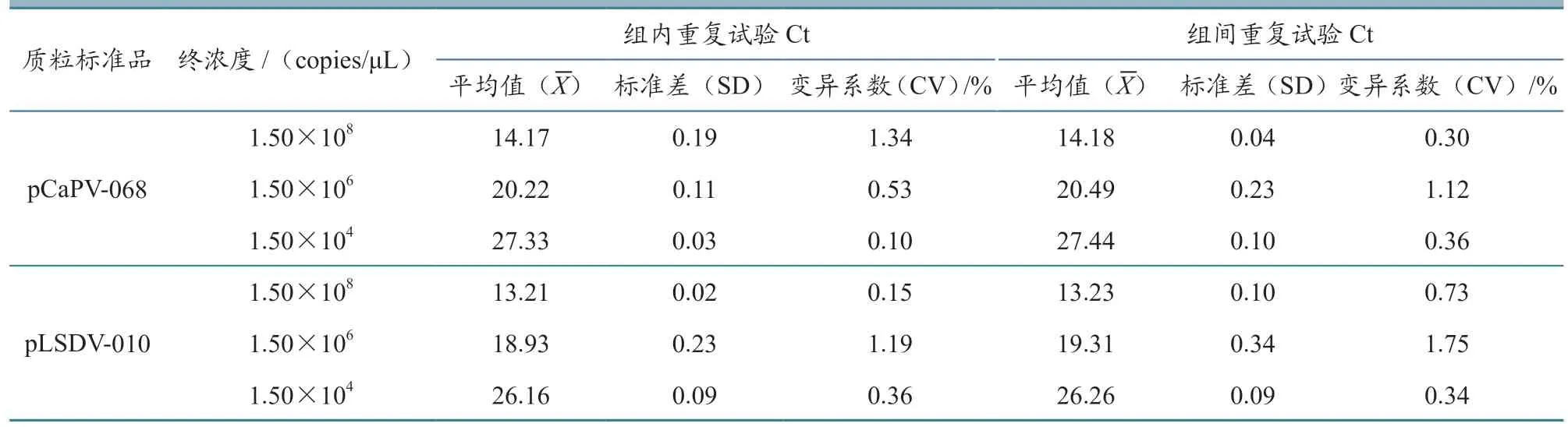
表3 双重荧光定量PCR 重复性试验
2.7 临床样品检测
对2017年10 月至2022年11 月在广西各地区采集的542 份牛羊皮肤结节、鼻腔拭子、血清等临床样品,应用建立的双重荧光定量PCR 方法进行检测;同时利用《牛结节性皮肤病诊断技术》(GB/T 39602—2020)和WOAH 推荐方法对样品进行同步检测。结果显示:LSDV 在皮肤结节样品中的检出率最高,其次是环境拭子、鼻咽拭子,而血样品的检出率较低(表4);本试验所建方法与参考的检测方法所检出的CaPV 样品符合率为98.52%,LSDV 为99.63%(表5)。结果表明本试验所建的检测方法结果可靠,可以用于临床样品检测。
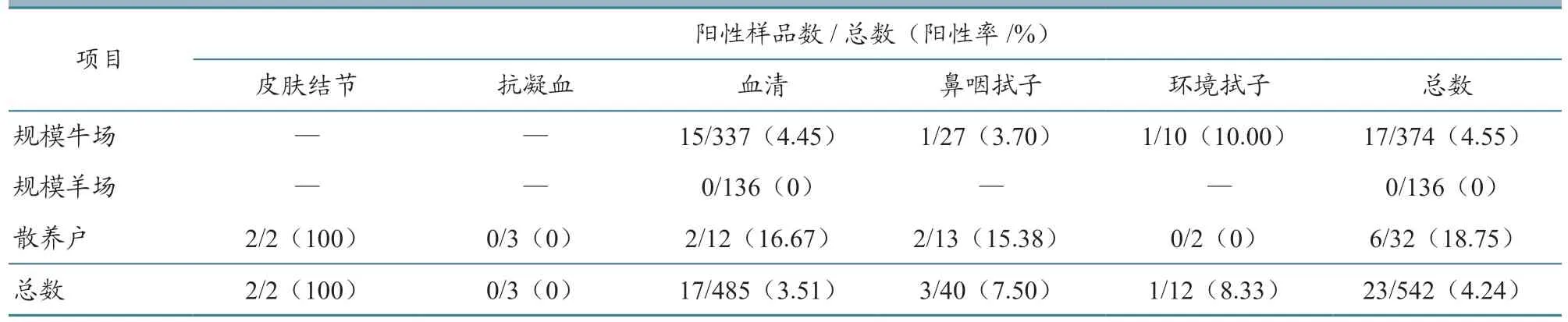
表4 临床样品种类及其阳性率
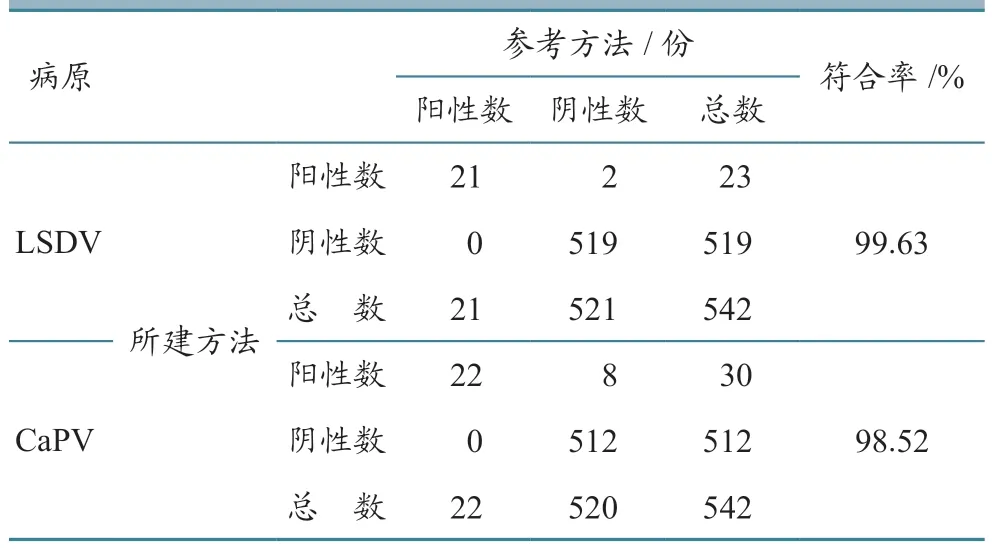
表5 2 种检测方法一致性结果
3 讨论
LSD 自1929年在赞比亚被首次发现后,随着国际贸易往来已陆续传播至非洲南部、欧洲以及亚洲等多个地区[10-11]。2019年LSDV首次扩散到我国,2020—2021年我国多个省份以及香港和台湾等地区已有报道[12-14]。越南、泰国等东南亚国家也陆续出现LSD 疫情[15-16]。目前,基于荧光PCR 技术建立LSDV 鉴别诊断方法成为各国研究热点[17-20]。例如,Wang[20]等针对RPO30基因,建立了能鉴别LSDV、GTPV 和SPPV 的双重实时荧光定量PCR检测方法,可检测到102copies/μL 的病毒DNA。
2019年起,我国批准在LSD 流行地区使用GTPV 弱毒疫苗进行免疫。本课题组在开展临床监测时发现,部分免疫动物样本可检出GTPV 核酸,但若使用CaPV 通用型引物和探针检测,则可能造成误诊。因此,有必要研制一种能同时检测并区分LSDV 和CaPV 其他成员的鉴别诊断方法。通过基因序列比对发现,LSDV010编码区极为保守,并与SPPV、GTPV 的相同区域存在较大差异;而LSDV068基因与CaPV 其他成员的核苷酸同源性大于99.0%[5]。基于上述结果,本试验选择LSDV010基因设计LSDV 特异性引物和TaqMan 探针,并结合CaPV068基因的通用型引物和MGB 探针,经过优化各种反应条件,建立了双重荧光定量PCR检测方法。该方法最低检出限为15 copies/μL,优于Wang[20]等建立的方法。应用本试验建立的方法检测542 份临床样品,共检出LSDV 阳性样品23 份(4.24%)、CaPV 阳性样品30 份(5.54%),与LSDV 和CaPV 参照方法的符合率分别为99.63%和98.52%。本试验发现LSDV 在皮肤结节样品中的检出率最高,其次是环境拭子、鼻咽拭子,而血样品的检出率较低。这是因为LSD 对于皮肤组织的嗜性强以及可以持续在皮肤中维持高浓度,与El-Mandrawy等[21]研究结果一致。另外,在环境样品中检出LSDV,说明无论是对于个体养殖户还是规模养殖场,环境清洁与消毒是有效防控LSD传播的重要手段。
4 结论
本研究建立了一种可同时检测并鉴别LSDV和CaPV 其他成员的双重荧光定量PCR 检测方法。该方法具有良好的特异性、灵敏性和重复性,为开展LSDV、CaPV 鉴别筛查,LSDV 精准防控及相关流行病学调查提供了快捷有效的技术手段。
