养殖鳜鱼出血病病原的分离与鉴定
2023-02-15吕圆圆周凯房文红匡俊宇赵姝马丽艳王元陈寿旭高桂明谢志强周俊芳
吕圆圆,周凯,房文红,匡俊宇,赵姝,马丽艳,王元,陈寿旭,高桂明,谢志强,周俊芳
(1.上海海洋大学水产与生命科学学院,上海 201306;2.中国水产科学研究院东海水产研究所,农业农村部低洼盐碱地水产养殖重点实验室,上海 200090;3.上海市松江区水产技术推广站,上海 201600)
鳜鱼(Siniperca chuatsi)又称桂花鱼,肉嫩味美,养殖前景良好。2021年,上海市一养殖场养殖的鳜鱼(体长11.0~13.4 cm)发生出血性疾病,初始典型症状为下颌出血,病死率为10%~20%。本研究通过细菌分离、分子鉴定、生化反应以及致病性试验等,确认鳜鱼发病死亡是由维氏气单胞菌(Aeromonas veronii)和迟缓爱德华氏菌(Edwardsiella tarda)共同感染引起的。
维氏气单胞菌对盐度具有广适性,广泛分布于淡水、海水中,宿主众多,不仅可以感染鱼、虾、蟹、贝、龙虾和乌贼等[1-2],还可感染人和陆生动物,并可污染食物[3–6]。Hu等[7]研究表明,维氏气单胞菌在健康或发病鱼类以及养殖水环境中广泛存在,在分离的气单胞菌中的占比均在60%以上。上海市浦东新区疾病控制中心对排便次数和粪便性状有改变的2 533 例患者采集样本检测,确定101 例感染了气单胞菌,其中维氏气单胞菌阳性样本44 例,占比高达52.5%,并且有44 例患者还出现了气单胞菌与其他病原体的共同感染[8]。
与维氏气单胞菌类似,迟缓爱德华氏菌也具有分布广、宿主多[9-10]等特点,可导致鲶鱼(Ictalurus punctatus)、尼罗罗非鱼(Oreochromis nilotica)、鲆鲽类、欧洲鳗鱼(Anguilla anguilla)、日本鳗鱼(Anguilla japonica)、鲤鱼(Cyprinusspp.)和黄鳝(Monopterus albus)等多种鱼类发病。2015年,养殖鲈鳗(Anguilla marmorata)暴发迟缓爱德华氏菌病,死亡率高,导致的经济损失较大[11]。迟缓爱德华氏菌除了导致动物发病外,也可感染人,导致结肠炎症、溃疡,形成假息肉,症状类似克罗恩病[12–14]。
本研究对病死鳜鱼进行系列病原分离与鉴定,旨在确定引发鳜鱼出血病的病原及其生化特性和抗生素敏感性等特征,为后续防治该病提供参考。
1 材料和方法
1.1 发病鱼临床症状
多数发病鱼下颌出血,严重者整个嘴部和鳍条出血,体表出现溃疡(图1)。剖开后,腹腔内充满腹水,腹壁肌肉黄染;肠壁变薄,内部充满黄绿色液体,肠黏膜轻度出血;下颌处肌肉出血。

图1 发病鳜鱼临床症状
1.2 材料
收集发病鳜鱼,低温运输到实验室;健康鳜鱼幼鱼[体长(5.83±0.25)cm],购自广东鳜鱼养殖户,充氧空运到实验室;细菌培养基(TSA、TSB、MH)和血琼脂平板,购自北京陆桥技术股份有限公司;革兰氏阴性细菌鉴定卡(GN 卡,Merieux),购自廷禄(北京)科技有限公司;细菌基因组DNA 提取试剂盒,购自天根生化科技(北京)有限公司;PCR 试剂(Takara),购自上海百赛生物技术股份有限公司;抗生素(药敏试验),购自北京索莱宝科技有限公司。
1.3 方法
1.3.1 细菌分离与纯化 将濒死鳜鱼体表用75%酒精棉消毒后解剖。用无菌接种环分别在鳃丝、肠道内容物、溃疡和肝脏剖面沾取组织或黏液,划线接种于大豆酪蛋白琼脂培养基平板,28 ℃恒温箱培养24 h;挑取形态特征一致的优势菌落再次划线培养分离,获得纯培养菌株,观察菌落颜色及形态特征;同时,把纯化后的菌株接种于含5%绵羊血的血平板,28 ℃恒温箱培养24 h,观察溶血特征。
1.3.2 分子鉴定和系统发育分析 挑取纯化后的单菌落,28 ℃恒温摇菌培养24 h,参照细菌基因组DNA 提取试剂盒说明书提取细菌DNA,进行PCR 扩增。扩增引物及条件见表1。将PCR 产物直接测序并经BLAST 比对分析后,采用MEGA-X 10.0 软件包中的Neighbor-Joining 法构建系统发育树。通过自举分析进行置信度检测,自举数据集为1 000 次。

表1 本研究所用引物
1.3.3 细菌生化特征鉴定 在确定纯化菌的革兰氏染色特性后,将纯化菌接种到血平板上,28 ℃培养20 h;挑取单菌落,按照革兰氏阴性细菌鉴定卡说明书,在梅里埃自动细菌鉴定仪上,分析菌株的各项理化指标。
1.3.4 药敏试验 首先制备菌悬液:将分离菌接种于2 mL TSB 液体培养基中,恒温摇床设置为28 ℃、180 r/min 培养16 h;用TSB 液体培养基稀释菌液,使悬菌液浓度在多功能酶标仪上的吸光度OD600nm为1.0,备用;吸取100 μL 稀释菌液加入到无菌的96 孔板中,以大肠杆菌ATCC25922 作为质控菌株。然后制备琼脂药敏板:将抗菌药稀释后,使用移液器移取药液,快速加入到50 ℃左右的MH 琼脂培养基中,迅速混匀,倒入平板,即成相应浓度的琼脂药敏平板,未添加抗菌药的MH琼脂培养基作为空白对照。最后将分离菌在药敏平板上接种与培养:将已配置好的细菌悬浊液按顺序各吸100 μL 分别加入96 孔板中,然后用灭菌后的自制钉板蘸取菌液,按顺序按在已凝固的药敏平板和空白MH 琼脂平板上,待菌液晾干后将药敏平板置于恒温培养箱中,正面向上放置,同时每种药物做3 个平行,28 ℃恒温培养16 h,将无菌生长的最低药物浓度视为最小抑菌浓度(MIC)。
1.3.5 健康鳜鱼感染试验 试验用鳜鱼外观健康,摄食正常,其分离细菌在TSA 琼脂平板上没有见到明显优势菌和细小的针尖样菌落,血平板培养也未见溶血菌落。根据感染要求,将试验用鳜鱼随机分到玻璃缸中。将纯化后的菌株分别接种至TSB液体培养基中,28 ℃培养18 h,取1 mL 菌液用0.85%的无菌生理盐水进行梯度稀释,涂布TSA琼脂平板,28 ℃培养24 h 后计算活菌数,每个梯度做2 个平行。根据分离菌株各自生长状况和预试验结果,用0.85%无菌生理盐水分别将菌液稀释到1×103~1×105cfu/μL,腹腔注射感染健康鳜鱼幼鱼,菌液注射量为100 μL/尾(GY2C2 攻毒15尾/梯度,GY2S1 攻毒7 尾/梯度),对照组注射等量0.85%无菌生理盐水。试验组和对照组分别暂养于玻璃缸中,水温控制在(27±1)℃;保持充氧和正常换水,观察并记录鳜鱼的发病和死亡情况,持续观察10 d。
2 结果
2.1 分离菌特点
初次分离培养24 h 后,发现每条鱼组织均出现一种相似的优势菌落(图2-A)——生长快速,呈现表面光滑、湿润、轻微隆起的圆形乳白色优势菌落(蓝色箭头);部分病情严重鱼的肠道黏液中,除了前面的优势菌落外,还长出一种生长缓慢、光滑、隆起的针尖样白色菌落(红色箭头),培养24 h 时小菌落数量少于大菌落,但随着培养时间延长,小菌落数量逐渐增多,48 h 时数量与大菌落近似;其他形态或颜色的菌落极少。纯化大菌落在绵羊血平板上出现清晰的β-溶血环(图2-B),而小菌落不溶血。

图2 患病鳜鱼组织分离菌培养特点
2.2 分子鉴定
按照表1 中所列引物[15-16]进行PCR 扩增并进行测序和BLAST 分析,发现所有的大菌落均为维氏气单胞菌;取其中一条鱼的鳃丝培养菌(GY2S1)序列构建进化树(图3),进行同源性分析。由于所有针尖样白色菌落均为迟缓爱德华氏菌,因此同样取同一条鱼的肠道培养菌(GY2C2)序列构建进化树(图4)。

图3 GY2S1 基于DnaJ 基因序列的分析聚类结果
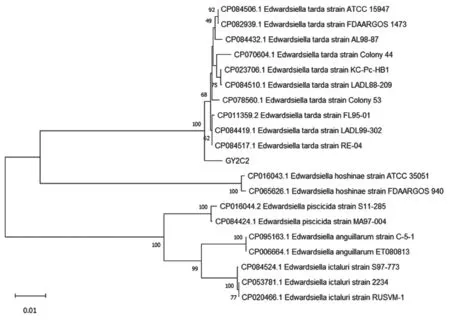
图4 GY2C2 基于16S rDNA 基因序列的分析聚类结果
2.3 生化特征
利用梅里埃自动细菌鉴定仪配套革兰氏阳性G-细菌的GN 卡,获得分离菌株GY2S1 和GY2C2的生化鉴定结果(表2)。从表中可见,GY2S1 的鸟氨酸脱羧酶(ODC)和赖氨酸脱羧酶(LDC)反应均为阴性,表明其既不属于维氏气单胞菌维氏生物群(A.veroniibiogroupveronii),也不属于维氏气单胞菌温和生物群(A.veroniibiogroupsobria),但在遗传上与温和生物群更近。GY2S1和GY2C2 均不产生H2S。
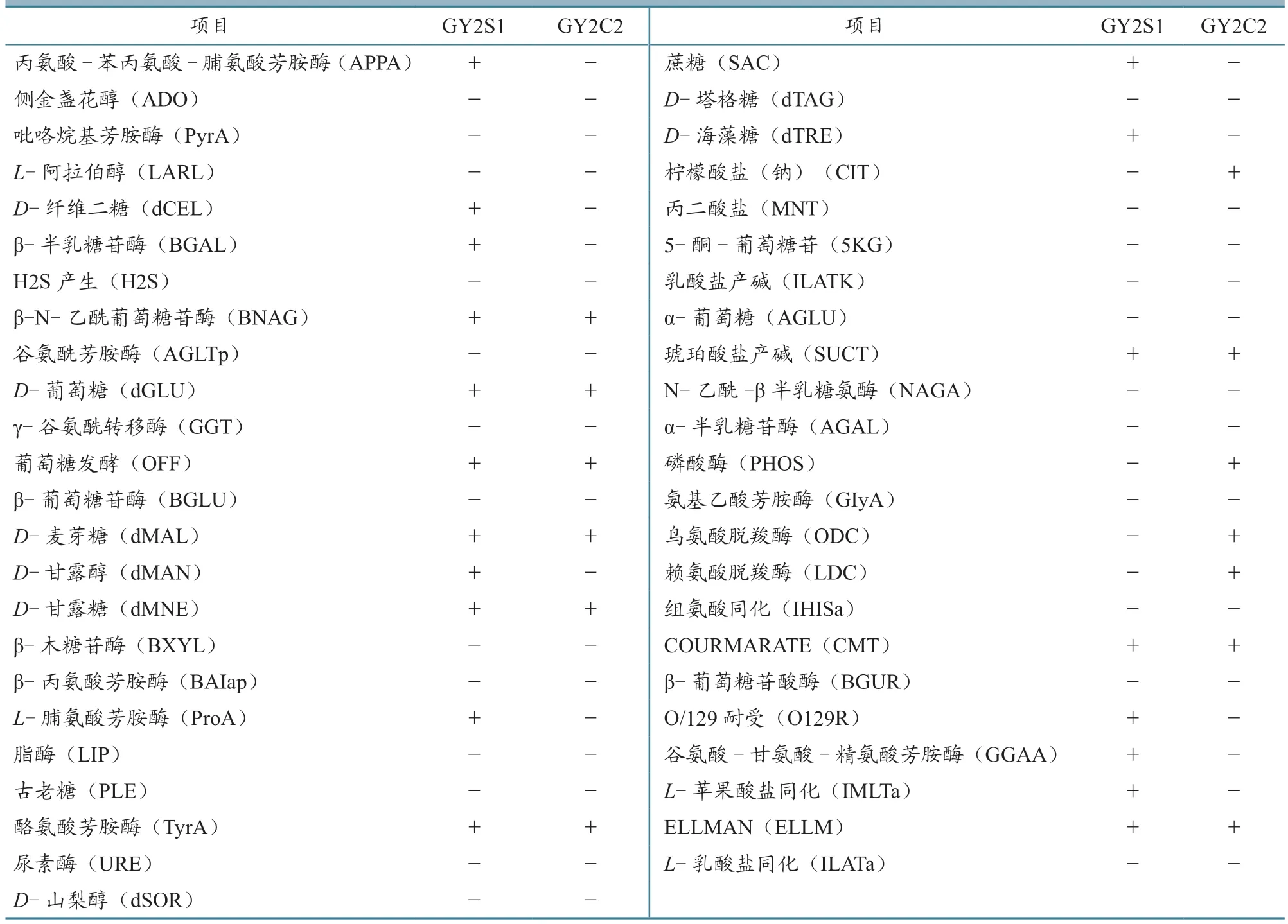
表2 菌株GY2S1 和GY2C2 的生化特征
2.4 药敏试验
参考常用鱼药与最新禁用药物名单,选了庆大霉素等6 种抗生素测试GY2S1 和GY2C2 的药物敏感性。结果(表3)显示:两种菌株GY2C2和GY2S1 对不同药物的敏感性不完全一致,菌株GY2S1 对环丙沙星和氟苯尼考高度敏感,而GY2C2 只对6 种药物中的氟苯尼考敏感;两种菌都对硫酸新霉素和红霉素耐药。
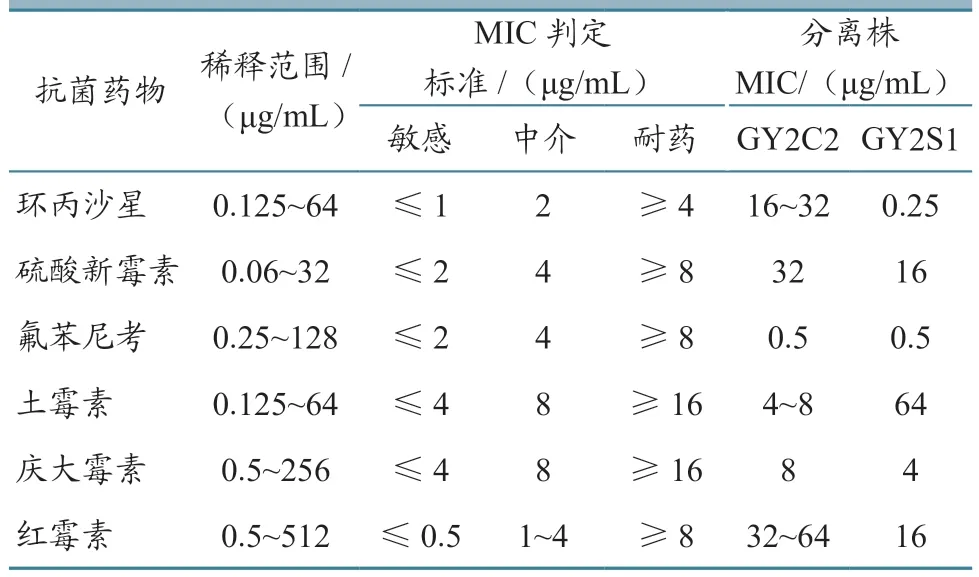
表3 菌株GY2S1 和GY2C2 对6 种抗菌药物的MIC 结果
2.5 健康鳜鱼感染试验
分离株GY2S1 和GY2C2 分别注射感染鳜鱼幼鱼后,被感染幼鱼均出现了死亡现象,死亡情况如表4 和图5 所示。相同浓度下,GY2S1 引起的死亡率高于GY2C2。从发病死亡鱼组织(肠道、肝脏)中分别分离到高度优势菌株;测序鉴定显示,分离菌株分别与注射感染菌株同种。
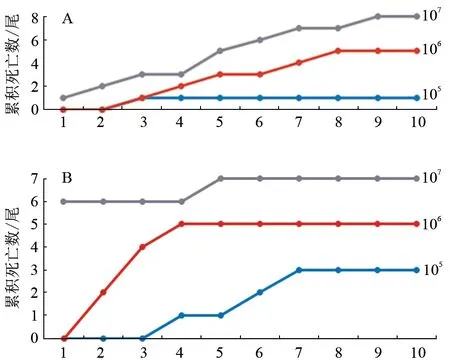
图5 人工感染病原菌后10 d 内的鳜鱼累积死亡数变化趋势

表4 健康鳜鱼幼鱼感染GY2S1 和GY2C2 后的死亡情况
3 分析与讨论
经鉴定证实,引起该养殖场养殖鳜鱼发病死亡的是维氏气单胞菌与迟缓爱德华氏菌共感染导致的出血病。嗜水气单胞菌、维氏气单胞菌已成为水产动物,如淡水鱼、淡水养殖对虾等的主要致病性细菌。Wang等[17]从我国南方发病和健康的养殖泥鳅中分离气单胞菌,发现维氏气单胞菌的检出率远高于其他气单胞菌种类,104 株中分离出87 株,占比高达83%,而传统的水生动物病原嗜水气单胞菌检出率只有4%,豚鼠气单胞菌没有检测到。类似地,Hossain等[18]从健康孔雀鱼分离到52株气单胞菌,其中维氏气单胞菌最多,为34 株,占比高达65%,而嗜水气单胞菌和豚鼠气单胞菌均为3株,检出率都很低。但是,到食物和人携带层面,优势菌种略有变化。Wu等[5]从市场以及寿司和海鲜店的鱼中分离到气单胞菌128 株,其中豚鼠气单胞菌最多,为43 株(33.6%),而该种菌在水生动物中的检出率却很低[18],甚至无[17];检出维氏气单胞菌33 株(25.8%),虽然略低于豚鼠气单胞菌,但仍然远高于其他菌种;但是,嗜水气单胞菌检出率仍然维持在较低水平,只有9 株(7.0%)。可见,食物来源气单胞菌的菌种组成与水生养殖源气单胞菌相比,变化最大的是豚鼠气单胞菌,检出率从很低甚至无跃升到最高,而其他菌种,如维氏气单胞菌和嗜水气单胞菌等,相对检出率变化较小,表现出动物与产品较好的一致性。需要注意的是,人源气单胞菌菌种组成与食物源具有较高的一致性:豚鼠气单胞菌和维氏气单胞菌在病人体内占比也较高,唯一异常的是达克气单胞菌,不仅占比与豚鼠气单胞菌类似,而且比率高于其在鱼源气单胞菌中的占比,推测应该与人的病例总数和人易感种类均较少有关。尽管维氏气单胞菌和迟缓爱德华氏菌均存在分布广、宿主多的特点,且水产病原共感染甚至协同发病的报道[19–21]也越来越多,但是两者感染鳜鱼的报道并不多[22],还未见到两者协同感染发病的报道。
基于分子生物学鉴定方法,GY2S1 菌株被鉴定为维氏气单胞菌。鉴于维氏气单胞菌数量巨大,且具有生物学特性的多样性,Wang等[23]建立了维氏气单胞菌的生物群分类方法,即维氏气单胞菌维氏生物群(A.veroniibiogroupveronii)特征是鸟氨酸脱羧酶反应阳性,而维氏气单胞菌温和生物群(A.veroniibiogroupsobria)的特征是鸟氨酸脱羧酶(ODC)反应阴性、赖氨酸脱羧酶(LDC)反应阳性。但是,根据GY2S1 的生化反应结果,分离株GY2S1 的赖氨酸脱羧酶和鸟氨酸脱羧酶的生化反应均为阴性,因此根据上述生物群分类方法,鳜鱼分离株GY2S1 既不属于维氏生物群,也不属于温和生物群。当然,基于DnaJ基因的进化分析结果显示,GY2S1 分离株与部分维氏气单胞菌温和生物群聚于一个大的分支,表明该分离株在遗传水平上与维氏气单胞菌温和生物群更近。迟缓爱德华氏菌与维氏气单胞菌类似,也存在非典型生化反应的情况。例如,迟缓爱德华氏菌的大量生化反应都表明其产生H2S[11,24],以致把“H2S 阳性”作为其典型特征。然而,本研究从鳜鱼获得的分离株GY2C2 却不产生H2S。另外,Shao等[25]也分离到1 株不产生H2S 的迟缓爱德华氏菌。
由于两种菌株来源相同,因此两者在敏感与耐受的药物种类方面比较近似,都对硫酸新霉素和红霉素耐药,而对氟苯尼考都高度敏感,这为病鱼的治疗提供了方便。两种菌株回感健康鳜鱼的死亡率统计结果显示,两者都是鳜鱼出血病的病原,但是维氏气单胞菌GY2S1 感染后发病迅速,死亡率高,是鳜鱼出血病的主要病原,因此治疗还可以辅以对维氏气单胞菌高度敏感的环丙沙星。
