商用BT 细胞中污染病毒的检测及基因序列分析
2023-02-15桂亚萍白艺兰刘健王建赵洪进
桂亚萍,白艺兰,刘健,王建,赵洪进
(上海市动物疫病预防控制中心,上海 201103)
作为重要的细胞基质,动物源性细胞系已在科学研究和生物制品生产方面获得了广泛应用。但由于其所用细胞、血清等均为动物源性材料,极易受到外源因子尤其是病毒的污染,导致潜在的生物安全风险[1]。张志等[2]从14 个省份的猪瘟细胞疫苗和猪繁殖与呼吸综合征弱毒疫苗中检出9份牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)阳性样品。有研究[3]对墨西哥6 批次单价疫苗、8 批次疫苗生产所用细胞系和10 批次胎牛血清进行检测后发现,62.5%的样本存在BVDV RNA 污染。
牛鼻甲骨(BT)细胞是用于多种牛病毒培养和检测的重要牛源细胞系,对其外源病毒进行检测尤为重要。已有研究[4]表明,BVDV可污染BT细胞、牛肾细胞等多种牛源细胞,同时牛细小病毒(bovine parvovirus,BPV)、呼肠孤病毒3 型(mammalian orthoreovirus 3,Reo3)、牛腺病毒3 型(bovine adenovirus type 3,BAdV-3)、牛呼吸道合胞体病毒(bovine respiratorysyneytial virus,BRSV)和牛副流感病毒3 型(bovine parainfluenzavirus type 3,BPIV-3)也是造成牛源细胞系污染的重要病原。因此,对BT 细胞进行以上病原的检测,对于后续试验结果的准确性和防止潜在的病毒传播具有重要意义。本研究通过PCR 扩增,细胞病变观察,以及阳性病原部分基因序列测序和分析,对商用BT 细胞进行相应病毒检测,以期为商用BT 细胞的质量控制提供参考。
1 材料和方法
1.1 材料
1.1.1 细胞 BT 细胞,购自某生物公司。
1.1.2 主要试剂 0.25%的胰酶消化液(批号AU202111)、胎牛血清(批号AU204825),购自BIOODIN 公司;DMEM 细胞培养液(批号2467189)、PBS(批号8121484),购自GIBCO 公司;核酸提取试剂盒(批号MDJL09-1),购自Magen公司;Prime ScriptTMOne Step RT-PCR Kit Ver.2(Dye Plus)反转录试剂盒(批号AL52736A)、PremixTaqTM(TaKaRaTaqTMVersion 2.0 plus dye,批号AI12330A),购自宝生物工程(大连)公司。
1.2 方法
1.2.1 BT 细胞相应病毒检测 对BT 细胞收毒后反复冻融3 次,2 000 r/min 离心5 min,取上清液备用。参考文献[5-7]设计BVDV、BPV、Reo3、BAdV-3、BRSV 及BPIV-3 检测引物(表1),由上海桑尼生物公司合成。按照核酸提取试剂盒说明书要求提取BT 细胞上清液总核酸,并以此为模板,根据Prime ScriptTMOne Step RT-PCR Kit Ver.2(Dye Plus)反转录试剂盒说明书要求,分别进行BVDV、Reo3、BRSV 和BPIV-3 的RT-PCR 扩增。扩增体系:2×Buffer 12.5 μL,上下游引物各0.5 μL,Enzyme Mix 1.0 μL,模板2.5 μL,ddH2O 8.0 μL。一步法RT-PCR 扩增程序:50 ℃ 30 min,94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s;72 ℃ 1 min,30 个循环;72 ℃ 10 min。按核酸提取试剂盒说明书要求,提取离心后的BT 细胞上清液DNA,以此为模板,根据PremixTaqTM(TaKaRaTaqTMVersion 2.0 plus dye)说明书要求,分别进行BPV和BAdV-3 的PCR扩增。扩增体系:2×Buffer 12.5 μL,上下游引物各0.5 μL,PremixTaq1.0 μL,模板 2.5 μL,ddH2O 8.0 μL。PCR 扩增程序:94 ℃2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30 个循环;72 ℃ 10 min。扩增产物经2%的琼脂糖凝胶电泳,阳性PCR 产物送上海桑尼生物公司测序,测序结果提交NCBI 进行BLAST 比对分析。

表1 6 种病毒的检测引物
1.2.2 细胞培养原材料BVDV 检测 各吸取200 μL DMEM 细胞培养液、PBS、胰酶、胎牛血清,按照核酸提取试剂盒说明书要求分别提取总核酸,以BT 细胞提取总RNA 为阳性对照组,扩增体系和程序同1.2.1,进行BVDV RT-PCR 扩增,产物经2%琼脂糖凝胶电泳检测。
1.2.3 BT 细胞中BVDV 增殖检测 经BT 细胞传代培养7 d,每隔1 d 观察细胞病变情况并吸取200 μL 细胞培养上清液备用;提取不同时间段的BT 细胞上清液总核酸,以BVDV-F/R 为引物进行RT-PCR 扩增,扩增产物经2%的琼脂糖凝胶电泳检测。
1.2.4 BVDVNpro和E2基因扩增 参考文献[8-9]设计并合成靶向BVDVNpro和E2基因的特异性引物(表2),以BT 细胞冻融离心后上清液所提总RNA 为模板,采用两对特异性引物分别扩增Npro和E2基因片段,阳性PCR 产物送上海桑尼生物公司测序。

表2 BVDV 特异性扩增引物
1.2.5 序列比对分析 对获得的5'UTR、Npro以及E2基因序列进一步处理后,与GenBank 上发表的BVDV 参考序列(表3)进行比对分析,利用MEGA 6.0 软件,采用邻接法构建系统进化树。
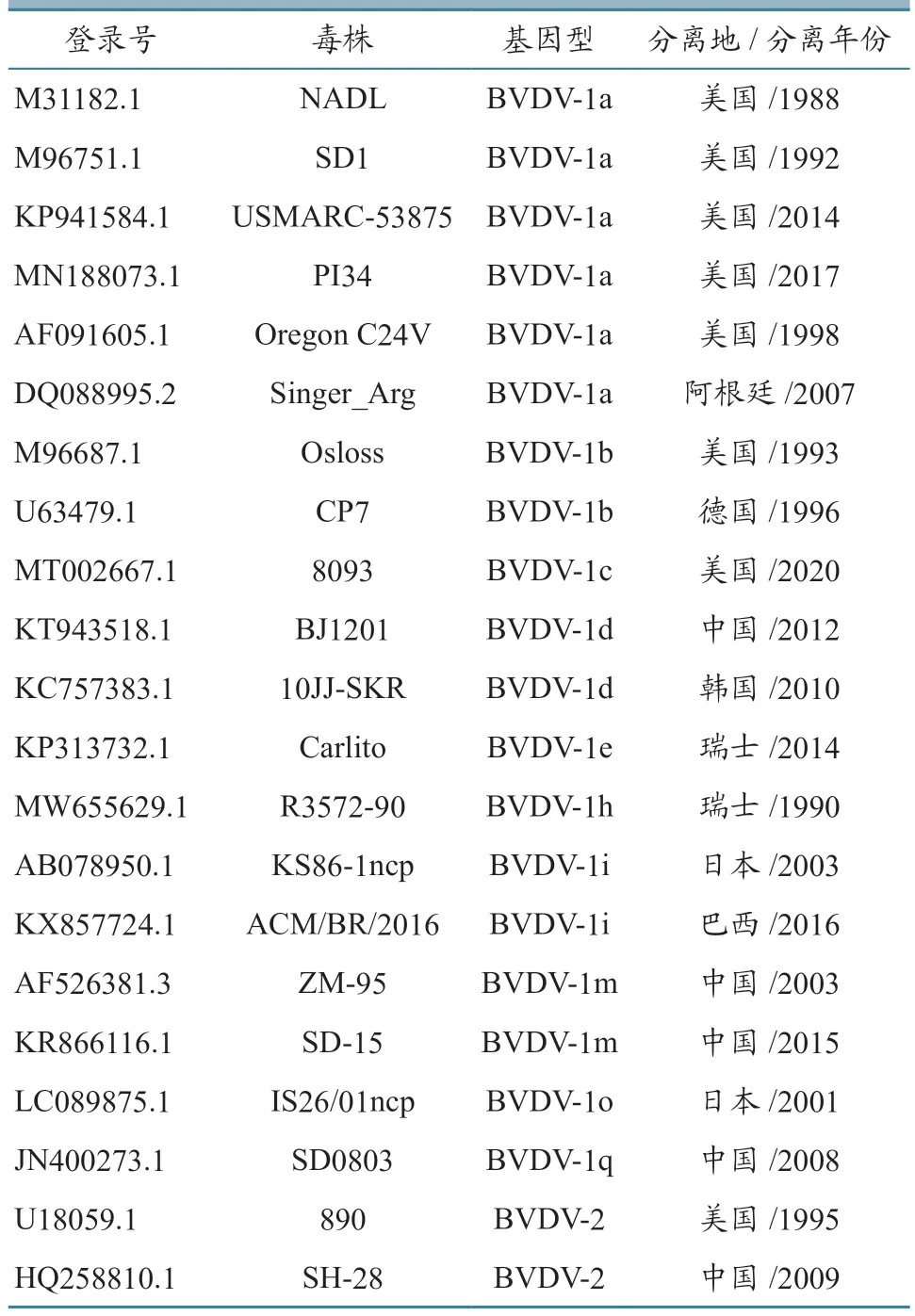
表3 BVDV 参考毒株信息
2 结果
2.1 BT 细胞中病毒的PCR 检测
以提取的BT 细胞总RNA 为模板分别进行BVDV、BPV、Reo3、BAdV-3、BRSV 及BPIV-3等6 种病毒的PCR 扩增。经琼脂糖凝胶电泳检测,仅BVDV 出现目的条带,其他病毒未出现相应条带(图1),进一步对阳性产物测序结果进行BLAST 分析,确定为BVDV 基因序列。

图1 BT 细胞BVDV PCR 扩增结果
2.2 原材料BVDV 检测
分别对培养细胞所用原材料DMEM 细胞培养液、PBS、胎牛血清、胰酶进行BVDV 检测,结果均为阴性(图2)。

图2 原材料PCR 扩增结果
2.3 细胞病变观察
对BT 细胞传代培养后,分别在相应时间段观察细胞状态。结果(图3)显示,7 d 内随着培养时间的增加,BT 细胞一直未出现明显病变。

图3 不同时间段BT 细胞生长情况
2.4 细胞培养上清液检测
对提取的不同时间段的BT 细胞培养上清液总核酸进行RT-PCR 扩增,后经琼脂糖凝胶电泳检测。结果(图4)显示,样品在302 bp 处有一条带,与预期结果一致,且条带的亮度随着培养时间的增加而逐渐增强,表明BT 细胞中存在BVDV 病毒,且该病毒可以在细胞内增殖。
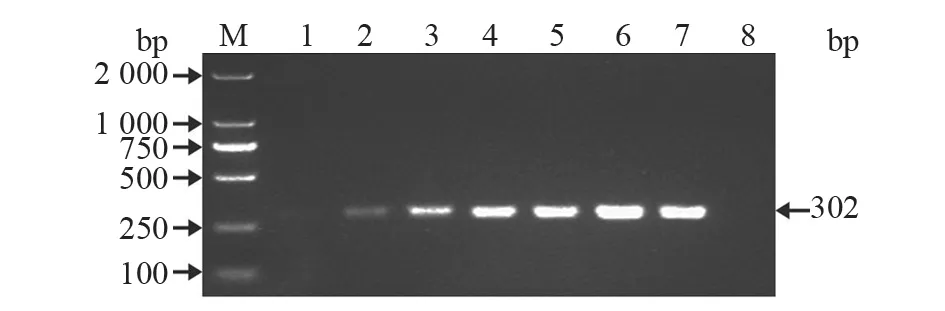
图4 不同时间段BT 细胞上清液RT-PCR 扩增结果
2.5 BVDV Npro和E2 基因扩增
分别利用BVDV的Npro以及E2基因特异性引物,对BT细胞总RNA进行RT-PCR扩增。结果(图5)显示,2 对特异性引物均能扩增出与预期大小相符的特异性条带,而阴性对照未出现相应条带。

图5 BVDV Npro和E2 基因RT-PCR 扩增结果
2.6 BVDV 5'UTR、Npro和E2 基因序列比对
BT 细胞中检出的病毒被命名为BVDV202201,对其扩增的部分基因序列进行同源性以及遗传进化分析。同源性分析结果显示:BVDV202201 的5'UTR 基因与USMARC-53875 株核苷酸同源性最高,为97.0%,与疫苗株Oregon C24V 株核苷酸同源性为96.4%,与BVDV-2型代表株 890 株的核苷酸同源性最低,仅为77.3%;Npro基因与Oregon C24V 株核苷酸同源性为90.7%,与BVDV-2 890 毒株的核苷酸同源性仅为70.7%;E2基因与Oregon C24V 株、USMARC-53875 株核苷酸同源性分别为89.7%和88.3%,与BVDV-2 890 毒株的核苷酸同源性仅为77.3%。基于5'UTR 和Npro 构建的遗传进化 树(图6~7)显示,BVDV202201 与Oregon C24V 株亲缘关系最近,同处于BVDV-1a 中的一个小分支;基于E2基因构建的遗传进化树(图8)显示,BVDV202201 与Oregon C24V株、USMARC-53875 株亲缘关系较近,同处于BVDV-1a 中的一个较大分支。以上结果表明,BVDV202201 属于BVDV-1a 型。
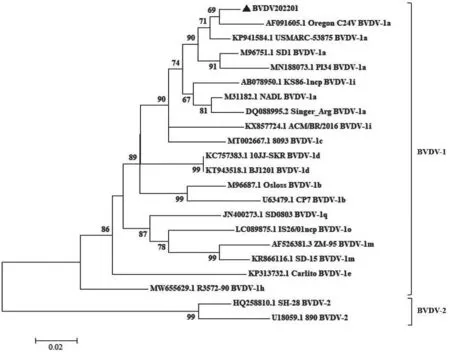
图6 BVDV 5'UTR 序列的进化树分析结果

图7 BVDV Npro 序列的进化树分析结果
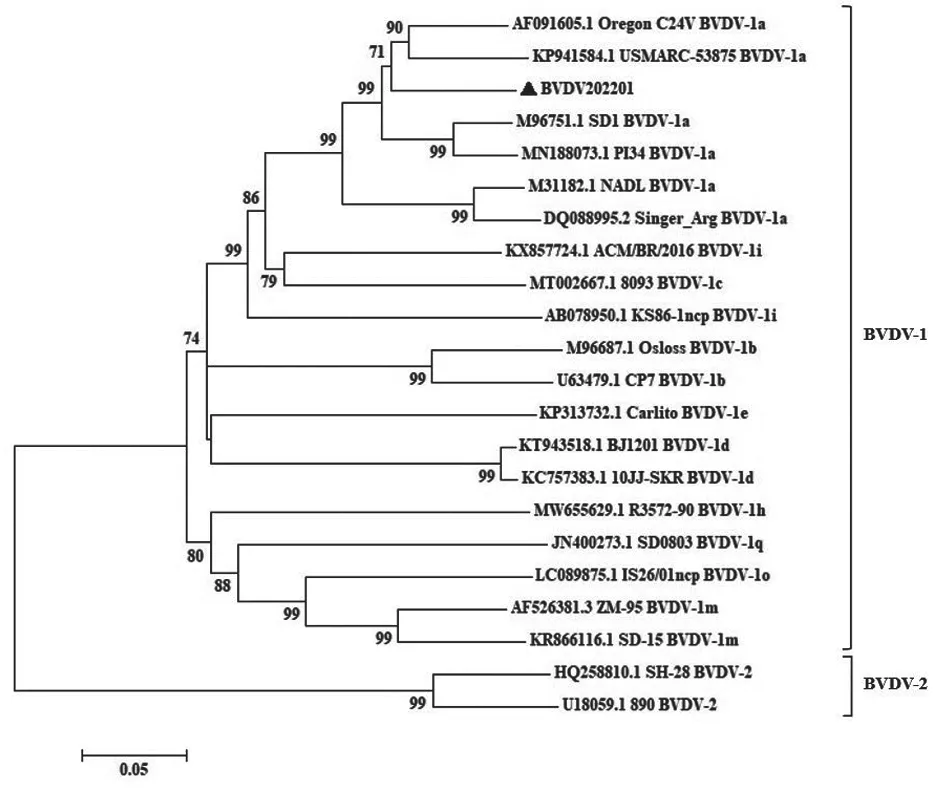
图8 BVDV E2 序列的进化树分析结果
3 讨论
BT 细胞不仅被广泛用于牛病毒的实验室检测,也可作为疫苗生产用细胞基质,因此控制其外源病毒污染是保障生物安全的必要前提。本研究对可能污染BT 细胞的6 种病毒进行检测,发现细胞中含有BVDV 病毒,在排除各原材料影响后,确定该细胞系中存在BVDV 污染。张超等[10]在对进口胎牛血清和脱脂奶粉进行检测时均发现存在BVDV 的抗原和抗体污染;朱晓玮等[11]从牛血清、牛睾丸细胞等牛源材料中均可检出BVDV 病毒,甚至在后续产品加工过程中仍有部分阳性检出。以上研究表明,BVDV 在牛源材料中的污染情况可能广泛存在。
本研究对BT 细胞进一步传代培养观察,发现检出的BVDV 病毒可在BT 细胞中增殖但不产生细胞病变。BVDV 是引起牛消化、呼吸以及生殖系统疾病的重要病原体,不仅影响牛群生产性能造成严重经济损失,也是牛源材料中的主要污染物[12]。根据是否引起细胞病变,可将BVDV 分为致细胞病变和非致细胞病变两种生物型,其中非致细胞病变的BVDV 可在细胞系中持续感染,是实验室细胞污染的重要传染源[13]。
BVDV 病毒中的5'UTR、Npro以及E2基因多用于鉴定不同毒株的基因型[14]。根据5'UTR 等基因的差异,可将BVDV 分为BVDV-1、BVDV-2 和BVDV-3 3 种基因型,其中的BVDV-1 型作为主要流行株已报道了1a—1u 至少21 种基因亚型[15]。本研究从BT 细胞中发现BVDV 病毒,将其命名为BVDV202201,结合5'UTR、Npro和E2基因序列的遗传进化分析,发现该病毒与北美的Oregon C24V 株亲缘关系较近,属于BVDV-1a 型毒株。Oregon C24V 毒株属于可引起MDBK 细胞病变的毒株,已作为BVDV 疫苗株被广泛应用。由于BVDV202201 与Oregon C24V 毒株位于同一分支,极有可能具有相似的生物学特性,提示其具有作为疫苗株研究的潜质。
本研究通过PCR扩增、传代培养、测序等方法,在商用BT 细胞中检出不引起细胞病变的BVDV病毒,经遗传进化分析发现,其与BVDV-1a 经典毒株Oregon C24V 亲缘关系较近,这为商业化BT细胞用于生产和科研工作的质量控制提出了重要污染警示。
