炭疽杆菌双毒力因子荧光PCR 检测方法的建立及应用
2023-02-15熊炜孙思扬韩伟李深伟薛蓓蕾田桢干
熊炜,孙思扬,韩伟,李深伟,薛蓓蕾,田桢干
(1.上海海关动植物与食品检验检疫技术中心,上海 200135;2.南昌海关技术中心,江西南昌 330038;3.上海国际旅行卫生保健中心,上海 200335)
由炭疽杆菌(Bacillus anthracis)引起的炭疽(anthrax)是严重危害人类和家畜健康的一种古老疫病,以急性、热性、败血性感染为主要特征。炭疽在世界各国均有发生,呈地方性流行或散发,各种家畜、野生动物和人类都有不同程度的易感性[1]。炭疽芽胞有很强的抵抗力,在干燥的土壤中可存活数十年之久。依据侵染途径不同,炭疽可分为3 种类型:皮肤性炭疽、吸入性炭疽和胃肠道炭疽[2]。近年来,我国不时有炭疽感染的报道。2017—2019年,我国共报道951 例炭疽病例,其中938 例是皮肤炭疽,占98.63%[3];2010—2019年,云南省共报告94 例人间炭疽病例[4];宁夏是我国炭疽的高发地区,2019—2022年分离的毒株均为强毒株[5];2021年山东出现人间炭疽病例[6];2022年陕西省延长县发生22 头猪感染炭疽杆菌死亡事件[7]。
炭疽致死的主要原因是炭疽杆菌在血液中大量增殖并产生毒素。炭疽毒素由3 种毒力因子组成,分别为保护性抗原(protective antigen,PA)、致死因子(lethal factor,LF)和水肿因子(edema factor,EF),均由pOX1 质粒所编码。这些毒力因子相互协同入侵机体,引起严重的病理性损害[8-9]。pOX2 质粒负责编码荚膜蛋白,可抵御炭疽杆菌繁殖体被机体吞噬。pOX1 和pOX2 质粒任缺其一,都将大大降低炭疽杆菌的致病力[10]。
炭疽杆菌常用的检测方法有细菌培养、Ascoli沉淀试验、荚膜免疫荧光检测、抗体ELISA 检测、PCR、荧光量子点免疫标记法、RPA 等温扩增、上转磷光免疫层析技术等[11-15]。其中,荧光PCR 方法具有特异性强、灵敏度高、准确性好等优点。为了提高我国出入境口岸对不明粉未快件样品的查验效率,防范邮递样品的炭疽攻击,本研究使用TaqMan 探针技术,建立了针对炭疽杆菌两种毒力质粒pOX1 和pOX2 的双重荧光PCR 检测方法,并对该方法的特异性、灵敏性和稳定性进行了试验,以期为炭疽的精准防控提供技术支撑。
1 材料和方法
1.1 主要试剂和仪器
细菌DNA 提取试剂盒(HiPure Bacterial DNA kit),购自广州美基生物科技有限公司;荧光PCR 通用试剂(Premix ExTaq),购自宝生物工程(大连)有限公司。荧光PCR 仪(QuantStudio 7 Flex),购自美国ABI 公司。
1.2 质粒和细菌
含炭疽杆菌pOX1 和pOX2 保守序列的质粒,由生工生物工程(上海)股份有限公司合成;金黄色葡萄球菌、表皮葡萄球菌、嗜肺巴斯德杆菌、铜绿假单胞菌、螺杆菌、沙门氏菌、志贺氏菌、大肠杆菌、化脓棒状杆菌、肺炎克雷伯菌、支气管鲍特杆菌、无乳链球菌、蜡样芽孢杆菌、副溶血弧菌、单增李斯特菌,由上海海关动植物与食品检验检疫技术中心微生物室保存;产气荚膜梭菌、布鲁氏菌、猪丹毒杆菌、副猪噬血杆菌,由南昌海关技术中心提供。
1.3 细菌核酸提取
取500 μL 细菌培养液,按照细菌DNA 提取试剂盒要求进行核酸抽提,最后将DNA 用50 μL水溶解作为模板,置于-20 ℃保存备用。
1.4 引物和探针
使用Vector NTI Suite 软件分析GenBank 上公布的炭疽杆菌毒力质粒pOX1 和pOX2 的基因序列,选择保守区域,使用Primer Express 软件设计引物和TaqMan 探针(表1)。
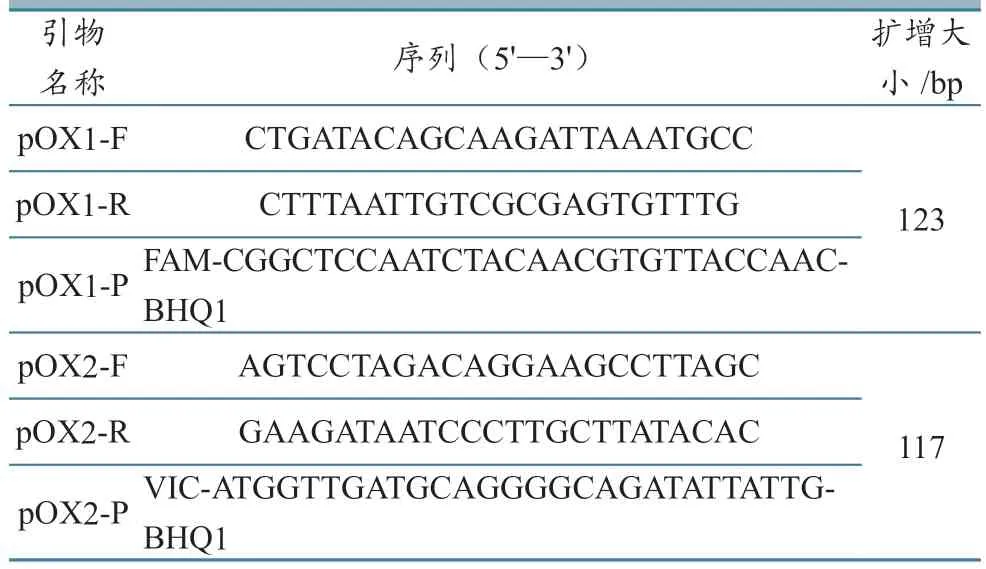
表1 引物和探针序列
1.5 检测体系和反应条件
双重荧光PCR 检测体系:2×Premix ExTaq缓冲液10.0 μL、pOX1 和pOX2 质粒正反向引物(30 μmol/L)各0.4 μL、pOX1 和pOX2 质粒探针(30 μmol/L)各0.3 μL、待检核酸模板3.0 μL,加水补足总体积至20.0 μL。单重荧光PCR 检测体系:2×Premix ExTaq缓冲液10.0 μL、pOX1 或pOX2 质粒正反向引物(15 μmol/L)各0.8 μL、pOX1 或pOX2 质粒探针(15 μmol/L)0.6 μL、待检核酸模板3.0 μL,加水补足总体积至20.0 μL。双重和单重荧光PCR 反应条件均为95℃ 3 min;95℃ 10 s、60℃ 30 s(收集荧光信号),共45 个循环。
1.6 特异性试验
采用建立的双重荧光PCR 方法分别检测炭疽杆菌pOX1 和pOX2 质粒以及金黄色葡萄球菌等19 种对照病原菌,验证该方法的特异性。
1.7 灵敏性试验
将炭疽杆菌pOX1 和pOX2 质粒依次10倍比稀释至拷贝数浓度为1×104、1×103、1×102、1×101、1×100copies/μL,采用建立的双重荧光PCR 方法和单重荧光PCR 方法同时进行检测,以水为阴性对照,验证该方法的灵敏性。
1.8 稳定性试验
配制双重荧光PCR 反应体系,均分为4 份后冻存。每间隔2 个月取出1 份,用于pOX1 和pOX2 质粒及48 份阴性组织样本检测,验证该方法的稳定性。
1.9 临床样品检测
采用建立的双重荧光PCR 方法分别对口岸入境的200 份猪肉样本、200 份牛肉样本和200 份羊肉样本进行炭疽杆菌核酸检测。
2 结果
2.1 特异性试验
采用建立的双重荧光PCR 方法,同时用于炭疽杆菌毒力质粒pOX1 和pOX2 和其他对照病原菌的检测。结果(图1)显示,仅pOX1 和pOX2 质粒出现阳性扩增曲线,其余对照菌均未出现扩增曲线。
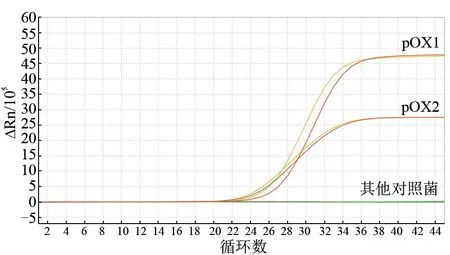
图1 特异性试验结果
2.2 灵敏性试验
将炭疽杆菌毒力质粒pOX1 和pOX2 分别进行10 倍比稀释,同时用建立的双重荧光PCR和单重荧光PCR 方法进行检测。结果(图2)显示,双重荧光PCR 和单重荧光PCR 方法对pOX1 和pOX2 质粒的最低检测限均为1×101copies/μL。

图2 灵敏性试验结果
2.3 稳定性试验
结果显示,4 个保存反应体系扩增阳性质粒的Ct 值和峰值几乎一致,而所有阴性样品均未出现扩增曲线。
2.4 临床样品检测
结果显示,仅阳性对照出现典型“S”形扩增曲线,600 份猪牛羊肉组织样本中均未检出炭疽杆菌阳性核酸。
3 讨论
炭疽杆菌可以形成抵抗力强且长期存活的芽孢,因而被芽孢污染的溪谷、滩地、凹地和草场等环境可能会成为炭疽的自然疫源地。炭疽的流行有明显的季节性,常流行于夏季,特别是在大降雨之后,雨水容易将环境中的炭疽芽孢冲刷出来,使得放牧牲畜接触炭疽芽胞的概率增加,从而造成炭疽暴发或流行。炭疽杆菌是严重威胁公众健康的致病菌之一,因此建立一种快速准确的检测方法,是迅速发现并控制病原扩散的有效手段。针对我国出入境邮件包裹中不明来源的粉未开展炭疽杆菌快速检测,既保证了正常邮件快速通关,又可防范通过邮件引发的恶意恐怖事件。
基于此,本研究建立了针对炭疽杆菌毒力质粒pOX1 和pOX2 的双重荧光PCR 检测方法。同时检测2 种炭疽杆菌靶基因,既保证了检测结果的可靠性,又能对炭疽杆菌的毒力进行预判,为后继的处置提供更多参考。双重荧光PCR 方法可能存在2 套检测体系在同一反应管内相互干扰的情况,本研究分别比较了双重和单重体系检测同一份样品的灵敏性,发现双重检测体系与单重检测体系的最低检测限一致。另外,如果检测过程中出现单一通道阳性的情况,那么首先应当考虑复检。复检时应重新提取核酸,并尽可能增加样本提取量及模板添加量(减少水的补充),以确认疑似样品是否为单一质粒阳性。如果确认为单一质粒阳性,可以初步判定为低致病性炭疽杆菌[10]。为了保证检测结果的可靠性,本研究还验证了该方法的特异性和稳定性。结果显示:19 种对照病原菌均未出现扩增曲线,说明特异性较强;低温保存2、4、6、8个月的反应体系扩增阳性质粒的Ct 值和峰值几乎一致,说明稳定性良好。
综上所述,本研究建立的炭疽杆菌双重荧光PCR 检测方法特异性强、灵敏度高、稳定性好,可满足国境口岸对动物源性产品和国际邮件样品中炭疽杆菌检疫排查的需求。
