牛多杀性巴氏杆菌LolA 蛋白的免疫特性
2023-02-15张春晓李昕甜王娟王苗赵奇王利丽孙欣艺侯冠欣张志强
张春晓,李昕甜,王娟,王苗,赵奇,王利丽,孙欣艺,侯冠欣,张志强
(1.河北科技师范学院,河北省预防兽医学重点实验室,河北秦皇岛 066600;2.乳山市农业农村局,山东乳山 264500;3.武汉市动物疫病预防控制中心,湖北武汉 430000)
多杀性巴氏杆菌(Pasteurella mutocida,Pm)是一种重要的人兽共患病病原菌,可引起多种动物多类型感染,常见有巴氏杆菌肺炎、禽霍乱、羊肺炎、猪萎缩性鼻炎、兔脓血病等。Pm 主要引起牛的呼吸系统疾病,是危害全球养牛业的病原之一[1]。荚膜分型是Pm 血清分型的主要依据。引起牛感染的Pm 以A 型和B 型为主,其中A 型主要引起牛肺炎,B 型引起牛出血性败血症。由于该菌血清型众多且不同菌株间缺乏交叉保护[2],因此疫苗的免疫效果并不确切,加之我国采用“北牛南调,西牛东运”的肉牛育肥模式,这均给Pm 感染防控增加了难度[3]。
研究[4]表明,荚膜、脂多糖、外膜蛋白及毒素等在Pm 致病过程中发挥着重要作用,因此有效单一抗原的筛选对Pm 交叉免疫保护性疫苗的研发尤为关键[5]。LolA 蛋白既是细胞外膜的蛋白成分之一,同时又属于ABC 转运体蛋白[6]。转运体蛋白不仅与细菌耐药性相关,而且在致病性中发挥重要作用[7-8]。外膜LolA 蛋白能够广泛吸收菌体的内源性物质和外源性物质并不断累积,参与药物及底物的运输过程,也与大多数转运体蛋白相同,与细菌的多重耐药性有着密切的关系,还能够作为靶点识别机体的免疫系统[9]。有研究[10]表明,Pm 的外膜蛋白可对免疫小鼠产生良好的交叉免疫保护作用。张宇航[11]等发现,猪胸膜肺炎放线杆菌的外膜LolA 蛋白具有优良的免疫原性。因此,本研究拟利用原核表达系统表达牛源Pm LolA 蛋白,并通过动物模型评估该重组蛋白的免疫原性和免疫保护效果,以挖掘LolA 蛋白的疫苗潜力,为Pm 免疫保护蛋白的筛选积累技术资料。
1 材料与方法
1.1 试验材料
牛源Pm、pMD18-T、pET-32a、DH5α、BL21感受态细胞,由河北科技师范学院动物传染病研究室提供;6~8 周龄清洁级昆明小鼠,购自中国医学科学院实验动物研究所;SDS-PAGE 凝胶试剂盒、Ni-Agarose His 标签蛋白纯化亲和层析柱、鼠源抗His 标签抗体、HRP 标记抗体(山羊抗小鼠IgG),购自北京康为世纪公司;PVDF 膜,购自美国Millipore 公司;质粒小提试剂盒,购自OMEGA 公司。
1.2 lolA 基因克隆及序列分析
根据NCBI 登录的Pm 参考菌株基因组序列(CP95014.1),分别设计含BamH I和SalI 酶切位点的上下游引物。引物P1:5'-CGGGATCCGATGCAGCAAGCGAATTACAGCAAC-3'(BamH I);引 物P2:5'-ACGCGTCGACTTTTTGGCGTTGGTCATCGAGTTCT-3'(SalI)。
使用细菌基因组提取试剂盒提取牛源Pm 基因组。以P1/P2 为引物,提取的基因组为模板扩增lolA基因,并将其克隆到pMD18-T 载体上送至上海生物工程公司测序。将所测的基因序列与GenBank 中不同动物源性Pm的lolA基因序列进行Blast 对比,并进行系统进化树分析。
1.3 重组质粒pET-32a-lolA 构建
将测序正确的PmlolA基因片段与pET-32a载体同时使用BamH I和SalI 限制性内切酶进行双酶切后连接过夜,并转化DH5α 感受态细胞。将PCR 和双酶切鉴定为阳性的重组质粒命名为pET-32a-lolA,并送至上海生物工程公司进行测序。
1.4 rLolA 蛋白原核表达与验证
参照文献[12]方法,将重组质粒pET-32a-lolA、空白质粒pET-32a 同时转化BL21 感受态细胞;经IPTG 诱导培养后,通过SDS-PAGE 凝胶电泳和Western blot 判断目的蛋白的表达情况。
1.5 rLolA 蛋白可溶性分析与纯化
将诱导培养的重组菌体进行超声破碎,通过SDS-PAGE 凝胶电泳分析目的蛋白在沉淀和上清中的表达情况,并根据结果选择合适的蛋白纯化方法;将纯化后的蛋白于-70 ℃保存备用。
1.6 免疫小鼠血清抗体水平检测
参照文献[13]方法,取清洁级昆明小鼠20只平均分为试验组与对照组,以纯化的rLolA 蛋白作为抗原,以50 μg/只的剂量,经弗式完全佐剂乳化后背部多点注射试验组小鼠;2 周后和4 周后分别进行二免和三免,后两次免疫使用弗氏不完全佐剂乳化蛋白。对照组于相同时间点注射相同佐剂乳化的PBS。每次免疫前后分别从小鼠尾尖采血,分离血清于-20 ℃保存。以rLolA 重组蛋白为包被抗原,利用间接ELISA 方法检测小鼠血清的抗体效价,以阴性血清OD450nm平均值+3SD 作为阴阳性判定标准,绘制小鼠血清特异性抗体水平曲线。
1.7 rLolA 蛋白免疫小鼠保护试验
取20 只清洁级昆明小鼠平均分为试验组与对照组,参照1.6 的方法进行3 次免疫。参照文献[14]方法,于首免后48 d,对两组小鼠腹腔接种2 LD50(1.64×106CFU)Pm 菌液,观察7 d,统计两组小鼠的死亡情况。
2 结果与分析
2.1 lolA 基因克隆及序列分析
利用PCR 方法扩增完整的lolA基因片段,于618 bp 处出现特异性条带,与预期结果一致(图1)。将目的基因克隆到pMD18-T 载体上,经PCR 和双酶切鉴定出现一致条带,且基因测序结果无突变移码。系统进化树(图2)显示,所测序列与不同动物源性PmlolA基因同源性较高,说明该基因高度保守。
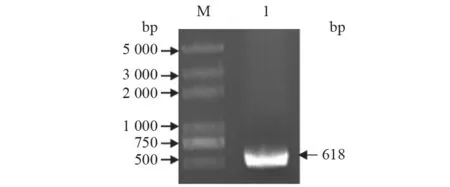
图1 PCR 扩增Pm lolA 基因结果
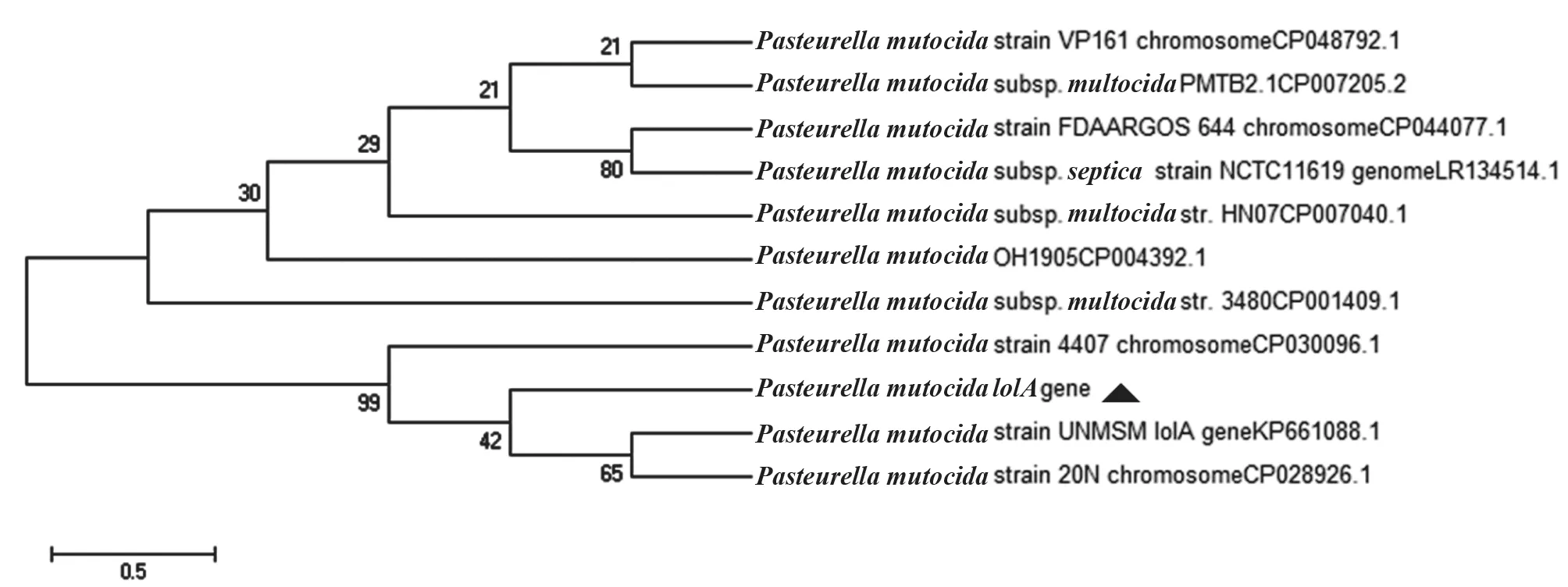
图2 不同菌株lolA 基因同源性分析结果
2.2 rLolA 蛋白原核表达与验证
利用SDS-PAGE 凝胶电泳检测重组蛋白,电泳结束后将分离胶放入适量考马斯亮蓝R-250 染色液中染色,染色完成后用去离子水进行脱色处理,直至出现清晰条带。重组蛋白在约40 ku 处出现特异性条带,与预期大小一致(图3)。进一步以His-Tag 为一抗(1:1 000 稀释)进行Western blot分析,发现目的条带同样出现在约40 ku 处(图4),表明rLolA 蛋白表达成功。
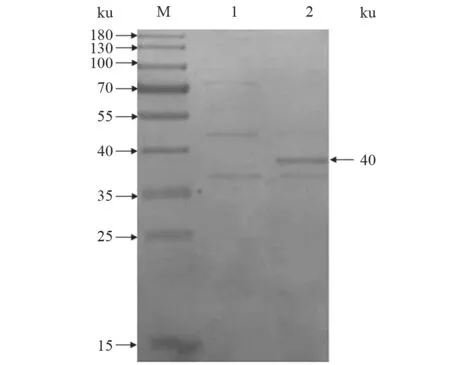
图3 SDS-PAGE 结果
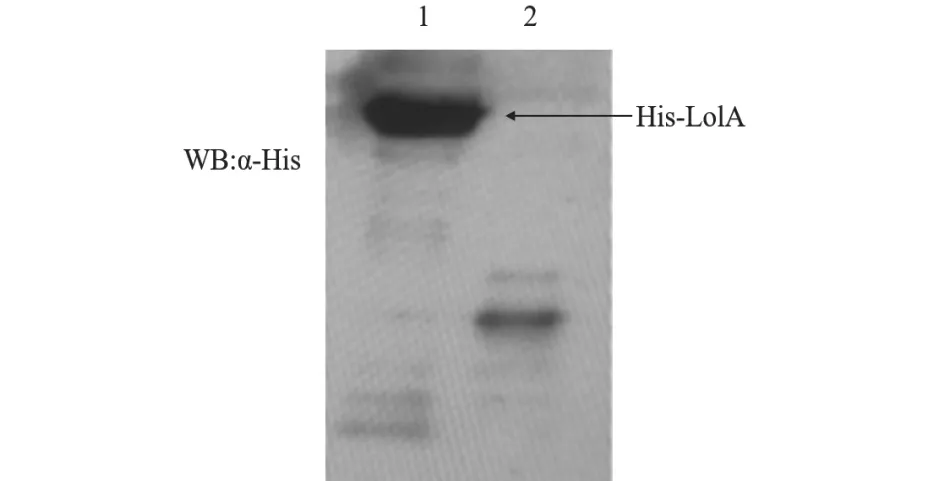
图4 Western blot 结果
2.3 rLolA 蛋白可溶性分析及纯化
对rLolA 蛋白进行的可溶性分析结果(图5)显示,重组蛋白主要表达在上清中;使用镍离子亲和层析柱纯化上清液,发现在40 ku 处出现目的条带(图6);使用ND-2000 超微量核酸蛋白测定仪测定的蛋白质量浓度为1.029 2 mg/mL。

图5 rLolA 蛋白可溶性分析结果
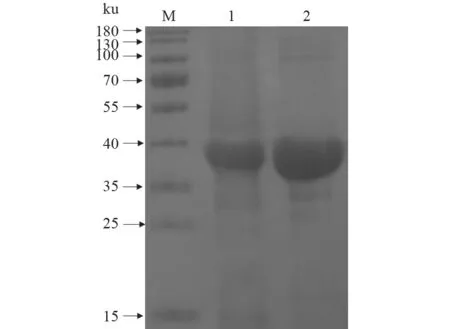
图6 rLolA 蛋白纯化效果
2.4 免疫小鼠血清抗体水平检测
结果(图7)显示,经两次免疫后,试验组小鼠相比对照组小鼠产生较高水平的特异性抗体,并在三免后达到最高水平,表明该重组蛋白具有良好的免疫原性。
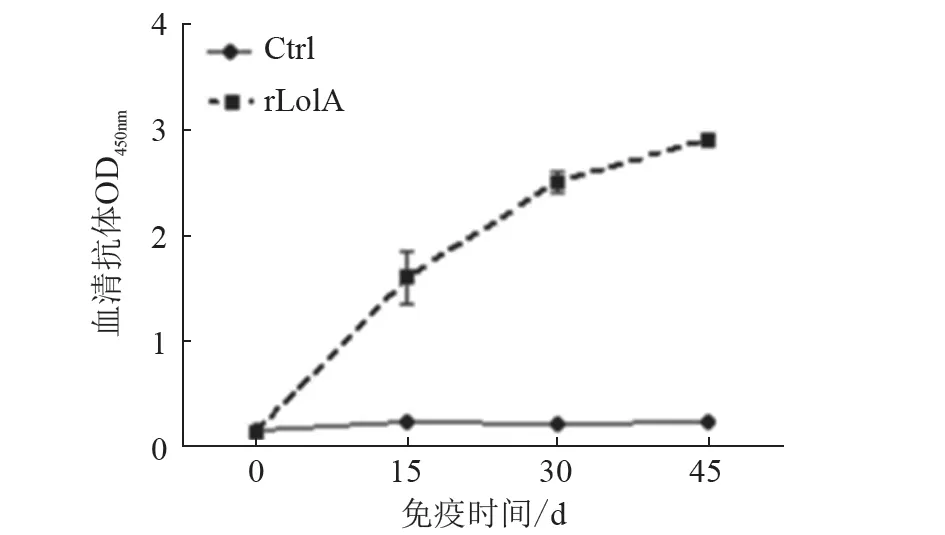
图7 免疫小鼠血清抗体水平变化
2.5 rLolA 蛋白免疫小鼠保护试验
首免后48 d,对试验组及对照组小鼠均以2 LD50牛源Pm 菌液进行腹腔感染,记录各组致死量。结果(图8)显示,在攻毒后3 d 内,对照组小鼠存活率为0,而试验组小鼠存活率为55%,表明rLolA 蛋白具有一定的免疫保护效果。
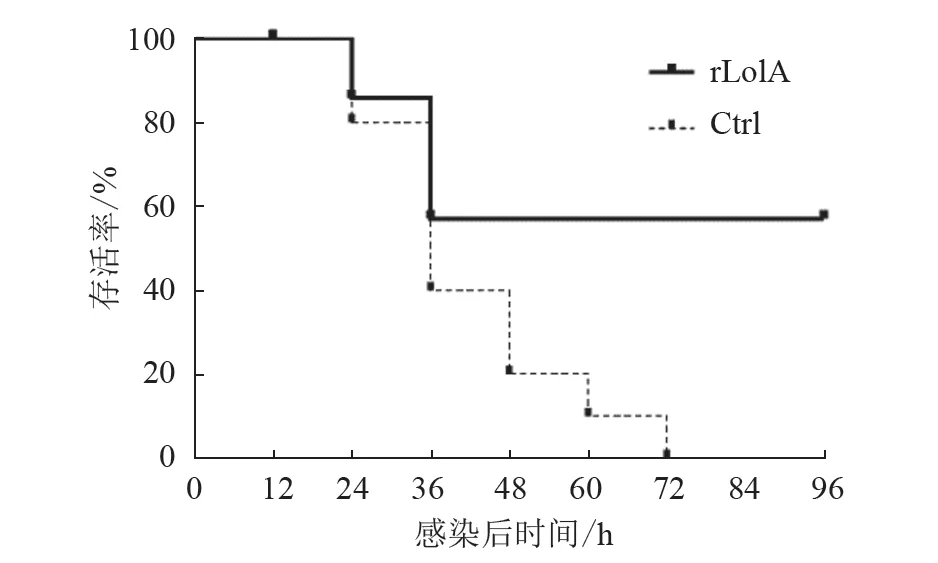
图8 rLolA 蛋白对小鼠的免疫保护效果
3 讨论
近年来,牛呼吸系统疾病(BRD)严重阻碍着全球养牛业的健康发展,其中Pm 是引发BRD的重要病原体之一。此外,Pm 还可引起多种动物患病[15-16],导致人患细菌性脑膜炎,给养殖业带来巨大经济损失的同时严重威胁着公共卫生安全[17-18]。因此,研发有效的Pm 疫苗尤为重要。已有研究[19]发现,以Pm 外膜蛋白为抗原,与相应佐剂混合制备成疫苗,其免疫效果显著。LolA 蛋白是外膜蛋白的重要组成部分,不仅参与调控细菌的吸附过程,在其他细菌上的免疫原性也已被证实[20]。本试验对不同菌株的lolA基因进行同源性分析并构建系统发育树,发现不同动物源性PmlolA基因同源性较高,序列高度保守。这意味着该蛋白对于其他动物感染Pm 也可能具有良好的免疫保护效果。本试验选择牛源Pm 外膜LolA 蛋白进行原核表达,进一步获得了纯化的重组蛋白,进而通过小鼠模型评估了rLolA 蛋白的免疫效果,证明该蛋白具有较强的免疫原性。
本试验借鉴前人经验于首免后48 d 进行动物感染试验,发现重组蛋白对免疫小鼠的保护率达55%,但该蛋白的免疫持续期仍然未知;另外本试验只是基于抗体效价的检测,缺少细胞免疫方面的研究,这些问题有待进一步验证。
通过融合蛋白的方式提高蛋白免疫特性的研究日益增多,将鞭毛蛋白作为疫苗载体蛋白或者疫苗佐剂与外膜蛋白形成融合蛋白,可显著提高外膜蛋白的免疫原性[21-22]。LolA 蛋白是否可以通过此种方式提高免疫保护效果将是接下来的研究方向。
