Ames试验与HPRT试验两种方法对6种氧化型染发剂的检测
2023-02-14陈秀娟李培宁吴剑辉黄晓辉刘香梅
陈秀娟,李培宁,江 漪,吴剑辉,黄晓辉,杨 云,吴 谦,刘香梅
(广州质量监督检测研究院,广东 广州 511447)
染发剂是可以用来改变头发颜色以达到美容为目的的化妆品,主要由染料、稳定剂、氧化剂等组成[1]。根据是否发生氧化反应分为氧化型染发剂和非氧化型染发剂,氧化型染发剂具有染色效果好、持色时间长、色调范围广且色泽相对比较自然的优点,是当前染发剂市场的主流产品,但其毕竟是化学合成的物质,而且染发过程实质也是化学反应的过程,有可能会引起皮肤过敏、毛囊损伤等副作用,甚至还有致癌的风险[2],其对健康的影响越来越受到人们的重视。我国的《化妆品监督管理条例》中把染发剂列为特殊化妆品进行管理,而氧化型染发剂须经过致突变性检验,包括细菌回复突变试验(即Ames试验)和体外哺乳动物细胞基因突变试验。本文选用分析HPRT 位点突变方法进行体外哺乳动物细胞基因突变试验,以下称HPRT 试验。通过Ames 试验和HPRT 试验两种方法检测6 种国内外生产的氧化型染发剂,并对其结果进行分析比较,探讨两种方法在氧化型染发剂中致突变性检测中的应用。
1 材料与方法
1.1 材 料
1.1.1 受试物受试物为6 种氧化型染发剂,其中1、2、3号样为广东某生产企业送检产品,4、5、6号样为某代理商送检的进口产品。受试物均为A、B 两剂型的无菌未开封独立包装产品,A剂均为膏状物,B剂均为黏稠乳液。试验前,在无菌条件下,按产品使用说明书的比例要求,将A、B 两剂混合均匀后,称取5.0 g以灭菌水配制成100.0 mg/mL的混悬液,再逐级2 倍稀释制成一系列的受试物,浓度范围从3.12~100.0 mg/mL,用于Ames 试验。另称取A、B 两剂混合物5.0 g,以无血清MEM培养基配制成100.0 mg/mL的混悬液,同样逐级2 倍稀释制成一系列的受试物,浓度范围从0.048 8~100.0 mg/mL,用于HPRT试验。
1.1.2 试验菌株鼠伤寒沙门氏菌组氨酸缺陷型TA97a、TA98、TA100、TA102 和 TA153 菌株,购自美国MOLTOX公司,贮存于4 ℃冰箱。
1.1.3 细胞株中国仓鼠肺细胞株V79,购自中国科学院上海生命科学研究院细胞资源中心,贮存于液氮中。V79细胞培养于37 ℃、CO2体积分数为5%的二氧化碳培养箱,采用含10%胎牛血清、100 U/mL 青霉素、100 μg/mL链霉素的MEM培养液。
1.1.4 主要试剂和阳性对照琼脂粉购于北京三药科技开发公司;营养肉汤购于广东环凯微生物科技有限公司;HPRT 试剂盒,购自北京汇智泰康医药有限公司。MEM 培养基和胎牛血清,均购于美国Gibco 公司;大鼠肝匀浆上清液(S9),购于江苏齐氏生物科技有限公司。叠氮钠和2-氨基芴均购于美国Sigma Aldrich公司;敌克松购于美国ChemService公司;1,8-二羟基蒽醌购于阿拉丁试剂有限公司;2-氨基蒽购于日本TCI公司。
1.1.5 主要仪器全自动Ames 实验仪购于北京慧荣和科技有限公司;生化培养箱及二氧化碳培养箱购于美国SHELLAB 公司;抑菌圈测量及菌落计数仪购于杭州迅数科技有限公司的Czone 系列;Scepter 2.0 细胞计数器购于Millipoer公司;AxioVert A1倒置显微镜购于蔡司公司。
1.1.6 代谢活化系统经β-萘黄酮和苯巴比妥钠诱导的大鼠肝匀浆上清液(S9),加相应的辅助因子(6-磷酸葡萄糖、辅酶Ⅱ)配制成含S9组分10%的S9混合液,作为体外代谢活化系统。
1.2 实验方法
1.2.1 Ames 试验[3]将5 种试验菌株分别接种于8 mL营养肉汤中,于37 ℃培养12 h,菌液划线接种于预先制备的相应的主平板中,TA97a、TA98 和TA100接种于氨苄-青霉素主平板,TA102接种于四环素主平板,TA1535接种于组氨酸-生物素主平板。37 ℃培养48 h,待长至典型菌落后置2~8 ℃冰箱保存。试验前,分别从主平板上选取相应单菌落接种于25 mL营养肉汤增菌培养,即置于37 ℃恒温培养箱中振荡(100次/min)培养10 h,备用。
根据受试物的毒性和溶解度,在加S9和不加S9代谢物活化系统条件下分别进行试验,各受试物分别设4个剂量组,同时设空白对照组、溶剂(灭菌水)对照组及阳性对照组。在加S9条件下,TA97a、TA98 和TA100 以DMSO 溶解的2-氨基芴为阳性对照,浓度为10.0 μg/皿;TA102以DMSO溶解的1,8-二羟蒽醌为阳性对照,浓度为 50.0 μg/皿;TA1535 以DMSO 溶解的2-氨基蒽为阳性对照,浓度为3.0 μg/皿。在不加S9条件下,TA97a和TA98以50.0 μg/皿的敌克松水溶液为阳性对照;TA100 和 TA1535 以 1.5 μg/皿的叠氮化钠水溶液为阳性对照;TA102 以4.0 μg/皿的丝裂霉素C水溶液为阳性对照。用全自动Ames 实验仪按技术规范的要求设置仪器参数进行试验,即2.0 mL顶层培养基、0.1 mL 菌液、0.1 mL 相应受试物、0.5 mL S9或0.5 mL PBS,待平皿冷凝固化后,倒置于37 ℃生化培养箱里培养48 h,计数每皿回变菌落数。计算各菌株各剂量3个平板回变菌落数的均值和标准差。
受试物诱发 TA97a、TA98、TA100、TA102 回变菌落数是溶剂对照组的2 倍或2 倍以上,受试物诱发TA1535 的回变菌落数是溶剂对照组的3 倍或3 倍以上,并出现以下情形之一,则该受试物判定为致突变阳性:①呈剂量-反应关系;②任何一个剂量条件下,出现阳性反应并有可重复性。受试物经上述5 个试验菌株测定后,只要有1 个试验菌株,无论在加S9或不加S9条件下为阳性,均可报告该受试物细菌回复突变试验为致突变阳性。反之为阴性。
1.2.2 HPRT试验[4]V79细胞复苏后,培养至第2代时,对细胞进行纯化处理,即将V79 细胞置于含THMG 的培养液中培养24 h,杀灭自发的突变细胞,然后将细胞再接种于含THG 培养液中培养2 d,减少细胞的自发突变率,达到纯化的目的。试验前,将纯化后生长良好的细胞接种于培养瓶中,放置于37 ℃二氧化碳培养箱中培养24 h后备用。
用HPRT试剂盒,根据受试物的细胞毒性来确定各受试物的剂量,分别设4个剂量组,在加和不加代谢物活化系统条件下分别进行试验,试验同时设阴性对照组(无血清培养基)及阳性对照组。在加S9条件下以终浓度为40 μg/mL的3-甲基胆蒽为阳性对照,在不加S9条件下以终浓度为0.5 μg/mL的丝裂霉素C为阳性对照。按技术规范的方法每皿加入相应浓度的受试物、无血清培养液(需要代谢活化时加S9)至总体积为5 mL,染毒时间为4 h,用PBS洗细胞3次,加入含10%胎牛血清的培养液继续培养22 h,消化细胞制成悬液,以每皿200个细胞接种于直径为10 mm的培养皿,每个剂量组5 个,培养7 d,计算相对集落形成率测试细胞毒性,相对无细胞毒性的产品以5 000 μg/mL 为最高剂量,出现细胞毒性的则以相对集落形成率在10%~20%之间为最高剂量。同时另做突变率测定,每组8个皿,每皿接种2×105个细胞,待细胞贴壁后加入5 μg/mL 的6-TG培养9 d,计数集落数。同时,每组3个皿,每皿200个细胞,不加6-TG,培养7 d,统计每皿集落数,并计算突变频率。计算公式如下:
相对集落形成率=受试物组集落形成率/溶剂对照组集落形成率
集落形成率=实际存活的细胞集落数/接种细胞数
突变频率=(突变集落数/接种细胞数)×(1/集落形成率)
试验结果用卡方检验进行统计学分析,在下列两种情况下可判定受试物在本试验系统中为阳性结果:①受试物引起突变频率的增加具有统计学意义,并有剂量-反应关系。②受试物在任何一个剂量条件下,引起突变频率具有统计学意义的增加,并有可重复性的阳性反应。
2 结 果
2.1 Ames试验
试验前,对测试菌株进行生物学特性鉴定,5 种试验菌株均为组氨酸缺陷型菌株,其表面一层脂多糖屏障缺损;TA97a、TA98、TA100 和 TA102 均含 R 因子对氨苄青霉素具有抗性;TA97a、TA98、TA100 和TA1535具有ΔuvrB突变,切除修复酶缺损,对紫外线敏感;TA102 具有pAQI 质粒对四环素有抗性。5 种试验菌株的生物学特性符合试验要求,自发回变数均在正常值范围内,符合试验要求。无论是在加和不加代谢物活化系统条件下,溶剂对照组回变菌落数均在正常值范围内,阳性对照组回变菌落数均超过溶剂对照组的2倍(TA1535为3倍)以上,试验系统符合要求。
加S9条件下,在预试验中,6 个受试产品分别配制成10 000 μg/皿时,在顶层培养基中为均匀的混悬液,凝固在底层培养基中可见轻微的细小颗粒但不影响结果的观察,也不影响菌落的计数,琼脂呈乳白色,背景菌苔生长良好,未见细菌毒性,所以均以10 000 μg/皿为加S9条件下的最高剂量组,以下设5 000、2 500及1 250 μg/皿共4个剂量组。培养结束后,观察受试物各剂量组平皿,琼脂均呈乳白色,背景菌苔生长良好,均未见细菌毒性。1号和2号产品所测试的4个剂量组均引起TA97a、TA98和TA1535回变菌落数的明显增加,超过溶剂对照组的2 倍(其中TA1535 是3 倍),并有剂量-反应关系。3 号产品所测试的4 个剂量组均引起TA97a、TA98 和TA100 回变菌落数的明显增加,超过溶剂对照组的2倍(其中,引起TA100 回变菌落数异常增加仅表现在两个稍高浓度的剂量组中),并有剂量-反应关系。4 号、5 号和6 号产品所测试的4个剂量组引起TA98回变菌落数的明显增加,超过溶剂对照组的2 倍,并均有剂量-反应关系,受试物诱发的回变菌落数见表1。
表1 Ames试验中加S9条件下6种受试物诱发的回变菌落数(,n=3)

表1 Ames试验中加S9条件下6种受试物诱发的回变菌落数(,n=3)
*:回变菌落数超过溶剂对照的2倍;**:回变菌落数超过溶剂对照的3倍.
TA1535 19±2 20±1 24±2 1 685±22**118±3**85±5**78±7**61±3**95±5**82±3**79±4**60±3**30±4 35±2 30±6 23±3 18±3 23±2 21±2 20±3 22±2 19±2 19±3 18±1 21±2 19±2 19±1 20±3组别空白对照溶剂对照(灭菌水)溶剂对照(DMSO)阳性对照1号产品2号产品3号产品4号产品5号产品6号产品10 000 5 000 2 500 1 250 10 000 5 000 2 500 1 250 10 000 5 000 2 500 1 250 10 000 5 000 2 500 1 250 10 000 5 000 2 500 1 250 10 000 5 000 2 500 1 250 TA97a 154±4 151±3 158±7 1 587±25*1 146±14*775±9*465±13*352±10*884±19*634±7*455±11*392±10*472±11*449±14*367±6*318±5*296±5 280±8 207±8 183±5 281±3 235±13 215±8 170±5 235±8 181±9 151±9 149±8 TA98 38±2 35±3 40±4 2 166±28*635±10*367±13*256±8*127±9*376±10*232±15*103±11*93±9*362±5*321±17*181±4*126±6*376±8*163±4*123±11*90±4*576±20*263±12*202±17*112±9*276±8*145±5*102±5*81±3*TA100 146±12 146±10 155±8 1 879±11*229±5 211±5 186±5 120±6 215±10 193±6 168±6 140±5 313±8*329±6*219±7 172±6 155±9 154±9 155±11 151±10 160±7 147±9 163±11 154±12 144±6 148±8 155±7 145±4 TA102 304±7 296±9 310±11 1 546±19*307±4 295±11 300±13 281±11 285±6 296±15 287±15 261±10 303±9 296±4 310±8 296±8 307±12 302±18 310±8 313±6 288±8 307±8 307±12 297±12 301±12 308±9 282±4 294±5
不加S9条件下,在预试验中1 号、2 号、3 号和6 号产品在 5 000 μg/皿剂量时;4 号和 5 号产品在10 000 μg/皿剂量时,琼脂清亮透明,背景菌苔生长不良,且存活菌落数均少于测试菌株的正常值,说明6 种产品均出现不同程度的细菌毒性,所以在不加S9条件下,各产品最高剂量的设置以细菌毒性为依据,以下设4 个剂量组。培养结束后,观察受试物各剂量组平皿,琼脂均呈乳白色,背景菌苔生长良好,均未见细菌毒性。1 号、2 号和3 号产品在312~5 000 μg/皿时,各剂量组均未引起5种试验菌株回变菌落数的增加;4号、5号和6号产品均引起TA97a和TA98回变菌落数的增加;其中4 号和5 号产品在1 250~5 000 μg/皿时,3 个剂量组均引起TA98 回变菌落数超溶剂对照组的2倍,并有剂量-反应关系;6号产品在 2 500 μg/皿及 1 250 μg/皿时,引起 TA98 回变菌落数超溶剂对照组的2倍,并有剂量-反应关系。受试物诱发的回变菌落数见表2。
表2 Ames 试验中不加S9条件下6 种受试物诱发的回变菌落数(,n=3)

表2 Ames 试验中不加S9条件下6 种受试物诱发的回变菌落数(,n=3)
*:回变菌落数超过溶剂对照的2倍;**:回变菌落数超过溶剂对照的3倍.
组别空白对照溶剂对照(灭菌水)阳性对照1号产品2号产品3号产品4号产品5号产品6号产品TA1535 19±2 17±1 978±22**18±2 17±1 19±2 21±3 19±3 18±2 18±2 18±3 18±2 17±2 19±2 22±2 18±1 20±3 19±3 21±4 20±3 16±2 20±3 20±2 20±3 22±1 19±2 20±3 2 500 1 250 625 312 2 500 1 250 625 312 2 500 1 250 625 312 5 000 2 500 1 250 625 5 000 2 500 1 250 625 2 500 1 250 625 312 TA97a 133±4 136±3 2 110±34*198±18 193±6 167±5 167±3 196±3 217±4 186±7 186±11 138±4 134±11 132±5 132±6 341±9*281±4*191±7 172±3 389±15*299±9*187±7 156±9 290±5*177±4 168±4 152±5 TA98 34±2 34±2 1 257±21*35±3 33±3 36±3 34±4 35±4 37±3 34±3 32±2 36±3 36±2 31±2 35±5 221±20*146±9*83±3*47±4 357±17*135±10*91±5*48±4 191±4*112±3*65±3 50±2 TA100 129±6 133±8 1 354±20*174±5 171±6 148±9 150±5 184±10 149±3 145±9 153±9 154±7 157±3 153±8 160±8 150±8 146±6 137±10 143±12 148±4 161±7 140±5 150±5 146±4 137±5 135±6 137±10 TA102 257±16 264±4 1 887±19*266±6 259±7 262±10 259±9 269±6 259±2 250±7 260±4 259±7 261±10 252±12 253±8 257±5 253±9 249±3 254±6 256±6 255±10 252±9 258±5 265±7 266±11 252±8 257±4
总结上述结果,6种受试物的Ames试验结果均为阳性。
2.2 HPRT试验
加S9条件下,1号、2号和3号产品均显示有一定的细胞毒性,其中1 号和2 号产品在2 500 μg/mL时,相对集落形成率分别为16.99%及15.30%,3号在625 μg/mL 时,相对集落形成率为15.06%,并以此作为其各自的最高剂量。4号、5号和6号产品为相对无细胞毒性的产品,以5 000 μg/mL 为最高剂量,相对集落形成率分别为91.03%、97.65%和87.39%,相对集落形成率及突变率见表3。
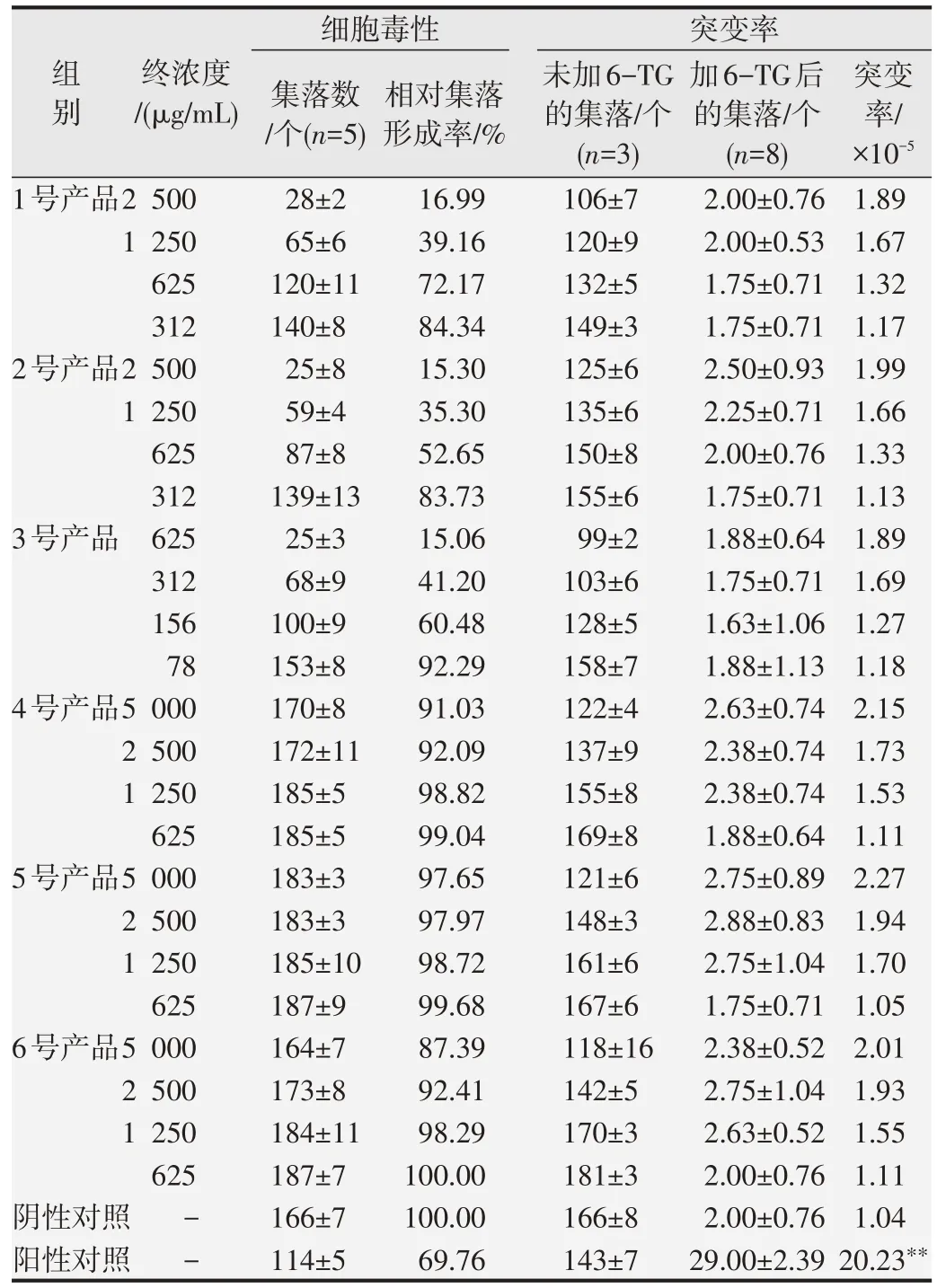
表3 HPRT试验中加S9条件下6种受试物引起V79细胞的突变率
不加S9条件下,各样品均存在一定的细胞毒性,其中1 号、2 号和6 号产品在所设的最高剂量39 μg/mL时,相对集落形成率分别为17.53%、13.11%及14.66%,3 号和4 号产品最高剂量为78 μg/mL 时,相对集落形成率分别为14.63%、16.94%,5 号产品最高剂量为156 μg/mL时,相对集落形成率为11.12%,相对集落形成率及突变率见表4。

表4 HPRT试验中不加S9条件下6种受试物引起V79细胞的突变率
用卡方检验对6 个受试物引起的突变率进行统计学分析,无论是加与不加S9条件下,差异均无统计学意义(P>0.05),6种受试物的HPRT试验结果均为阴性。
3 讨 论
Ames试验是以营养缺陷型的沙门氏菌为指示生物的回复突变试验,HPRT 试验是利用体外培养的哺乳动物细胞为指示的正向突变试验,由于哺乳动物细胞具有较完善的DNA修复功能,遗传物质突变后极有可能被修复[5],导致Ames 试验的结果与HPRT 试验的结果会有一些差异。在本研究中,Ames试验检测6种氧化型染发剂均为阳性结果,而HPRT 试验检测则均为阴性结果,也证实了两项实验存在一定的差异。Ames试验以受试物对试验菌株的最低抑菌浓度为最高剂量,HPRT试验以受试物出现细胞毒性(10%~20%的细胞存活)为最高剂量,而从氧化型染发剂的配方组分[6]及大量的研究资料表明,氧化型染发剂具有明显的细胞毒性作用[7]。从本研究可见,无论是加与不加代谢活化系统,Ames 试验的最高剂量普遍高于HPRT 试验。尤其是在不加代谢活化系统条件下,Ames试验最高剂量可达到5 000或2 500 μg/皿,而HPRT 试验最高剂量仅达到156 μg/mL,HPRT 试验每皿细胞加入含受试物的培养基为5 mL,其最高剂量组加入受试物的量为780 或195 μg/皿,HPRT 试验无法设置更高的剂量,这亦是试验结果出现差异的原因。由此可见,HPRT 试验高剂量浓度过低才出现了阴性结果,但由于氧化型染发剂普遍存在细胞毒性,导致HPRT 试验无法设置更高的浓度剂量,那么氧化型染发剂是否适合用HPRT 试验进行测定,尚需要更多的氧化型染发剂做进一步的试验研究,做更大范围的实验数据进行比较。再者,人们在使用氧化型染发剂进行染发时,按产品的使用说明书,A 剂和B 剂混合后直接作用于头发,使用的是产品的原型。若使用者头发长度至肩膀,每人每次使用量为50~60 g;即便是男士的短发,用量也需要10~20 g 之多。从试验的最高剂量来看,两项试验的剂量设置均未达到人体接触量,在这种情况下,需要选择更高剂量的Ames 试验,尽量接近于实际使用情况用以反映染发剂的安全性问题。另外,《化妆品安全技术规范》中HPRT试验的要求以卡方检验对突变率进行系统学分析,而该试验的突变率通常在万分之一至万分之三,在事件发生率如此低的情况下用卡方检验进行统计学分析值得商榷。其次,从试验的周期和操作的复杂程度看,Ames试验染毒后培养2 d即可进行菌落计数,用全自动Ames试验仪器来代替人工加样,只需要一位实验员就可以完成整个加样流程。HPRT 试验从染毒到细胞的表达,到细胞的克隆,实验周期为20 d。而且即使是使用了全动细胞计数仪进行细胞计数,也需要数位实验员来同时参与试验,包括对细胞进行消化、计数、稀释制备适量浓度的细胞悬液,对实验人员的操作熟练程度要求也比较高,从试验周期及操作的简便方面看,Ames试验明显具有优势。再看试验成本,Ames试验所需的培养基大多是比较易得到的营养琼脂培养基,而且有众多的国产品牌可供选择;HPRT 试验所需的MEM 或DMEM 等培养基,大多都是进口或进口分装,价格相对比较昂贵,特别是品质比较好的小牛血清,近年的售价只升不降。而且HPRT 试验周期长,所消耗的培养基、培养瓶和培养皿都比较多,HPRT 试验的成本从各个方面来看均远远高于Ames试验。
综上所述,虽然Ames试验和HPRT试验均可以作为氧化型染发剂致突变性检验的备选项目[8],但HPRT试验因细胞毒性的存在无法设计更高的剂量,从而掩盖了氧化型染发剂致突变性的真实水平,从经济角度和检验周期来看,HPRT 试验亦不是最优选择,因此本文建议对氧化型染发剂进行致突变性检验时,应以快速、简便的Ames 试验在最经济、最短时内完成其致突变性检验,评价其安全性。
