MoO 3在E玻璃中溶解度及玻璃结构的研究
2023-02-13杨柳霍冀川张行泉朱永昌
杨柳 霍冀川 张行泉 朱永昌
(1. 西南科技大学环境友好能源材料国家重点实验室 绵阳 621010;2. 西南科大四川天府新区创新研究院 成都 610213;3. 中国建筑材料科学研究总院有限公司 北京 100024)
0 引言
当前,在配备核设施的国家如法国、英国、美国和俄罗斯等,玻璃固化是最佳且唯一工业化的固定高放废物的方法[1,2]。相较于晶体结构,玻璃基体具有短程有序长程无序的特征,这种特征允许不同元素按不同比例进入玻璃网络或网络间隙,即便它们有各自的化学键合要求,因此,玻璃基体可以固化各种放射性核素。因硼硅酸盐玻璃具有较高的化学耐久性、良好的抗辐射性及高的废物承载能力,所以它被认为是最有前景的高放射性废物固化基材[3]。但是,由于有些元素如钼、硫等在硼硅酸盐玻璃中的溶解度比较小[4],在玻璃固化过程中会引起黄相的产生。我国一些动力堆产生高放废液中含有较高的Mo,所以提高Mo在硼硅酸盐玻璃中的溶解度,对于我国在动力堆高放废物治理方面具有重要意义。根据已有研究,在有配位氧存在的情况下,Mo有两种价态形式,CaMoO4、 Li2M oO4或 Na2M oO4中的钼酸盐四面体(Mo6+O4)和MoO2中 的 扭 曲 八 面 体(Mo4+O6)。Mo6+最 稳定具有较高的场强范围(1.89~1.94 Å-2),会对周围的氧产生强烈的作用及重排效应,所以硼硅酸盐玻璃中,Mo6+一 般与O2-结合形成三维空间的钼酸盐四面体[MoO4]2-[5]。研究表明,[MoO4]2-位于富含非桥氧和碱金属离子及碱土金属离子富集的解聚区[6],随着Mo掺量的增加解聚区不断扩大,当Mo的掺量超过其在硼硅酸盐玻璃中的溶解度时,[MoO4]2-会与碱金属或碱土金属阳离子形成结晶相从玻璃网络中脱离出来,通常这种结晶相呈黄色,故将其称作黄相[7,8]。钼酸盐黄相本身并不具有放射性,但在结晶时,它可能与90S r、137Cs共同析出,而黄相对水的化学耐久性非常差,在深地质处理过程中与地下水接触时会将90S r、137Cs释放到生物圈中,从而造成巨大威胁[9-12]。因此,提高MoO3在硼硅酸盐玻璃中的溶解度对于提高硼硅酸盐玻璃对高放废物的装载能力十分重要。传统硼硅酸盐玻璃对Mo的包容量只有1%~2%。为了提高MoO3在硼硅酸盐玻璃中的溶解度,许多学者进行了大量研究,如向硼硅酸盐玻璃中加入稀土元素(如Nd、La)、高场强阳离子(如Li+、Mg2+)、改变玻璃组成中碱土金属的种类(硼硅酸盐玻璃中随着碱土金属从Ba→Ca,MoO3的溶解度依次增加)及调节硅硼比、钠钙比等[13,14]。
此外,有研究发现,一些在地壳中长期稳定存在的天然矿物也可作为处理高放废物的潜在基材,如玄武岩和透辉石。玄武岩是一种自然资源十分丰富的基性火山岩,具有良好的抗风化性能、抗腐蚀性能,耐磨性好且硬度高,用其制备的玄武岩玻璃化学组成与钙铝硅酸盐玻璃相似,被认为是核玻璃的天然类似物[15]。刘昊等[16]用玄武岩玻璃为基材制备的玻璃固化体中Mo的最大溶解度为5.5%(质量分数),28天后Mo的浸出率为8.5×10-6g /(m2·d)。透辉石是富含钙镁且具有链状结构的硅酸盐矿物,化学式为CaMgSi2O6,自然资源也十分丰富。徐冲等[17]在用透辉石固定Mo的研究中发现,Mo在透辉石中的最大溶解度为8%(质量分数),28天后,Mo的浸出率在10-7g/(cm2· d)数量级。蒋勤等[18]用硼砂对透辉石进行改性后,Mo的最大溶解度可提高到9%(质量分数)。
玄武岩和透辉石对Mo都表现出远高于传统硼硅酸盐玻璃的包容性,且具有良好的化学稳定性,但它们都还只停留在实验室研究阶段,未能进行工业化。E玻璃是一种工业化生产的具有良好稳定性的玻璃,在民用、军用等方面具有广泛应用。所以本实验采用工业化生产的E玻璃为玻璃固化基材,向其中添加MoO3,研究E玻璃对MoO3的包容量及Mo对E玻璃固化体玻璃网络结构和玻璃化转变温度的影响,并与传统硼硅酸盐玻璃、玄武岩和透辉石做比较,以探究E玻璃是否可以作为优质的玻璃固化基材。
1 实验
1.1 实验材料
原料:E玻璃粉末,粒径范围小于0.15 mm,化学成分见表1。
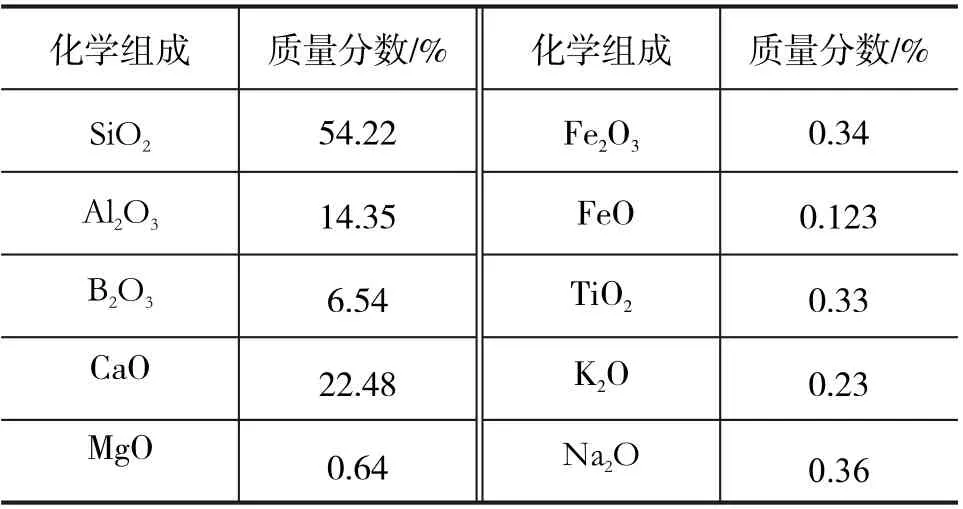
表1 E玻璃化学成分组成
实验试剂:三氧化钼(MoO3),99.9%,阿拉丁试剂,分析纯(A.R)。
实验设备:SL301样品粉碎机;MF-1700℃箱式高温电阻炉、100 mL刚玉坩埚、QM-3SP2-CL行星式齿轮球磨机、FA1004电子分析天平。
1.2 样品制备
E玻璃呈短条状,不便用于实验,故在实验前样品准备时,用SL301样品粉碎机对E玻璃进行粉磨处理,使其粒径小于0.15 mm。
样品成分组成如表2所示。用分析天平按2%、4%、6%、6.5%、7%的比例称取MoO3与E 玻璃粉末混合,将40 g样品装于行星式球磨机的球罐中,以300 r/min的速度运行25 min,然后过筛分离出混合充分的物料,将样品转移置100 mL的刚玉坩埚中,再将坩埚放于高温炉中进行烧制。

表2 玻璃固化体成分组成
前期先在1300 ℃、1350 ℃、1400 ℃下对E玻璃进行熔融以确定烧制温度,发现在1400 ℃下玻璃具有较好的流动性,故选择1400 ℃为烧制温度。高温炉的烧制程序设置为:10 ℃/min从室温升至1400 ℃保温3 h,然后迅速倒在提前预热好的碳板上进行淬火处理再冷却至室温,便得到E玻璃固化体。
1.3 样品表征及测试方法
用X射线衍射仪(XRD,PANalytical,X'Pert PRO,荷兰)对样品进行物相分析。采用激光拉曼光谱仪(Raman,Invia,Renishaw,英国)对样品结构进行分析。用KBr粉体压片法测试波数为400~2000 cm-1范围内的红外吸收光谱(FT-IR,SPECTRUM ONE,PerkinElmer company,美国)。采用综合热分析仪(DSC,TA,SDTQ600,美国)分析样品的热稳定性。测试条件:升温速率10 ℃/min,室温~1000 ℃,空气气氛。
2 结果与讨论
2.1 物相分析
不同MoO3掺量固化体样品(以下用Mx表示,x=0、2、4、6、6.5、7)的XRD结果分析如图1所示。

图1 不同MoO 3掺量样品的XRD谱图
未掺MoO3的 M0样品在2q=20°~ 40°之间有一较宽的驼峰,是因为玻璃相具有短程有序长程无序的结构特征。M2~ M6样 品的衍射图谱与M0一样只在2q=20°~ 40°处有一较宽的驼峰,没有尖峰出现,在M6.5样品中除驼峰外,还出现了微弱的衍射峰,在M7样品中衍射峰明显增强且与CaMoO4晶体(JCPDS 85-1264)的特征衍射峰一致,说明当MoO3的掺量在6%及以下时Mo能完全溶于玻璃体中,当掺量超过6%时Mo会以CaMoO4的形式析出[19],且析出的CaMoO4晶相随掺量的增加不断增加。故判断MoO3在E玻璃中的溶解度极限为6%。
研究表明,Mo以+6的形式存在于硼硅酸盐玻璃网络中,因Mo6+的 电荷场强较高易与周围O2-配位形成[MoO4]2-四面体,从玻璃网络中脱离出来,在富碱金属(alkali metal)和碱土金属(alkali-earth metal)的解聚区富集,并与碱金属阳离子(Na+)和碱土金属阳离子(Ca2+)进行电荷补偿,以CaMoO4和Na2MoO4的形式析出[20]。样品中没有检测到Na2MoO4的特征衍射峰,是因为Na+会优先与网络结构中的[BO4]-单元进行电荷补偿,由于E玻璃中Na的含量很少,而硼的含量相对较多,所以当MoO3超出E玻璃的固溶极限时,只析出CaMoO4晶相。
2.2 红外结果分析
不同MoO3掺量样品的红外光谱如图2所示。

图2 不同MoO 3掺量样品的红外光谱图
所有样品均在486、711、1020、1411、1641 cm-1处出现明显的吸收带,它们分别对应固化体结构中不同的基团和振动模式。
497 cm-1处 的吸收带对应[AlO4]-中Al-O的振动。713 cm-1和 1417 cm-1处 的 吸 收 带 分 别 对 应 于[BO3]中B-O-B的弯曲拉伸模式和不对称拉伸模式[21]。1020 cm-1处的宽吸收带是由[SiO4]中的Si-O-Si不对称拉伸(1020~1060 cm-1)和[BO4]中的B-O-B不对称拉伸叠加而成。1641 cm-1处的吸收带是由H2O中H-O-H的弯曲拉伸引起。809 cm-1处微弱的吸收带是由CaMoO4中[MoO4]2-的不对称拉伸振动引起的[22,23],说明有CaMoO4晶相析出,这与XRD结果一致。
2.3 Raman结果分析
不同MoO3掺量样品的拉曼分析结果图谱如图3所示。

图3 不同MoO 3掺量样品的Raman谱图
在低频区和中频区分别产生了以925 cm-1和322 cm-1为中心的一个较强的散射峰和一个较弱的散射峰,它们分别对应于玻璃网络结构中[MoO4]2-的延伸振动模式和弯曲振动模式。随着MoO3掺量的增加散射峰的强度不断增加,当掺量>6%时,在877、844、792和388 cm-1处产生了较为尖锐的拉曼峰,这些峰与CaMoO4的拉曼特征峰相符[24,25]。当MoO3掺量≤6%时在925 cm-1和322 cm-1处的两个宽峰,说明在溶解度范围内时,Mo以[MoO4]2-的形式完全溶于玻璃网络结构中。当MoO3掺量>6%时产生与CaMoO4拉曼特征峰相似的尖锐峰,且峰强随掺量的增加而增加,表明当MoO3超过E玻璃固溶极限时,多余的[MoO4]2-会 与 碱 土 金 属 阳 离 子Ca2+结 合 并 以CaMoO4的形式析出。说明E玻璃对MoO3的包容量为6%与XRD分析结果一致。
由于玻璃网络结构单元Qn(Si)(n=0~4,代表桥氧原子数)与[MoO4]2-四面体的拉曼散射信号在测试过程中会发生重叠[26],所以为进一步分析Mo的加入对玻璃网络结构的影响,对750 ~1000 cm-1范围内的拉曼图谱进行反卷积如图4所示。

图4 Raman反卷积图
750 ~1000 cm-1附 近的能谱与Qn单元的对称拉伸有关,在溶解度范围内,随着MoO3掺量增加Q1占比呈上升趋势,Q2、 Q3、 Q4的占比呈下降趋势,说明玻璃网络结构的聚合度下降[27],故MoO3的加入会使玻璃网络结构发生解聚。当掺量超过溶解度极限时,Qn单元占比不断减少并出现尖峰,这是由[MoO4]2-的伸缩振动引起,说明析出了CaMoO4晶相。
2.4 DSC结果分析
图5展示了不同MoO3掺量样品的DSC曲线,通过DSC曲线对样品的玻璃化转变温度(Tg)进行确定。

图5 不同MoO 3掺量样品DSC图
由图5可以看出,当MoO3掺量≤6%时,玻璃化转变温度先升高后降低,当掺量超过6%时,玻璃化转变温度与未掺MoO3时的接近。当MoO3掺量较少时,玻璃化转变温度呈现一个上升趋势,可能是因为玻璃网络结构中的[MoO4]单元有与[BO3]、[BO4]等单元结合的倾向,使玻璃网络结构的交联度增强。随着MoO3掺量的增加,玻璃化转变温度降低,是因为MoO3的加入破坏了玻璃网状结构使玻璃发生解聚,且随掺量增加[MoO4]2-和网络修饰阳离子在解聚区汇集使解聚区变大从而使玻璃化转变温度降低。
3 结论
本文以E玻璃作为固化基体,采用熔融退火的方式得到不同MoO3掺量的固化体。对MoO3在E玻璃中的最大溶解度进行探究,得到E玻璃对MoO3的最大包容量为6%,此时玻璃化转变温度为882 ℃。通过XRD、红外及Raman探究了MoO3对玻璃网络结构的影响,随着MoO3的掺入,Q1占 比 增 加,Q2、 Q3、 Q4占比减少玻璃网络结构发生解聚,当MoO3掺量超过溶解度极限时,解聚区 的[MoO4]2-与 Ca2+结合形成CaMoO4晶体从玻璃网络结构中析出。
