一种新型拟除虫菊酯类农药半抗原的设计合成及其效果评价
2023-02-13杨星星王炳志李细清严义勇王幸幸
杨星星,付 辉*,王炳志,李细清,张 鑫,严义勇,王幸幸
(1.深圳市易瑞生物技术股份有限公司,广东深圳 518101;2.深圳市通量检测科技有限公司,广东深圳 518038)
拟除虫菊酯类农药由于其高效低毒被广泛用于蔬菜、水果、农作物、林业的害虫防治。然而,随着拟除虫菊酯类农药长期大量的使用,其原药本体及代谢物残留危害日益明显,现已引起世界各国研究者的极大关注[1-2]。目前,检测拟除虫菊酯残留最常用的方法是气相色谱法,此外,高效液相色谱法、毛细管电泳法、质谱-色谱联用技术等[3-11]也都可用于拟除虫菊酯残留的检测,但这些仪器分析法对样品基质要求高,往往需要复杂的前处理,不仅耗时费钱,而且会造成痕量拟除虫菊酯的损失;再加上这些仪器分析方法无法满足低成本、高通量、快速检测和现场检测的要求。免疫分析法由于前处理简单、使用方便等优点正好可以弥补这些不足,因此建立拟除虫菊酯的免疫检测技术具有很好的发展前景和市场潜力。
建立拟除虫菊酯免疫检测方法的关键是制备亲和力强和高灵敏度的抗体,而重点在于半抗原的设计合成。一直以来,由于对抗原抗体作用机理以及半抗原空间结构的了解不足,导致半抗原设计具有很大的盲目性,通常需要反复多次的试错尝试,耗费了大量的资金和时间。而且对于非有机合成专业的人员来说,对目标物进行有机修饰或从头合成半抗原,往往非常困难。另外,拟除虫菊酯是一类典型的手性农药,含有多个旋光异构单体,这对于能够识别手性单体的抗体而言,一种菊酯往往是多种物质的混合物,增大了免疫分析的难度。目前针对拟除虫菊酯半抗原的合成主要有全合成在苯环上衍生手臂[12-14]、在菊酯的氰基上衍生手臂,这些方法制备的半抗原手性结构会有很多种,而对半抗原进行手性分离又是非常困难的事;有的甚至只使用菊酯的部分结构[15-16],导致免疫获得的抗血清竞争不理想。为了能够有效地获得高质量拟除虫菊酯的抗体,笔者经过多次尝试成功运用拟除虫菊酯原药为原料,在不改变菊酯整体结构情况下,经过几步简单的合成,制备出与原药手性结构一样的农药半抗原单体;并对几种拟除虫菊酯的抗血清进行性能测试,能够满足一定的要求,为后续进一步研究提供参考。
1 材料与方法
1.1 试验材料
1.1.1主要试剂。氯氰菊酯、氯菊酯、氟氯氰菊酯、溴氰菊酯原药购自成都温江试剂;二甲硫醚、三苯基磷乙酸叔丁酯、无水四氢呋喃、三氟乙酸、N,N-二甲基甲酰胺(DMF)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐、N-羟基琥珀酰亚胺(NHS)、液溴购于上海安耐吉试剂公司;卵清蛋白(Ovalbumin,OVA)、牛血清蛋白(Bovine serum albumin,BSA)、弗氏佐剂购自美国Sigma 公司;羊抗小鼠IgG-HRP购自北京Solarbio生物有限公司;拟除虫菊酯类农药标准品购自北京坛墨质检;包被液、稀释液、洗涤液、封闭液、TMB 底物溶液、终止液均参考文献[17]配制。
1.1.2实验动物。Balb/c小鼠,雌性,8~9周龄,体重 20~22 g(广东省医学动物实验中心)。
1.1.3仪器。DHJF-8002 低温恒温搅拌反应浴(郑州长城科工贸有限公司);旋转蒸发仪(日本爱朗公司);酶标板自动洗涤机(美国,Bio-tech);API 3000液质联用仪(美国,AB);酶标仪(美国,Thermo);臭氧发生器(广州奥普发环保科技有限公司)。
1.2 试验方法
1.2.1半抗原的合成。称取10 mmol拟除虫菊酯原药(氯氰菊酯、氯菊酯、氟氯氰菊酯、溴氰菊酯),用30 mL二氯甲烷溶解后转移至冷阱中,在-78 ℃下通入预干燥并预冷却的臭氧6 h(臭氧通过臭氧发生器制备,产气量为20 g/h)。反应完成后通入预干燥并预冷却的氮气15 min,再加入70 mmol二甲硫醚,-78 ℃通入氮气鼓泡反应30 min后取出,蒸干溶剂,过柱纯化得无色油状物JZ-1。
将12 mmol三苯基磷乙酸叔丁酯溶于30 mL二氯甲烷,在冰水浴下通入氯气直到体系变黄绿,停止氯气(注:若是制备溴氰菊酯半抗原则是直接加入液溴),继续搅拌过夜,反应完成后旋干后无需后处理直接用,即得到JZ-2。
取4.0 mmol JZ-1再加入6.0 mmol JZ-2,用无水四氢呋喃20 mL与二氯甲烷3 mL溶解。室温搅拌反应4 h,反应完成后加适量水用乙酸乙酯萃取2~3遍,合并有机相,蒸干后过柱纯化,得到无色油状物JZ-3。
称取1.5 mmol JZ-3溶于6 mL二氯甲烷,再加入3 mL三氟乙酸,室温搅拌反应1 h,反应完成后旋蒸除去溶剂,加乙酸乙酯30 mL,用柠檬酸-柠檬酸钠饱和溶液洗涤2次,再用水洗涤2次,最后用饱和食盐水洗涤1次,有机相干燥后旋干,得白色固体即菊酯半抗原,分别编号为JZ-H1、JZ-H2、JZ-H3、JZ-H4,具体合成路线和结构见图1和表1。
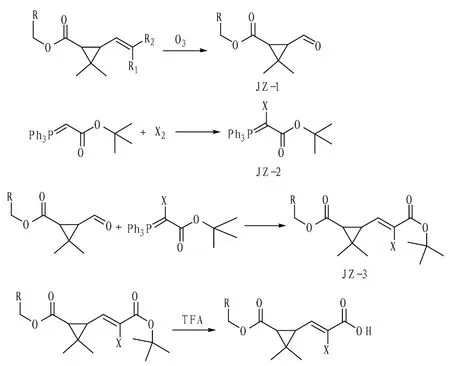
注:R1、R2为H、Cl、Br、F3C-;R为菊酯其他带有苯环结构;X为Cl、Br。 Note:R1 and R2 are H,Cl,Br and F3C-;R is pyrethroid and others have benzene ring structure;X is Cl,Br.图1 拟除虫菊酯半抗原合成路线Fig.1 Synthesis route of pyrethroid hapten

表1 4种拟除虫菊酯半抗原结构
1.2.2人工抗原的合成。采用活泼酯法将合成的拟除虫菊酯半抗原JZ-H1、JZ-H2、JZ-H3、JZ-H4分别与载体蛋白BSA 相偶联,制备菊酯人工免疫抗原。具体步骤:称取1 mmol半抗原、1.1 mmol N-羟基琥珀酰亚胺、1.2 mmol 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐,加入0.5 mL DMF溶解,在磁力搅拌下室内温度进行反应8 h。反应结束后吸取0.2 mL,缓慢滴加到3 mL 10 mg/mL 的 BSA 碳酸盐缓冲液(pH 9.6)/DMF(2∶1,v/v)混合液中,在磁力搅拌下室温反应6 h。将反应液置于透析袋内,在0.01 mol/L pH 7.4的 PBS 溶液中搅拌透析,每 4~8 h 换1 次透析液,共透析72 h。透析结束后将透析袋中的蛋白溶液分成若干等份分装于 1 mL 离心管中,分别编号JZ-H1-BSA、JZ-H2-BSA、JZ-H3-BSA、JZ-H4-BSA,于-20 ℃冰箱中存放备用。
采用混合酸酐法制备包被原,具体步骤:将1 mmol菊酯半抗原溶于 0.5 mL DMF,冰浴下,加入1.2 mmol三丁胺、1.2 mmol氯甲酸异丁酯,室温避光搅拌反应 60 min,得到的混合酸酐溶液缓慢滴加到3 mL 20 mg/mL 的 OVA PBS(0.01 mol/L,pH 7.4)/DMF(2∶1,v/v)混合液中,室温磁力搅拌反应 3 h,将反应液置于透析袋内,在0.01 mol/L pH 7.4的 PBS 溶液中搅拌透析,每 4~8 h 换1 次透析液,共透析72 h。透析结束后将透析袋中的蛋白溶液分成若干等份分装于 1 mL 离心管中,分别编号JZ-H1-OVA、JZ-H2-OVA、JZ-H3-OVA、JZ-H4-OVA,于-20 ℃冰箱中存放备用。
1.2.3抗血清制备。选取12 只8 周龄的 Balb/c 雌性小鼠分为4组,每组(编号分别为 1 号、2 号、3 号小鼠)首先是尾部采血取血清作为阴性血清,之后进行免疫,免疫4次,每次免疫间隔21 d,第4次免疫后7 d,挖眼采集血清100 μL,冰箱过夜,10 000 r/min离心 10 min,得到菊酯鼠多抗血清。
1.2.4抗血清效价和灵敏度测定。将包被原JZ-H1-OVA、JZ-H2-OVA、JZ-H3-OVA、JZ-H4-OVA用碳酸缓冲液稀释至所需浓度包被后,抗血清效价的测定采用间接非竞争 ELISA 操作程序,抗血清灵敏度的测定采用间接竞争ELISA 操作程序,具体程序参照文献[18] 。
2 结果与分析
2.1 半抗原的鉴定将“1.2.1”合成的4种拟除虫菊酯半抗原JZ-H1、JZ-H2、JZ-H3、JZ-H4采用质谱进行测定,检测在负离子模式下进行,如图2所示。从图2可以看出,这些半抗原均可得到分子离子峰 [M-H]-以及倍峰 [2M-H]-;JZ-H1分子离子峰 424.4[M-H]-,倍峰849.5 [2M-H]-;JZ-H2分子离子峰 399.4[M-H]-,倍峰799.7[2M-H]-;JZ-H3分子离子峰 442.6[M-H]-,倍峰885.5[2M-H]-;JZ-H4分子离子峰470.6[M-H]-,倍峰939.6 [2M-H]-;这些峰均与其对应化合物的分子量相符(表1),说明这些半抗原合成成功。

图2 4种拟除虫菊酯半抗原质谱图Fig.2 The MS of four pyrethroid haptens
2.2 人工抗原的鉴定将菊酯半抗原分别与载体蛋白偶联后,制备获得包被抗原和免疫抗原,通过紫外扫描获得相应的紫外吸收光谱(图3)。从图3可以看出,偶联物的紫外吸收均发生明显变化,表明半抗原与载体蛋白偶联成功。
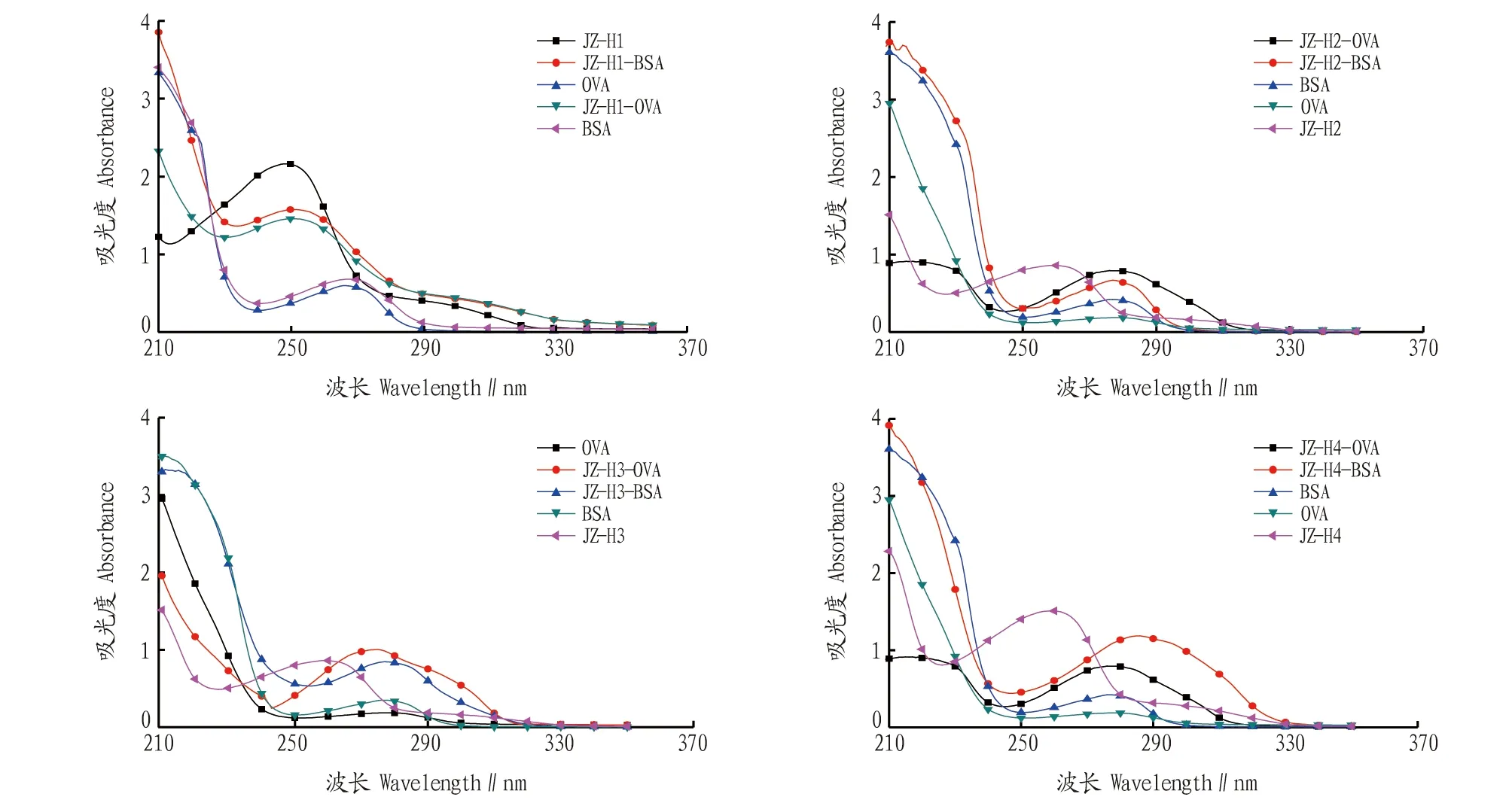
图3 免疫抗原和包被抗原紫外吸收光谱Fig.3 UV absorption spectrum of immune antigen and coating antigen
2.3 抗血清效价和灵敏度测定由间接非竞争 ELISA 法测定4种药物产生的抗血清,经过4次免疫,抗血清的效价均达到15 000倍以上(表2),说明被免疫的小鼠产生了抗体。
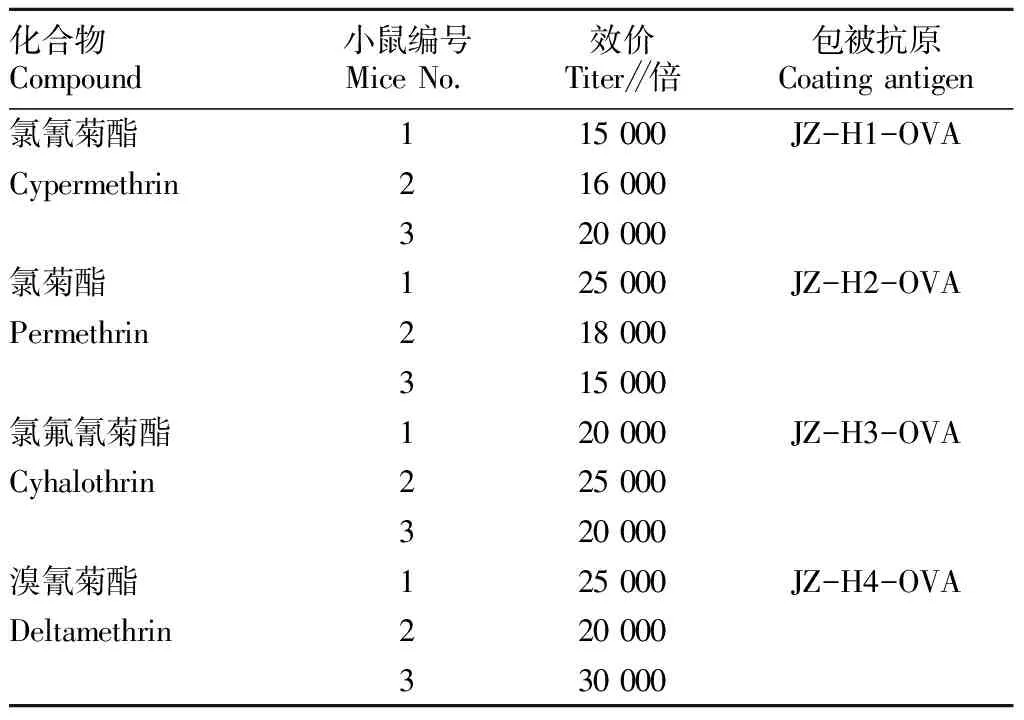
表2 各小鼠免疫效价Table 2 Immune titers of mice
在这4类药物抗血清中,每种选择效价较高的小鼠抗血清利用竞争ELISA 法进行抗体灵敏度检测。以0.2 mg/mL 浓度的JZ-H1-OVA、JZ-H2-OVA、JZ-H3-OVA、JZ-H4-OVA包被原分别包被酶标板,分别配制 0、0.000 1、0.001 0、0.100 0、1.000 0、10.000 0、100.000 0 mg/L 7个梯度的菊酯标准溶液(含 10%甲醇,pH 7.2)。每孔依次加入 50 μL 待测菊酯标准溶液、50 μL 抗血清(氯氰菊酯稀释20 000倍、氯菊酯稀释25 000倍、氟氯氰菊酯稀释25 000倍、溴氰菊酯稀释30 000倍)。间接竞争ELISA 法的抑制曲线如图4所示。从图4可以看出,4种抗血清均有竞争,随着各菊酯标准品用量的增加,抑制率会逐渐升高;在1 mg/L时除了溴氰菊酯的抑制率低于50%,其余均高于50%,这说明血清中的抗体和各菊酯发生了特异性结合反应,抗血清中存在针对菊酯的特异性抗体,直接证明了制备的各菊酯人工抗原合成成功。
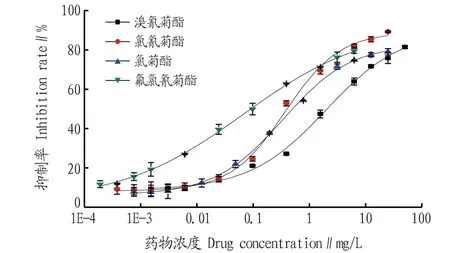
图4 各菊酯的抑制曲线Fig.4 Inhibition curve of each pyrethroid
3 讨论
有关拟除虫菊酯类农药的免疫检测已经有很多学者进行了报道,菊酯类农药免疫检测的一大难点就是设计合成其半抗原,现有研究一般采用全合成的方法进行制备,而由此带来的问题是合成的半抗原会有很多手性结构,导致免疫结果不理想,制备的抗体往往有滴度而没有竞争。 该研究首次以4种拟除虫菊酯为事例,采用原药经臭氧氧化、氯代反应、维悌希反应、水解4步化学反应合成半抗原,没有改变药物的手性结构,最大限度地保留药物本身的官能团,这样制备的抗体才能有较高的灵敏度和特异性。
