颅内脑膜瘤MR影像征象与血管周细胞瘤的鉴别诊断研究
2023-02-13王婷婷高金光
王婷婷 温 辉 高金光
武警河南省总队医院影像科,河南省郑州市 450000
颅内脑膜瘤属于一种良性肿瘤,影像学表现较为复杂,极易与血管周细胞瘤(HPC)相混淆[1]。HPC属于一种颅内血管源性恶性肿瘤,来源于脑膜间质毛细血管壁上一种变异的平滑肌细胞[2]。目前临床鉴别诊断颅内脑膜瘤与HPC主要依靠病理检测,但HPC由于内部血供丰富,术中易出血,且具有侵袭性[3]。故早期及时准确鉴别诊断脑膜瘤、HPC对患者具有重要意义。磁共振成像(MRI)是临床术前鉴别诊断良、恶性肿瘤的常用影像学手段,因具有高软组织分辨率、多方位成像、图像质量清晰等优势在临床工作中得以广泛应用[4]。鉴于此,本文通过对颅内脑膜瘤、HPC患者的临床资料进行回顾,分析两者影像学表现的差异。
1 资料与方法
1.1 一般资料 收集本院2017年12月—2020年12月收治的48例HPC患者与44例脑膜瘤患者。纳入标准:(1)均经临床确诊;(2)无MRI检查禁忌证;(3)合并头部其他疾病者;(4)影像学、临床资料完整。排除标准:(1)二次手术者;(2)孕妇、交流障碍、意识障碍等特殊人群;(3)合并脑膜炎、脑血管疾病史;(4)检查依从性极差,中途退出者。HPC组48例,男18例,女30例,年龄30~71岁,平均年龄(52.41±8.31)岁;病程1个月~3年,平均病程(19.56±4.32)个月。脑膜瘤组44例,男17例,女27例,年龄30~72岁,平均年龄(53.03±9.02)岁,病程1个月~3年,平均病程(20.12±5.14)个月。两组一般资料比较无统计学差异(P>0.05)。
1.2 方法 两组均行MRI平扫+增扫描。采用德国GE3.0T MRI扫描仪。各扫描序列参数:T1WI重复时间(TR)2 692ms,回波时间(TE)26.8ms;T2MI参数TR 5 100ms,TE 116.7ms;弥散加强成像(DWI)参数TR 5 400ms,TE 74.5ms,层厚5mm,层间距1mm。b值=0、1 000s/mm2,扫描时间99s。表观弥散系数(ADC)图由DWI图像自动生成。上述扫描序列视野(FOV)均为24cm×24cm,矩阵256×256,层厚、间距分别为5mm。动态增强:采用高压注射器注射对比剂Gd-DTPA 0.1mmol/kg体质量,注射速率2.5ml/s,随后快速推注17ml生理盐水,采用压脂VIBE序列,参数为TR 630ms,TE 9.2ms,行轴位无间断重复扫描,持续时间约37s,后行增强冠状位、矢状位、轴位T1WI扫描。
对两组MRI图像进行定性、定量分析。定性分析包括肿瘤形态、部位、有无囊变坏死、信号等特征。由两名或以上经验丰富的诊断组医师在不知病理结果下进行阅片,并获取结论。意见发生分歧时,通过协商获取最终结果。定量分析内容包括标准化T1(NT1)、T2(NT2)、ADC(NADC)及T1增强值(NCE)。各数值测量由1名放射科医师完成,并选取瘤体三个不同层面,在各个层面肿瘤实性区域选取同等大小感兴趣区(ROI)测量信号绝对值,计算均值;在同一系列半卵圆中心正常脑白质区勾画3个ROC,计算其均值。各序列标准值=肿瘤信号绝对值/正常脑白质信号值。
1.3 观察指标 (1)以病理结果为金标准,分析MRI鉴别诊断脑膜瘤、HPC的价值。(2)比较两组常规、增强MRI征象。(3)比较两组MRI定量参数。(4)比较两组水肿程度。轻度<2cm,中度:2~4cm,重度>4cm。
2 结果
2.1 MRI鉴别诊断脑膜瘤、HPC的价值 MRI鉴别诊断脑膜瘤、HPC的敏感度、特异度及准确度分别为97.92%、93.18%、95.65%,与病理检查结果一致性较高,kappa值为0.913(P<0.05)。见表1。

表1 MRI鉴别诊断脑膜瘤、HPC的价值
2.2 两组常规、MRI征象比较 HPC组分叶征、窄基底连接、骨折破坏及不均匀增强发生率均显著高于脑膜瘤组,脑膜尾征发生率低于脑膜瘤组(P<0.05)。见表2。

表2 两组常规、MRI征象比较[n(%)]
2.3 两组MRI定量参数比较 HPC组NT1值高于脑膜瘤组,NT2、NCE值均低于脑膜瘤组(P<0.05),但两组NADC值比较无明显差异(P>0.05)。见表3。
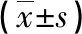
表3 两组MRI定量参数比较
2.4 两组病灶水肿程度比较 两组病灶水肿程度比较差异无统计学意义(Z=-0.399,P=0.690>0.05)。见表4。

表4 两组病灶水肿程度比较[n(%)]
3 讨论
HPC属于一种恶性疾病,侵袭性较低,影像学、临床表现与脑膜瘤存在许多相似之处,给临床鉴别诊断造成一定难度。脑膜瘤是临床上较为常见的一种良性肿瘤,但存在一定恶性潜能,据临床资料显示,脑膜瘤经治疗后3%~91%会出现复发[5]。HPC与脑膜瘤治疗手段与预后亦存在一定差别,因此术前明确诊断对患者非常重要。MRI是临床辅助检查手段之一,具有高软组织分辨率、多方位扫描等优势,在肿瘤鉴别、分级中具有重要作用。李成博等[6]发现,MRI鉴别诊断颅内肿瘤的敏感性、特异性可达90%以上。本研究与上述报道相符,与病理结果作为对照,kappa值为0.913。说明MRI可有效鉴别诊断HPC、脑膜瘤,与病理检查具有良好的一致性。
本研究通过对比HPC、脑膜瘤MRI征象发现,HPC组分叶征、窄基底连接、骨折破坏及不均匀增强发生率较脑膜瘤组高,而脑膜尾征比例低于脑膜瘤组。两组血管流空影、囊变坏死及水肿程度情况比较无统计学差异。表明HPC与脑膜瘤在血管流空影、囊变坏死、水肿等方面相似度较高,而分叶征、窄基底连接、骨折破坏及不均匀增强可能作为鉴别诊断HPC、脑膜瘤的重要征象。(1)窄基底连接。HPC生长速度较快,与周围脑膜作用时间较短,因此大多数HPC有窄基底连接特征[7]。而脑膜瘤与硬脑膜存在密切关系,大部分为宽基底连接[8]。(2)脑膜尾征。肿瘤出现脑膜尾征主要是因为肿瘤细胞长时间浸润,导致血管异常增生、静脉回流受阻等病理行改变,或大量肿瘤细胞在纤维结缔组织聚集。脑膜瘤生长时会侵犯周围硬脑膜,而HPC生长速度快,病程短,对硬脑膜作用的时间较短,故未出现脑膜尾征。单个MRI征象虽在HPC、脑膜瘤患者中均有出现,但多个MRI征象同时存在时,有助于提高鉴别诊断价值。但叶爱华等人[9]发现,HPC、脑膜瘤血管流空影、囊变坏死发生率比较有明显差异,与本研究不符,分析其原因,可能与患者自身、操作者技术、纳入样本量等因素有关。
Leehi等人[10]指出,人体正常脑白质的T1、T2值存在一定差异,故需采用NT1、NT2值。HPC实性部分多为等T1、T2信号,部分T2信号较低,推测可能与肿瘤细胞紧密排列,胞浆少,且细胞间质内含丰富网状纤维有关。本研究结果显示,两组NT1、NT2值比较差异显著,且HPC组NCE值低于脑膜瘤组,分析其原因,可能是因为脑膜瘤内含海绵状血管成分,血窦多,血流较慢,增强扫描峰值时间长,NCE值较高;而HPC血供丰富,增强扫描呈一过性强化,峰值时间短,NCE值相对较低。
综上所述,MRI在鉴别诊断颅内脑膜瘤与HPC上与病理结果具有良好一致性,且两者MRI征象具有特异性,有助于为临床鉴别诊断脑膜瘤、HPC提供可靠指导意见。
