阿魏酸钠经RhoA和Rho-kinase信号通路抑制小鼠肝纤维化的机制研究*
2023-02-13赵蔚林
赵蔚林 李 君
湘潭医卫职业技术学院,湖南省湘潭市 411102
肝纤维化(Hepatic fibrosis)是肝脏受到损伤后,产生的一种持续存在状态。其是肝脏组织开始修复时,如果细胞外基质(Extracellular matrix,ECM)的合成与降解平衡状态发生失衡,从而导致肝脏出现的一系列病理学改变[1-2]。当机体发生肝纤维化时,如不及早进行干预治疗,将发展为肝硬化,甚至肝癌。现阶段肝硬化、肝癌是我们国家常见病、多发病及重要的死亡原因,其病理主要特征为肝组织呈现弥漫性纤维化、假小叶及再生结节形成[3]。
据目前研究发现肝纤维化的典型特征为肝星状细胞(Hepatic stellate cell,HSC)活化和ECM沉积[4],分子机制涉及到炎症因子、生长因子、趋化因子和氧化应激相关分子等,因此,深入研究肝脏纤维化的发病机制,并由此基础上探索新的治疗靶点,在减少肝硬化和肝癌的发生尤为重要。
阿魏酸钠(化学名称:3-甲氧基-4-羟基桂皮酸钠盐二水合物)系阿魏、川芎、当归等中药提取物中的单体活性成分经化学修饰所得。现代药理学研究表明,其具有抗氧化、抗凝、抗炎、改善血液流变学等功效,现临床上广泛运用于心血管系统疾病的治疗[5]。但据最新研究报道,发现阿魏酸钠具有抑制肝纤维化的功效,但具体作用机制现阶段尚不明确[6]。本研究将以信号通道为切入点,构建以CCl4-花生油诱导肝纤维化模型,通过阿魏酸钠治疗的肝纤维化小鼠为研究对象,探讨阿魏酸钠抑制肝纤维化的分子作用机制,从而为临床治疗肝纤维化提供一种新的途径。
1 材料与方法
1.1 材料 (1)动物:雄性CL小鼠60只,体质量160~210g(中南大学湘雅医学院),实验动物编号:SYXK(湘)2015-0014。饲养条件:温度25℃,湿度(55±10)%,给予标准的食物和水。(2)主要试剂及仪器:阿魏酸钠(成都嘉叶生物科技有限公司,纯度:98%)。CCl4购于江苏清泉化学股份有限公司(批号20210901);花生油购于青岛吴昊植物油有限公司。透明质酸(HA)、层黏蛋白(LN)、Ⅲ型前胶原肽(PⅢP)和Ⅳ型胶原(CⅣ)试剂盒,BCA蛋白浓度测定、苯甲基磺酰氟(PMSF)蛋白酶抑制剂试剂盒均购自上海透景生命科技股份有限公司;兔多克隆RhoA抗体、小鼠单克隆α-SMA 抗体购于湖南纯清生物科技有限公司。兔多克隆eNOS 抗体、ROCK抗体购自广东椰泰生物科技有限公司。DAB试剂盒购于山东滨州智源生物科技有限公司。
1.2 实验方法
1.2.1 小鼠肝纤维化模型建立:适应性饲养1周后,将小鼠依据随机数字表法分成正常对照组、模型组、给药组,每组20只。模型组和对照组小鼠均灌胃给予 CCl4-花生油(1∶1,V/V)1ml/kg灌胃,1次/d,连续8周。从第9周开始,给药组各小鼠给予阿魏酸钠20mg/kg灌胃,1次/d,连续给药4周。
1.2.2 小鼠肝脏标本制作:12周后,将小鼠分别称重,并按照50mg/kg剂量戊巴比妥钠,分别进行麻醉,于腹主动脉处取血,并分离,留取血清;同时制作各组肝脏组织标本,逐个称肝重并记录,然后用剪刀在各小鼠的肝脏相同部位剪取组织标本,置于福尔马林溶液中固定,剩余肝组织迅速置于-80℃冰箱中冰冻并留存[7]。
1.2.3 肝组织影像学检测:对实验小鼠最后一次给予阿魏酸钠灌胃后,当即随机从各组中抽取5只小鼠,分别对其进行肝脏超声检测。对被检测小鼠,予以禁食、不禁水8h,并按照体重,腹腔内分别注射戊巴比妥钠(给药剂量:50mg/kg),以麻醉小鼠,完善小鼠肝区体毛剃除,充分暴露肝脏体表投影区域,将其仰卧位固定于试验平板,采用飞利浦Affiniti 70彩色多普勒超声诊断仪,并采用其配备弹性成像定量软件包及eL18-4铂净线阵探头(频率:4~18MHz)。扫描小鼠肝脏,检测肝脏大小、形态、软硬度等指标,得到二维均值。
1.2.4 肝功能及肝纤维化指标检测:采集各组试验小鼠血清,运用全自动生化仪,对血清中天门冬氨酸氨基转移酶(Aspartate aminotransferase, AST)、谷氨酸氨基转移酶(Alanine aminotransfease,ALT)的表达情况进行检测[8]。运用全自动化学发光免疫检测仪,分别对小鼠血清标本中肝纤维化指标:透明质酸(HA)、Ⅳ型胶原(CⅣ)、Ⅲ型前胶原肽(PⅢP)和层黏蛋白(LN)的含量进行检测,并分别记录[3]。
1.2.5 肝脏组织病理学检测:分别对各试验组小鼠的肝脏组织,采用4%多聚甲醛溶液进行固定48h以上,并常规使用石蜡包埋,制作成5μm厚度的组织切片,对其分别予以HE和Masson三色染色,在光学显微镜下观察各试验组小鼠肝脏组织的病理染色情况[3]。并严格按照2000年中华医学会传染病与寄生虫病学分会、肝病学分会一起联合制定的《病毒性肝炎防治方案》中,对肝脏组织结构破坏类型、范围及程度,将对肝微循环影响的大小将肝纤维化划分为1~4期(S1~4)[9],见表1 。对各小鼠肝组织切片,在显微镜下拍照,并按照分组及病理变化分类。

表1 肝纤维化分期
1.2.6 肝组织免疫组化检测:将各组小鼠肝组织切片置放玻片上,使用二甲苯Ⅰ、Ⅱ中10min浸泡,使其充分脱蜡;各组织乙醇浸泡6min,然后流水15min浸洗,再将载玻片置于PBS玻片缸,摇床上晃动并洗涤6min×3次;在室温、严格避光的环境下,予3% H2O2以20min孵育,再PBS洗涤6min×3次;滴加入5%BSA溶液,并采用室温条件下封闭30min,倾除多余溶液。
1.2.6.1 肝脏组织中RhoA呈现情况:对兔来源抗RhoA,使用PBS对其1∶300比例进行充分稀释,滴50~100μl至切片,在10℃冰箱中孵育12h;取出后室温下静置2h,PBS反复洗涤10min×4次,再切片放至苏木素染液中,染色15s后,使用流水浸洗10min,用普通显微镜观察细胞核着蓝色,予以二甲苯Ⅰ、Ⅱ分别再浸泡处理20min;制作好的切片置于通风橱中,充分通风20min,使其晾干,滴加中性树胶,并采用玻片覆盖,再次晾干;使用电子显微镜观察各组小鼠肝脏组织病理结构改变,逐个摄片及保存。
1.2.6.2 肝脏组织中Rho-kinase的表达:小鼠肝组织滴加山羊血清封闭液,放置于湿盒中,在室温条件下孵育15min。在切片上滴加RhoA,Rho-kinase抗体4℃冰箱条件下过夜;再室温情况静置3h,PBS反复洗涤各组切片10min×4次。分组滴加生物素标记二抗工作液,室温下孵育20min,PBS充分洗涤15min×3次;洗涤后采用DAB显色,并苏木素染核,染色成果后逐一封片。
1.2.6.3 RhoA,Rho-kinase阳性表现情况:肝细胞细胞质中出现棕褐色或棕黄色颗粒。光学高倍镜下,每张切片上随机至少抽取8个完整并相互不重叠视野,使用Image-Pro Plus 6.0软件测定每个视野下阳性反应的IOD值,统计分析使用SPSS22.0软件。
2 结果
2.1 小鼠状态 建模8周后,正常对照组的小鼠进食正常,对外界刺激反应灵敏;肝脏外观色泽饱满,边缘锐利,表面光滑,呈现正常肝脏形态。模型组、给药组小鼠均对外界刺激反应迟钝,欠活泼,进食量明显减少。建模期间,模型组、给药组分别死亡2只。
2.2 肝组织影像学检测
2.2.1 二维超声模式:采用二维超声模式分别对各组小鼠肝脏的形态结构、回声改变等进行逐一检测,结果见图1。结果提示,正常对照组小鼠肝脏表面光滑,肝实质回声均匀,弥漫性细颗粒状,肝内胆管系统结构清晰。而模型组小鼠肝脏表面欠光滑,呈现出小结节样改变,肝内回声增粗、变强,肝内胆管系统结构混乱,难以鉴别。而经过阿魏酸钠干预后,给药组小鼠肝脏表面见光滑,肝脏组织实质回声改变均较模型组有明显减轻。
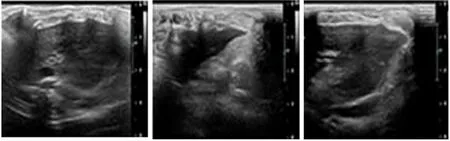
正常对照组 模型组 给药组
2.2.2 超声弹性成像模式:在超声弹性成像技术下,各试验组小鼠肝脏组织超声弹性成像技术下改变情况见图2。正常对照组小鼠肝脏主要为绿色,少部分呈现蓝色,其中红色部分系肝叶组织间隙和肝内管道结构。模型组小鼠肝脏中主要呈现大量蓝色,绿色和红色占比少,而经阿魏酸钠干预后的给药组,其蓝色比模型组显著减少,趋近正常对照组影像。

正常对照组 模型组 给药组
2.3 肝脏硬度值 与正常对照组和给药组比较,模型组小鼠肝脏的硬度值均明显增强。对比试验结果,得出经阿魏酸钠干预后,小鼠肝纤维化程度可有明显减轻。结果见表2。

表2 各组小鼠肝脏硬度值对比
2.4 肝功能检测和肝纤维化指标 模型组小鼠肝功能指标(AST、ALT)对比正常对照组明显升高(P<0.05);阿魏酸钠给药后可见降低(P<0.05)。模型组小鼠4项肝纤维化指标对比正常对照组(PⅢP、HA、CⅣ和LN)有显著升高(P<0.05)。结果见表3。

表3 各组小鼠肝功能和肝纤维化指标
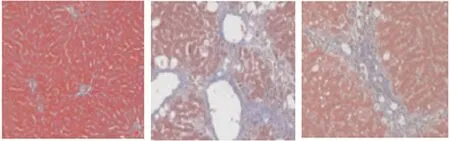
2.5 肝脏组织病理学染色 小鼠肝脏组织HE染色和Masson三色染色结果表明,正常对照组肝脏组织结构有序正常,肝小叶结构清晰,没有出现纤维结缔组织增生和脂肪变性、坏死现象,是正常肝脏病理形态。模型组发现小鼠肝脏组织中出现大量肝细胞坏死现象,肝汇管区、肝小叶及肝窦结构表现出严重紊乱,可见显著纤维结缔组织增生,并可见胶原物质沉积。给药组肝纤维化明显有改善,胶原物质沉积较模型组明显减轻。结果见图3、图4。
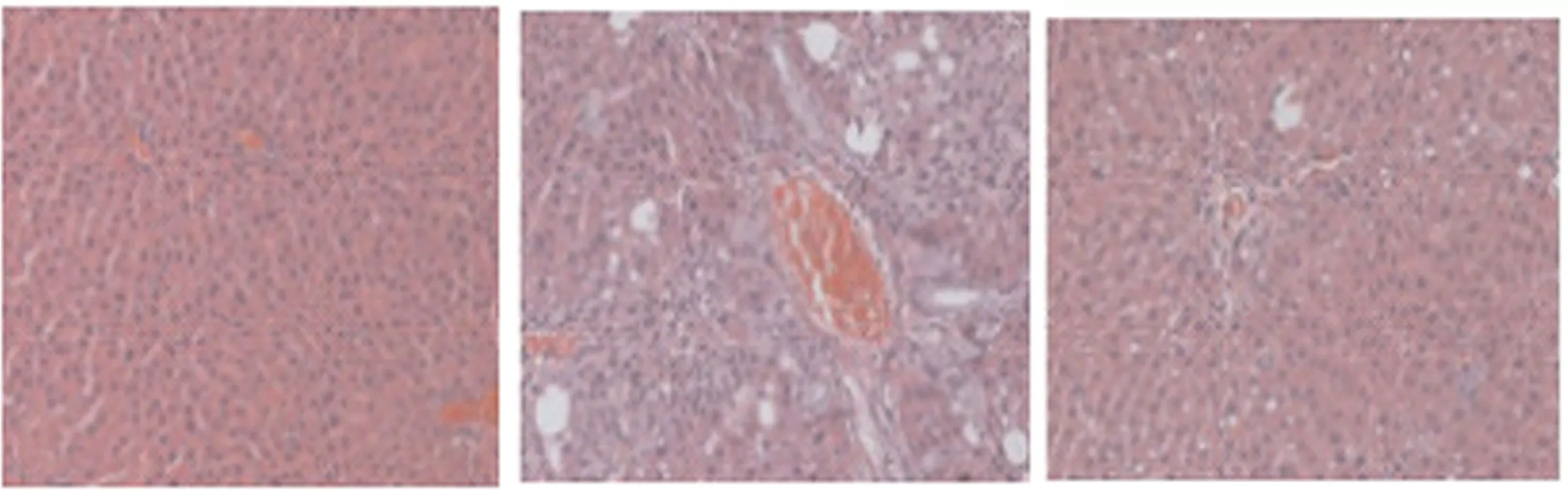
正常对照组 模型组 给药组
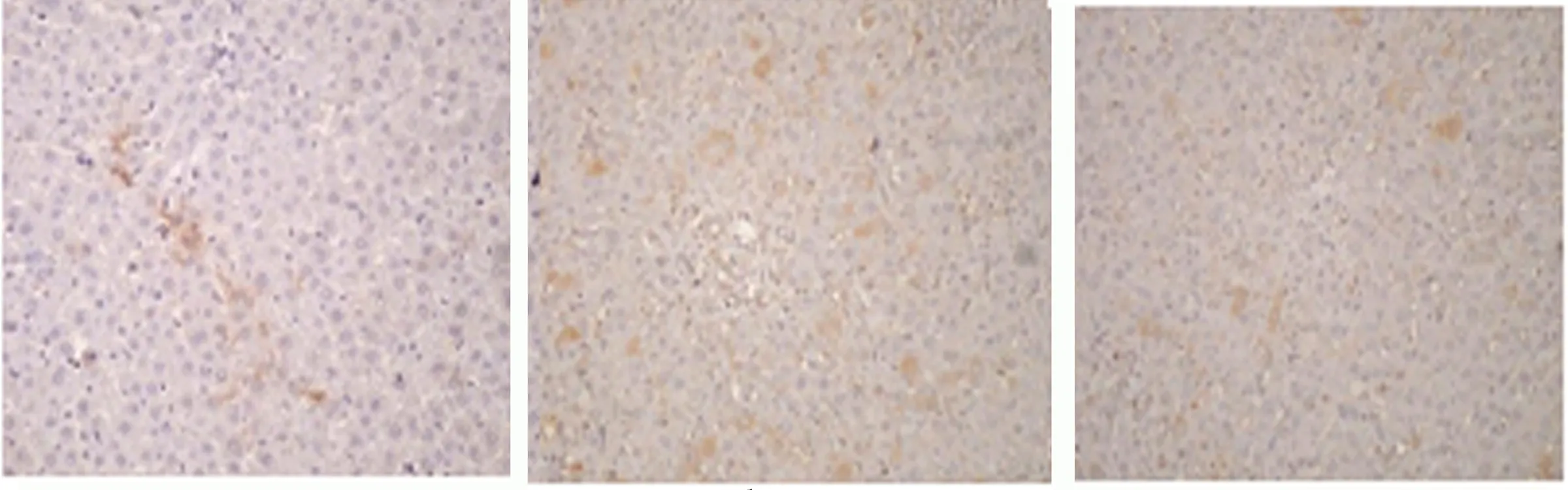
2.6 小鼠肝脏组织内RhoA、Rho-kinase的含量 模型组小鼠肝脏组织内RhoA表达均高于其他两组。采用阿魏酸钠干预后,肝硬化小鼠肝脏RhoA的表达见降低(P<0.05),见图5。阿魏酸钠干预后,模型组小鼠肝脏Rho-kinase的含量见减低(P<0.05),见图6。
正常对照组 模型组 给药组
3 讨论
CCl4系一种常见的具有选择性肝毒性化学物质,其通过活化HSC,达到诱导肝脏正常组织向纤维化转变进程[10]。现研究发现,各种类型肝脏损害常常呈现出肝纤维化这一共同病理征象[11],其是一种早期并且具有可逆的肝脏损害,如临床上能及早干预,常能表现出一定的修复潜力[12]。因此,早期预防和及早干预是阻止肝纤维化进程的关键[13],但研究发现肝纤维化的发病机制异常复杂,且多种细胞、细胞因子等参与疾病进程,因此探索研究抑制肝纤维化进程,并能使其减退的抗纤维化药物具有极高价值[13]。本研究显示阿魏酸钠能够有效抑制小鼠肝脏组织纤维化,其影像学指标(形态结构、回声改变、弹性、硬度)、肝功能指标(AST、ALT)和肝纤维化指标(HA、LN、CⅣ、PⅢP),并结合其肝脏组织病理学检查,发现阿魏酸钠治疗下,能够有效改善小鼠肝脏纤维化变程度以及胶原沉积范围;联合免疫组化检测下肝脏组织中RhoA,Rho-kinase的含量,发现模型组RhoA及Rho-kinase水平都明显高于正常对照组和给药组,因此能较为全面地证明阿魏酸钠具有保护肝脏组织和抑制肝纤维化的作用。RhoA和Rho-kinase体现为活化的HSC中表达[14],并参与HSCs激活及肝脏纤维化进展,该信号通道通过调节血管平滑肌的舒张及收缩,从而发挥促进HSC活化的作用,并导致肝细胞外基质出现过度纤维化增生[15]。只有活化状态RhoA(GTP-RhoA)才能发挥激活Rho-kinase并诱发其下游效应。RhoA和Rho-kinase含量的显著减少,提示由RhoA活化并引起的下游效应受到抑制。GGPP为RhoA起活化的重要因素[16],阿魏酸钠极有可能通过抑制GGPP生产,从而抑制RhoA和Rho-kinase通路的激活[17]。

正常对照组 模型组 给药组


正常对照组 模型组 给药组
综上所述,本研究不仅证实了阿魏酸钠对CCl4-花生油诱导的小鼠肝纤维化具有抑制作用,而且通过分子生物学手段研究发现,阿魏酸钠发挥抗肝纤维化作用的机制可能是通过抑制RhoA和Rho-kinase信号通路的激活,降低GGPP、α-SMA、α-SMA、ROCK、eNOS、Colla-genI、Colla-genⅢ的表达[18],调节TIMP/MMP的平衡,抑制HSCs的激活,降低ECM的合成来发挥作用的。
