肌电与血氧信号同步采集系统设计与实验研究
2023-02-12臧梦洁邢丽冬钱志余姚柳叶
【作 者】 臧梦洁,邢丽冬,钱志余,姚柳叶
南京航空航天大学 自动化学院,南京市,210016
0 引言
运动疲劳防治是运动人体科学研究领域的热点,肌肉疲劳的现象主要涉及神经性和代谢性的生理因素[1]。从神经系统看,肌肉在逐渐疲劳时,动作电位发生变化,导致sEMG变化。从生理代谢看,肌肉中血管活性增强,局部组织内血氧的消耗量变大,会使组织中血氧含量减少到另一个平衡点,监测肌肉组织的缺氧程度可用来判断肌肉疲劳程度[2-3]。
目前已有针对肌肉疲劳时sEMG与近红外信号特征的变化规律的相关研究。1923年,COBB和FORBES证实在肌肉静态收缩刺激下,肌电信号的幅值有明显增加的趋势。1962年,KOGI和HAKAMADA首次实验证实肌肉疲劳过程中肌电信号的功率谱向低频方向移动[4]。1981年STULEN等[5]研究肌肉疲劳过程频率特征对于肌电传导速度(conduction velocity,CV)的影响,发现频谱的低频与高频分量的比值对CV值更为敏感,中值频率在噪声的影响下表现出较强的鲁棒性。2016年谭启涛等[1]借助近红外光谱技术观测左腿外侧腓肠肌的血氧波动,发现疲劳状态下肌源生理代谢活动加强,从而导致组织对血氧量的需求增加。
当前研究主要基于单元信号,但采集的信号较为单一,无法全面反映肌肉疲劳过程中内在的物理参数的变化特点。多通道多元信号融合实现多维度分析肌肉疲劳的研究较少。我们设计了一种软硬件结合的肌电与血氧同步采集系统,实时采集目标肌群疲劳过程中的sEMG与血氧信号,并通过提取变化较为明显的特征参数进行分析,为后续对目标肌肉群的实时定量的肌肉疲劳评估奠定基础。
1 sEMG分析方法
根据相关研究结论,肌肉在发生疲劳的过程中,由于肌肉纤维中的运动单元(motor unit,MU)的同步化程度加强并在时空上叠加,使得sEMG幅值明显增大。同时高频单元的活性降低,低频单元的活性被激发,表现为频谱特征的左移[6-7]。下面利用这两种维度特征交叉分析系统所采集到的肌电信号进行研究。
1.1 时域分析
相较于空间维度,时域分析以时变函数的方式反映肌电信号在时间维度的变化,得到该信号的数学统计特性。肌电信号经预处理后常用的时域特征有均方根值(root mean square,RMS)和积分肌电值(integrated electromyography,iEMG)。
RMS的计算公式:
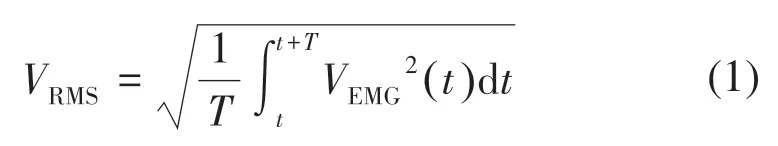
iEMG的计算公式:
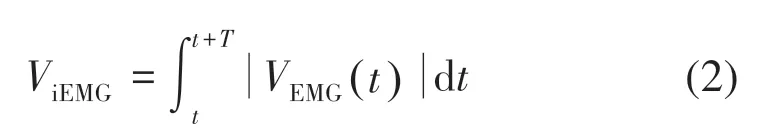
式中:T为选取的信号窗内帧数长度;VEMG(t)为t时刻采样的sEMG的幅值。
1.2 频域分析
通过频域分析可以反映全局频率特征、能量分布以及运动单元被募集的情况[7]。常用的频率特征参数计算包括信号的平均功率频率(mean power frequency,MPF)、中值频率(media frequency,MF)等。
MPF的计算式:
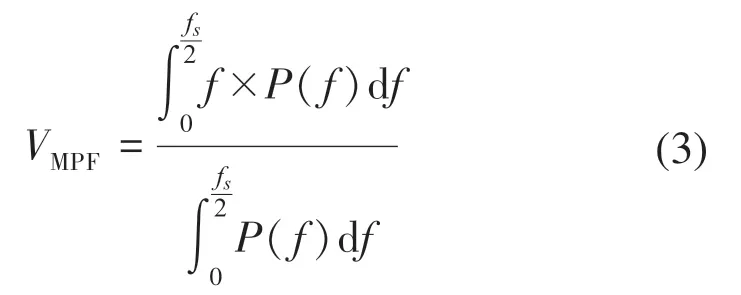
MF的计算式:
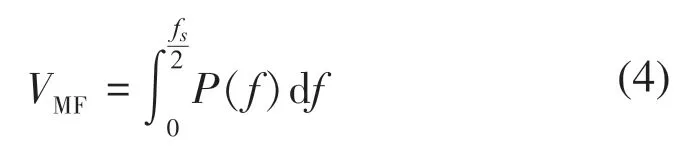
式中:f为信号的频率;fs为信号的采样率;P(f)为功率谱密度函数。
2 血氧检测原理
本系统根据氧合血红蛋白(oxyhemoglobin,HbO2)和脱氧血红蛋白(deoxyhemoglobin,Hb)在600~900 nm波段的 光窗口 有不同的吸收特征,以朗伯-比尔定理为理论基础[8],朗伯-比尔定律公式可表示为:
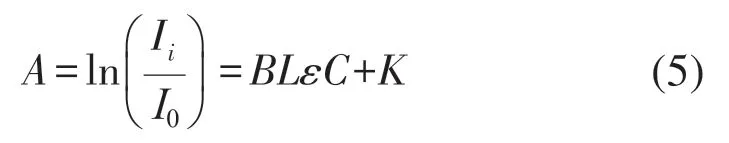
式中:A为光密度;Ii、I0分别为光源入射光强和出射光强;C为待测物质浓度,单位为mol/L。L为光穿过组织的路径长度;B为差分路径因子(differential pathlength factor,DPF),用来描述光子实际传播的路径与L的数学关系;ε为待测成分的摩尔吸光系数,单位为mM-1cm-1;K为光子散射过程产生的耗散常量。
双波长血氧检测模型如图1所示:双波长(735 nm/850 nm)LED光源发出的近红外光Ne和红光Re,a和b为到光源距离不同的两个光电传感器。光子穿透由皮肤、皮下组织等多组分混合体系后由光电传感器 a和b接收。
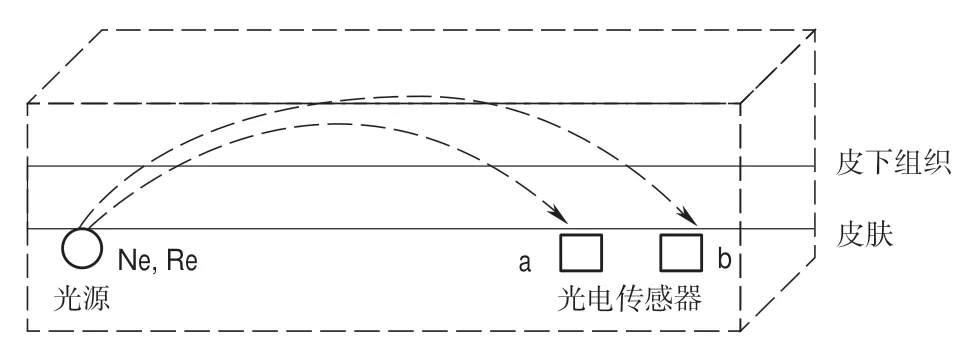
图1 双波长血氧检测模型Fig.1 Dual wavelength blood oxygen detection model
由于光子在传播的过程中引起的损失K无法直接计算,因而考虑计算组织血氧浓度的相对变化。具体计算式如下[9-10]:
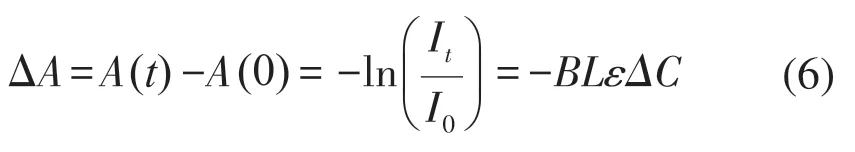
在调整双波长光源的发射光强度后,A(0)表示肌肉组织在静息状态下探测器采集到的光强度;A(t)表示肌肉状态改变后探测器采集到的光强度;ΔC表示t时刻吸收物质的浓度变化;ΔA表示t时刻光密度的变化。对于本系统所使用的光电传感器,光密度的变化与所采集的电压成正比,因此ΔA可由电压值反映,计算式如下:
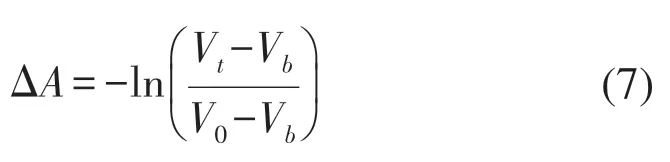
式中:V0代表初始状态下的电压值;Vt代表t时刻的电压值;Vb为暗电压值。
在双波长血氧检测模型中每一种波长对应光密度变化量的具体式如下:

虽然式(8)中L的值会引起差分路径因子B的变化,但是根据已有的研究表明当L大于一定值(2.5 cm)后,B值会趋于稳定不变[11]。依据现有研究的结果,并结合插值法确定符合本系统的B值,式(8)中的摩尔吸光系数ε也可由文献查阅得到[12-13],至此就可以定量地计算组织中两种血红蛋白的浓度相对变化,计算式如下:
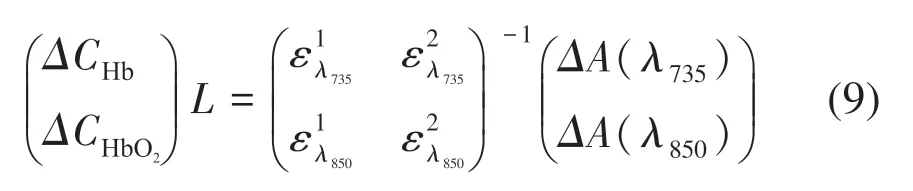
3 系统硬件设计
sEMG-NIRS采集系统硬件架构如图2所示。系统采集端主要包括两个模块:①sEMG采集模块:前端凝胶电极采集前臂原始的sEMG,经过调理电路之后,由微处理器进行处理。微处理器对信号调理电路输出的信号进行平滑和软件滤波处理,从而得到污染较小的信号;②肌肉血氧采集模块:光电探头中的光电传感器接收到从人体组织内部吸收之后散射出来的光信号,并将该信号转换成电信号,经放大滤波、分离后由STM32处理。
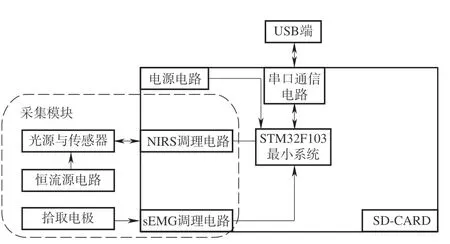
图2 sEMG-NIRS采集系统硬件设计框架Fig.2 sEMG-NIRS acquisition system hardware design block framework
3.1 sEMG采集电极选取
sEMG的幅值在微伏级别[14],信号频率为10~500 Hz,其中50~150 Hz能量较高[15-16]。需要考虑探头在使用的过程中如何减小伪迹,另外导联线的选择应满足有一定的抗干扰和屏蔽作用。我们选用Ag/AgCl凝胶电极,相比于针电极,凝胶电极具有无创、使用方便等特点适用于受试者在运动情况下采集sEMG。采用三点式放置电极,其中两个作为sEMG的差分输入端,另一个电极接地保护以提高信号采集的准确性。
3.2 信号处理电路设计
信号处理电路在sEMG传感器模块中至关重要,根据sEMG在傅里叶变换之后的频谱分布特点,该信号调理电路设计如图3所示,主要由双输入单输出的差分放大电路、RC低通滤波、高通滤波以及次级放大器4个部分组成。由于差分模拟输入电路的设计对sEMG的品质的影响非常大,为实现输入端的阻抗趋近于无穷大同时对于共模信号表现出较为出色的抑制效果,本系统选用INA128集成芯片。另外由于在工作时芯片自身会存在射频整流,其产生的射频干扰(radio frequency interference,RFI)会使采集到的sEMG混有直流输出失调误差。因而在INA128的前端放置RC低通滤波器进行射频滤波。其截止频率计算式如下:
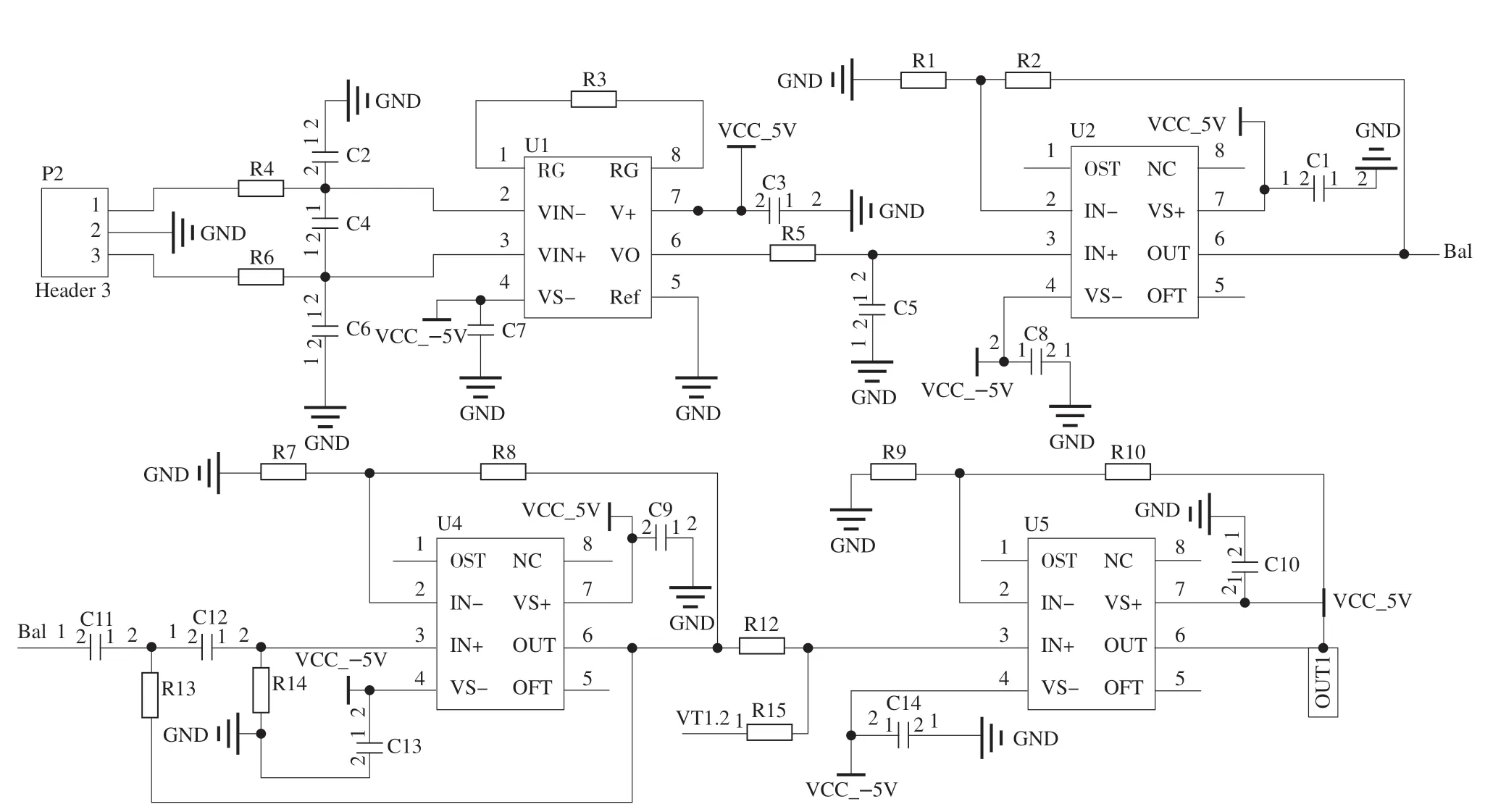
图3 sEMG信号调理电路Fig.3 sEMG signal conditioning circuit
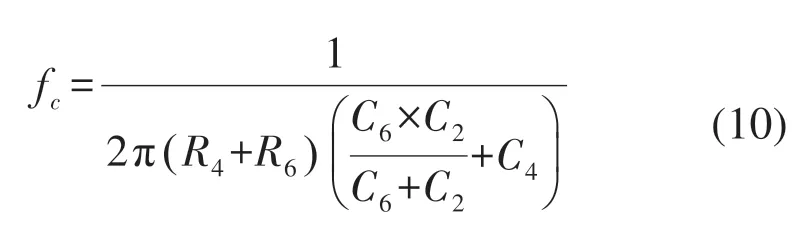
为满足采样信号既有合适的电压增益又不会因正反馈过强而产生自激振荡,因而设计由C11、C12、R13以及R14组成的压控电压源二阶RC高通滤波器。最后经OPA604集成运放芯片组成的同相加法电路实现输出电压信号的抬升从而能更加准确地被微处理器采集并进行后续处理。
3.3 近红外光源驱动电路设计
为保证发射近红外光源有稳定的发光功率,采用具有恒流输出功能的集成芯片进行驱动,并且设计恒流源电路以满足其特定的工作需求。电路输出的驱动电流大小可通过外接电阻R3调节,电容C2的作用为抑制高次谐波干扰。另外,为确保输入与输出电压幅值相同,增加外接电阻R1以减弱模拟开关通道开通期间阻抗分压的影响。使用微处理器的定时器功能产生具有恒定相位差和频率的PWM波分时控制模拟开关芯片MAX323的导通和关断进而使得双波长LED以恒定频率交替工作,设计的恒流源驱动电路如图4所示。
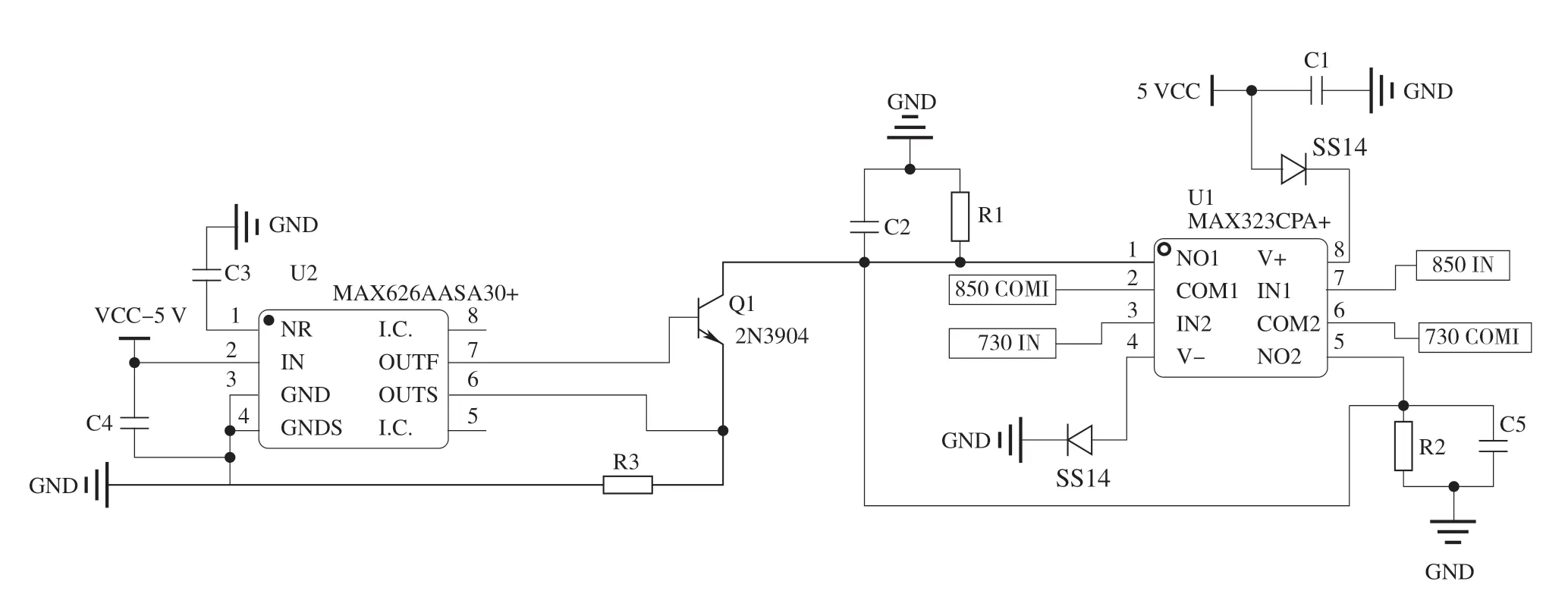
图4 恒流源驱动电路Fig.4 Constant current source drive circuit diagram
3.4 柔性探头设计
依据蒙特卡罗仿真(Monte-Carlo simulation,MC)模拟光子散射的路径结果[17],光子通过多次散射而返回到组织表面,在人体组织中传播的路径近似为月牙形态。因而在与光源同平面的另一个位置安放信号接收器,则一定能够探测到经过散射后的光子。若要达到采集到深层肌肉的血氧变化信息的目的,传感器与光源发射极的最大距离一般在4 cm[18]。图5所示是前置探头的布局图,系统选择发射极到光电传感器间距分别为3 cm和4 cm,光电传感器之间的间距为1 cm,通过测试当肌肉收缩时这两处位置均能准确地探测到信号强度的改变。
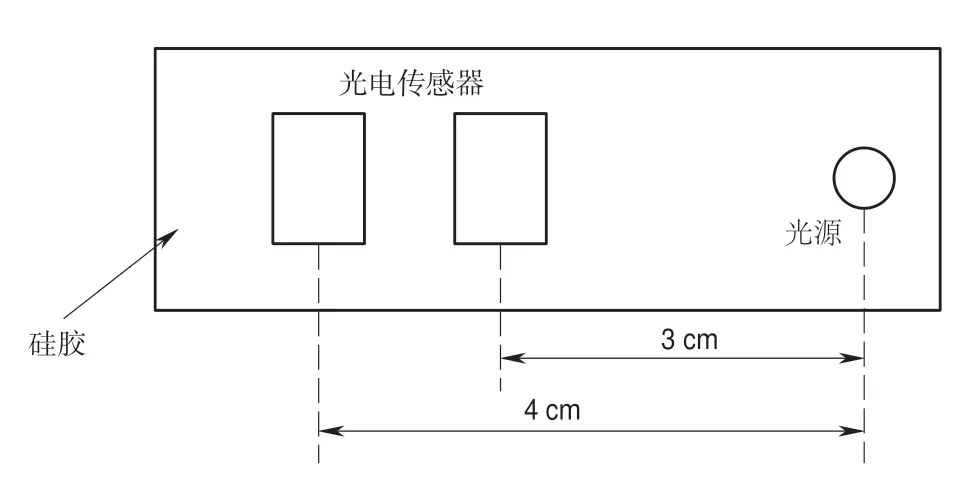
图5 柔性探头布局Fig.5 Flexible probe layout
3.5 信号调理电路
信号调理电路系统框架如图6所示,主要由时序开关电路、前级放大、滤波电路这三部分组成。前端探头上的每个传感器接收的光电信号经过双路模拟开关MAX323组成的时序开关电路后将混叠的两波长电压信号以与光源相同的驱动频率切分开变为两路信号,因此整个调理模块存在4个独立的放大滤波电路对切分后的电压信号分别进行处理。
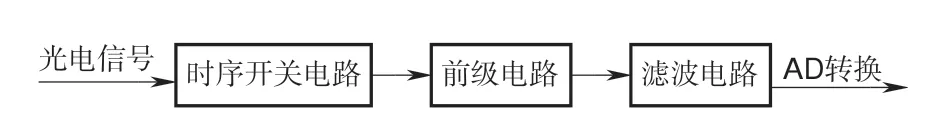
图6 信号调理电路系统框架Fig.6 Signal processing circuit system framework
4 系统软件设计
硬件采集平台所采到肌电以及血氧信号由STM32的AD功能模数转换后再计算相应值。系统为了并行完成多个任务,包括分时驱动模拟开关、ADC采集、数据计算、数据通信以及存储,同时方便设置每个任务的优先级,采用 uC/OS-III实时操作系统,它具有可剥夺多任务管理,极短的关中断时间以及直接向任务发送信号等优点,可对微处理器中的各项任务进行高效的资源管理。系统软件运行流程如图7所示。
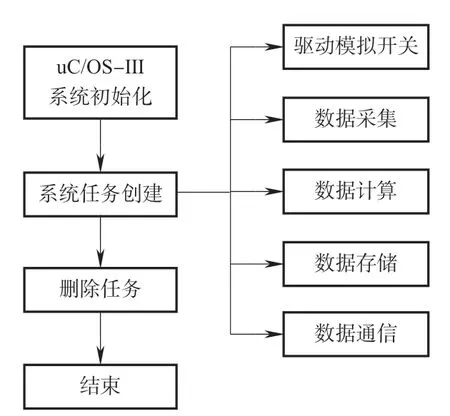
图7 系统软件流程Fig.7 System software flow
STM32启动之后,系统对 uC/OS-III 进行初始化,完成对各个参数初始化配置、内存空间的分配,接着创建系统任务,在系统任务中创建分时驱动模拟开关任务、数据采集任务、数据通信任务等。待每个任务创建完毕,根据某一任务对数据实时性准确性的要求以及CPU对任务的执行周期,为该任务设置不同的优先级并为每个任务配置所需的堆栈空间。当所有任务创建完毕时,启动操作系统从而保证各部分有序执行,最后释放存储块删除开始任务。
5 实验验证
5.1 等长收缩下局部肌肉疲劳实验
本研究选取人体右臂肱桡肌中部进行实验,实验对象在温度恒定的实验室内静坐5 min,将人体状态调整至平静适宜的状态。使用医用酒精棉将实验对象右前臂肱桡肌位置擦净,去除皮肤上的灰尘角质等,保证表面肌电极与受试者皮肤之间有效的接触。使用5 kg哑铃加速肌肉疲劳的进程。首先采集在无负重状态下3 s的数据,随后观察者将哑铃放于实验对象手中,保持90e静态等长收缩状态,采集过程实验对象恒力保持25 s后结束,重复以上实验。
取结束6 s之前的数据对信号经过小波软阈值降噪预处理,分别提取时域特征参数RMS、iEMG,以及频域特征参数MPF结果,如图8所示。研究发现,随着肌肉负重时间的持续,sEMG的时域特征参数RMS、iEMG有增大的趋势,而频域特征参数呈现相反的变化,即频谱发生了左移。这说明sEMG与肌肉疲劳有很强的相关性,与现有的研究结论相吻合,同时也表明本系统中的sEMG信号采集模块有效。
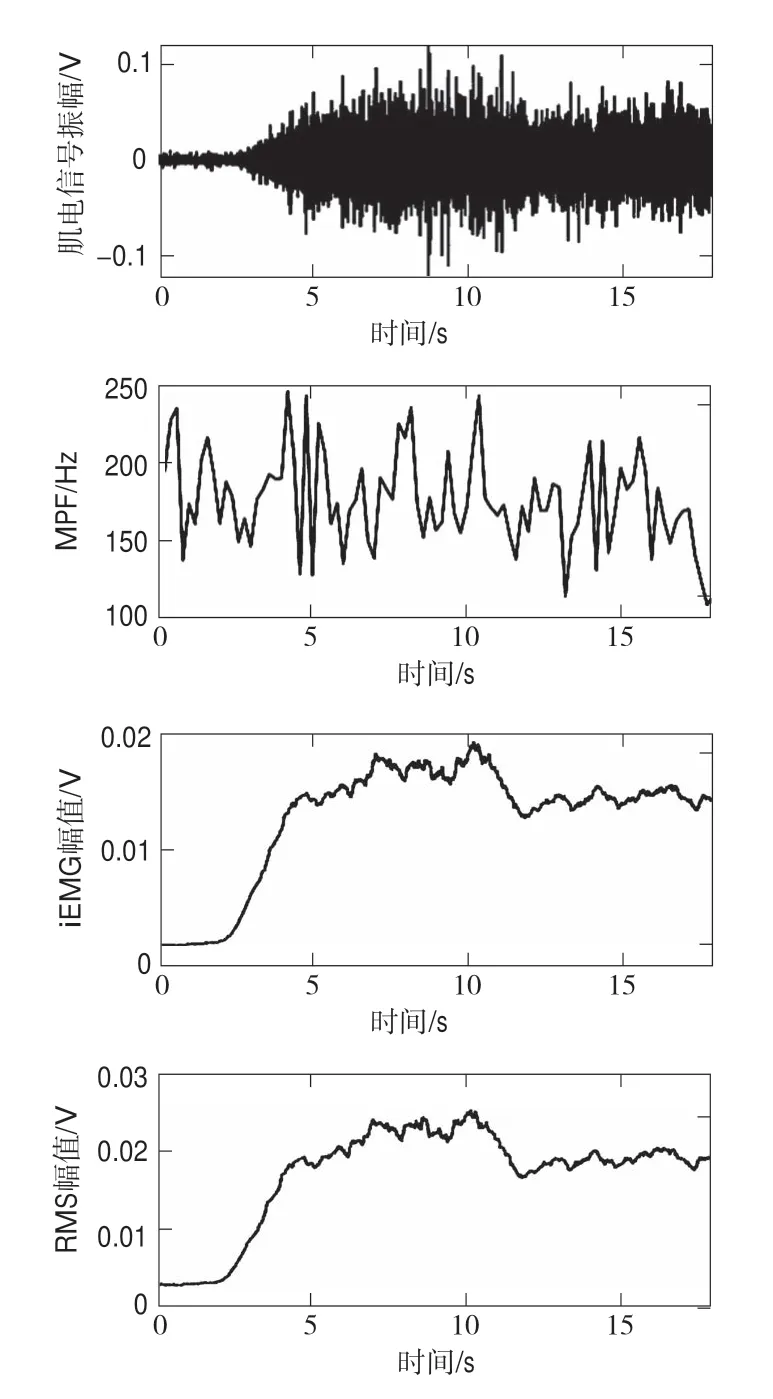
图8 sEMG原始信号与特征参数提取Fig.8 sEMG original signal and feature parameter extraction
5.2 前臂阻断实验
为了验证系统检测人体组织的血氧浓度变化的有效性,使用商用设备OxiplexTS组织血氧仪与本系统做对比实验。本系统与该商用设备采集血氧的原理相同,根据Hb和HbO2对红光和近红外光吸收差异的特性计算血氧蛋白浓度变化。
在前臂阻断的实验中,将传感器探头紧密贴合在前臂的内侧,将水银血压计的绷带绑于上臂后,被测手臂水平放于桌面并开始实验。等待系统采集稳定后,将袖带内的压力迅速增加到110 mmHg(1 mmHg=133.32 Pa)。由于阻断了局部血液循环且前臂的生物组织又在不断耗氧,从而前臂的HbO2浓度呈现降低趋势,Hb的浓度逐渐上升。袖带内的压力持续一段时间后迅速释放,前臂血液循环正常,前臂血液中的氧含量将迅速增加,恢复原有状态,导致两种血红蛋白浓度逐渐变为初始状态。
图9(a)、(b)中两种曲线分别是本系统和OxiplexTS组织血氧仪在某一次前臂阻断实验中测得的数据。可以看出,本系统在前臂阻断情况下得到ΔHbO2、ΔHb的变化趋势和幅度与标准的商用仪器采集的两种血红蛋白浓度相对变化一致。
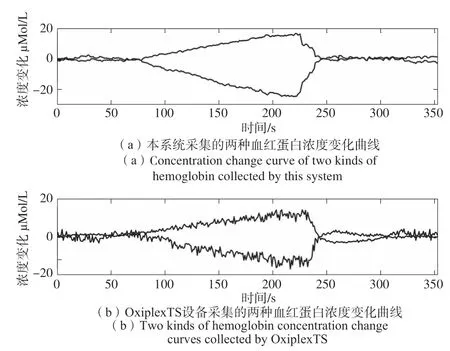
图9 本系统与OxiplexTS设备采集两种血红蛋白浓度变化曲线Fig.9 This system and OxiplexTS equipment collect two kinds of hemoglobin concentration curve
6 结论
以 STM32 芯片为核心,基于sEMG和NIRS设计了一种针对目标肌群的肌电和血氧信号实时监测设备,介绍了其硬件和软件部分,设计了等长收缩局部肌肉疲劳实验以及前臂阻断实验来验证本系统的有效性。系统为探究肌肉疲劳与目标肌群的sEMG以及血氧信号相关性提供了便利,为后续研究肌肉疲劳评估奠定基础。
