花色苷与蛋白质相互作用的研究进展
2023-02-12藏志焕丑述睿唐思懿李芝颖田金龙
藏志焕,丑述睿,唐思懿,李芝颖,田金龙,李 斌
(沈阳农业大学食品学院,辽宁 沈阳 110866)
花色苷是一种天然水溶性色素,属于黄酮多酚类化合物[1],存在于植物的花、果实、茎、叶和根器官的细胞液中。花色苷作为食物中的一种常见成分,可以通过摄入蔬菜、水果、葡萄酒和其他食物适量补充[2]。花色苷的颜色随pH值变化而变化,当pH值由酸性变为碱性时,其颜色由红色、紫色变为蓝色(图1A)。花色苷的安全无毒性使其在食品工业中被广泛应用于赋予或改善加工产品的颜色[3]。除颜色外,由于花色苷具有抗氧化、抗炎,抗肿瘤及保护视力等功效[4],常被用于医药、食品、化妆品等领域[5]。从结构上看,花色苷来源于花青素,由芳香环、含氧杂芳香环和芳香环组成[6](图1B)。在植物中主要包括以下6 种花青素,即矢车菊素、芍药素、天竺葵素、矮牵牛素、锦葵素和飞燕草素[7](图1C)。室温条件下花色苷结构在不同pH值水溶液中相互转换,结构之间存在着一定的平衡,分别为黄烊阳离子(红色)、醌类(紫色到蓝色)和无色形式(甲醇假碱和查耳酮)[4]。但花色苷在水溶液中极易受到水分子的亲核攻击,2-苯基苯并吡喃阳离子发生羟基化而发生降解。影响稳定性的因素主要有pH值、光照、温度、酶和糖等[8]。因此,针对花色苷的稳态化研究是目前亟需解决的热点问题。

图1 花色苷的颜色变化、花青素结构及花青素种类、取代基和颜色Fig.1 Color change of anthocyanins,the structure of anthocyanin and anthocyanin types,substituents and color
为了提高花色苷的稳定性,前人已经研究和开发了几种方法,如共着色、结构修饰和微胶囊等[9-11],但均存在得率低、安全性差、色泽不易保持等问题[12]。研究表明,蛋白质具有良好的表面性质、自组装性能和凝胶化特性,可在不改变花色苷结构的情况下,通过非共价和共价的作用形成结合体,花色苷固定在蛋白质结构腔中,可减少吡喃阳离子的损失,从而对花色苷的稳定性产生积极影响[13]。花色苷与蛋白质复合后会改善蛋白质的功能性质,如表面疏水性、乳化性、起泡性等[13]。因此,更好地了解蛋白质和花色苷的相互作用规律对其在食品体系中的应用至关重要。
蛋白质对花色苷的结合作用可分为共价结合和非共价结合。两者相互作用可以影响彼此在食物系统的形态、抗氧化能力、热稳定性、乳化特性和生物利用度。本文综述了近年来针对花色苷与蛋白质相互作用的研究进展,主要从蛋白质对花色苷稳定性保护和生物利用率的影响、花色苷对蛋白质功能性质的影响及二者复合后的工业应用方面进行阐述,以期为花色苷与蛋白质的互作在食品及其他行业中的应用提供理论参考。
1 花色苷稳定性及蛋白质对花色苷的影响
花色苷的稳定性是目前工业应用急需解决的问题,花色苷可以通过非共价相互作用或共价键与蛋白质相互作用,已成为提高其生物活性及消化道稳定性的有效方法。
1.1 花色苷的稳定性
花色苷的稳定性与两方面因素有关:1)取决于花色苷本身结构。一般来说,花色苷的稳定性与2-苯基苯并吡喃阳离子结构中羟基的数量有关,羟基数量越多稳定性越低,甲基化程度与稳定性呈正相关,游离羟基的糖苷化能够提高花色苷稳定性[4,14]。附着在花色苷苷元上的糖基单元和酰基以及它们的结合部位,对花色苷分子的稳定性和反应性有重要影响[14];2)加工和贮藏过程中的理化因素,如pH值、温度、光、氧、酶、抗坏血酸、糖及其降解产物、二氧化硫、氨基酸、酚酸、金属离子等[15]。花色苷稳定性、颜色与结构随pH值变化而变化。研究表明,当pH值低于3.0时,黄烊阳离子是花色苷的主要存在形式,当pH值逐渐升高到6时,花色苷的结构转化成无色的甲醇假碱和查耳酮假碱,当pH值高于7时,花色苷形成醌类结构[16]。花色苷受温度影响最为显著,热处理会使其化学稳定性、颜色以及功能性发生巨大的变化[17]。温度达60 ℃以上时,花色苷发生降解转变为查耳酮[18]。酶对花色苷稳定性影响较大,例如多酚氧化酶和过氧化物酶使植物组织发生酶促褐变,降低花色苷稳定性[19]。研究发现超高压处理会钝化部分多酚氧化酶和过氧化物酶,从而起到保护花色苷的作用[20]。另外,光照、抗坏血酸、糖等因素也会使花色苷稳定性降低[21-23]。
1.2 蛋白质与花色苷互作提高花色苷稳定性
表1列出了利用蛋白质作为保护花色苷稳定性载体材料的研究进展。蛋白质对花色苷具有一定的结合能力,但不同的蛋白质对不同的花色苷在亲和力方面存在一定的差异性[24-26]。前期的研究发现酪蛋白、乳清分离蛋白、牛血清白蛋白等可通过非共价结合,保护蓝莓花色苷在加工贮藏时的稳定性[27-28],非共价相互作用机制如图2所示。

表1 蛋白质与花色苷相互作用对花色苷稳定性的影响Table 1 Effects of interaction between proteins and anthocyanins on the stability of anthocyanins

图2 蛋白质和花色苷通过氢键、疏水相互作用和离子相互作用的非共价结合示意图Fig.2 Schematic diagram of the non-covalent interaction between proteins and anthocyanins through hydrogen bonds,hydrophobic interaction and ionic interaction
1.2.1 天然蛋白质
蛋白质与花色苷在食品加工体系中常常共存。蛋白质与花色苷的结合主要由氨基酸侧链与花色苷通过氢键、疏水相互作用等弱作用力形成。采用多谱法及分子对接等研究手段可有效判断二者相互作用力类型。Chamizo-González等[29]通过分子对接和分子动力学模拟,评价了葡萄籽7S球蛋白与葡萄锦葵色素-3-葡萄糖苷的相互作用,结果表明7S球蛋白通过氢、烷基和π-烷基键与花色苷相互作用,黄烊阳离子朝向蛋白质的疏水区域,保护其免受水化作用。牛奶蛋白与花色苷的结合具有重要的意义,酪蛋白约占牛奶蛋白的80%左右,其中β-酪蛋白可作为矢车菊素-3-葡萄糖苷最具潜力的蛋白载体,这是因为β-酪蛋白与花色苷之间具有更多的氢键数量和相互作用能,可以有效提高花色苷稳定性和生物利用度[37]。Gong Shengxiang等[30]发现,紫马铃薯花色苷能够通过静态猝灭有效地猝灭酪蛋白和乳清分离蛋白的固有荧光,且酪蛋白对花色苷的结合亲和力强于乳清分离蛋白,结构分析结果表明,花色苷通过氢键和范德华力结合酪蛋白和乳清分离蛋白,分子对接分析结果表明,酪蛋白和乳清分离蛋白与花色苷有不同的结合位点。Meng Yueyue等[31]的荧光光谱分析结果表明,花色苷与蛋白的结合基本上是由非共价相互作用驱动的,结合热力学结果表明,矢车菊素-3-葡萄糖苷与β-乳球蛋白的结合是自发的,而疏水相互作用在络合过程中起着至关重要的作用。综上所述,花色苷稳定性提高的原因可能是,蛋白质与花色苷之间形成了“手-手套”的结合模式,将花色苷包裹在蛋白质特有的空间保护腔中。例如,图3中不同颜色的区域表示蛋白质与花色苷可能存在几个结合的口袋,在理论上可以通过分子动力学进一步计算口袋结构域与花色苷的空间匹配程度,筛选出花色苷可能作用口袋,为大分子组分(蛋白质)筛选提供重要的基础依据。

图3 蛋白质(α-酪蛋白)与花色苷(锦葵色素-3-半乳糖苷)“手-手套”结合Fig.3 “Hand-glove” binding of protein (α-casein) and anthocyanin(malvidin-3-galactoside)
1.2.2 改性蛋白质
相比于天然蛋白质,改性后的蛋白质对花色苷稳定性有不同的作用效果。有研究发现,在不同pH值条件下,乳清蛋白通过美拉德反应生成的产物有效提高了矢车菊素-3-葡萄糖苷的热稳定性[38]。Chen Zhongqin等[15]发现预热后的大豆蛋白分离物结合亲和力增强,可以与矢车菊素-3-葡萄糖苷相互作用,有效保护其稳定性。预热乳清分离蛋白与花色苷相互作用后也发现了类似的现象,这主要归因于预热后的蛋白质空间结构得到舒展,与花色苷的作用力增强[39-40]。Ren Shuai等[32]发现在抗坏血酸存在的情况下,添加天然乳清蛋白(质量浓度10 mg/mL)使紫色玉米和葡萄的花色苷半衰期延长约2 倍,黑胡萝卜花色苷溶液延长约1.31 倍,天然乳清蛋白的加入可有效提高抗坏血酸饮料中花色苷的稳定性,然而预热乳清蛋白却对花色苷的半衰期无显著影响。究其原因可能是天然乳清蛋白加热到40 ℃或50 ℃时,乳清蛋白折叠结构并没有打开太多,冷却后分子的展开可能是可逆的,这可能导致更多的花色苷与抗坏血酸相互作用,使颜色损失增加。
1.3 蛋白质提高花色苷生物利用率
花色苷的生物利用率低是限制其应用的一大难题[41]。在人体消化环境中,口腔pH值为5.6~7.9,胃部pH值为1.5~3.5,肠道pH值为6.7~7.4。由于消化时间短暂,花色苷稳定性在口腔中变化不明显,在胃部酸性环境下,花色苷主要以红色黄烊阳离子形式存在,其相对稳定[42],在小肠中由于消化酶的存在使花色苷发生严重降解,黄烊阳离子发生去质子化,仅有少量花色苷到达结肠发挥功效[43]。因此,阻止有色结构到无色结构的转换是保持花色苷稳定性的关键因素[44-45](图4)。
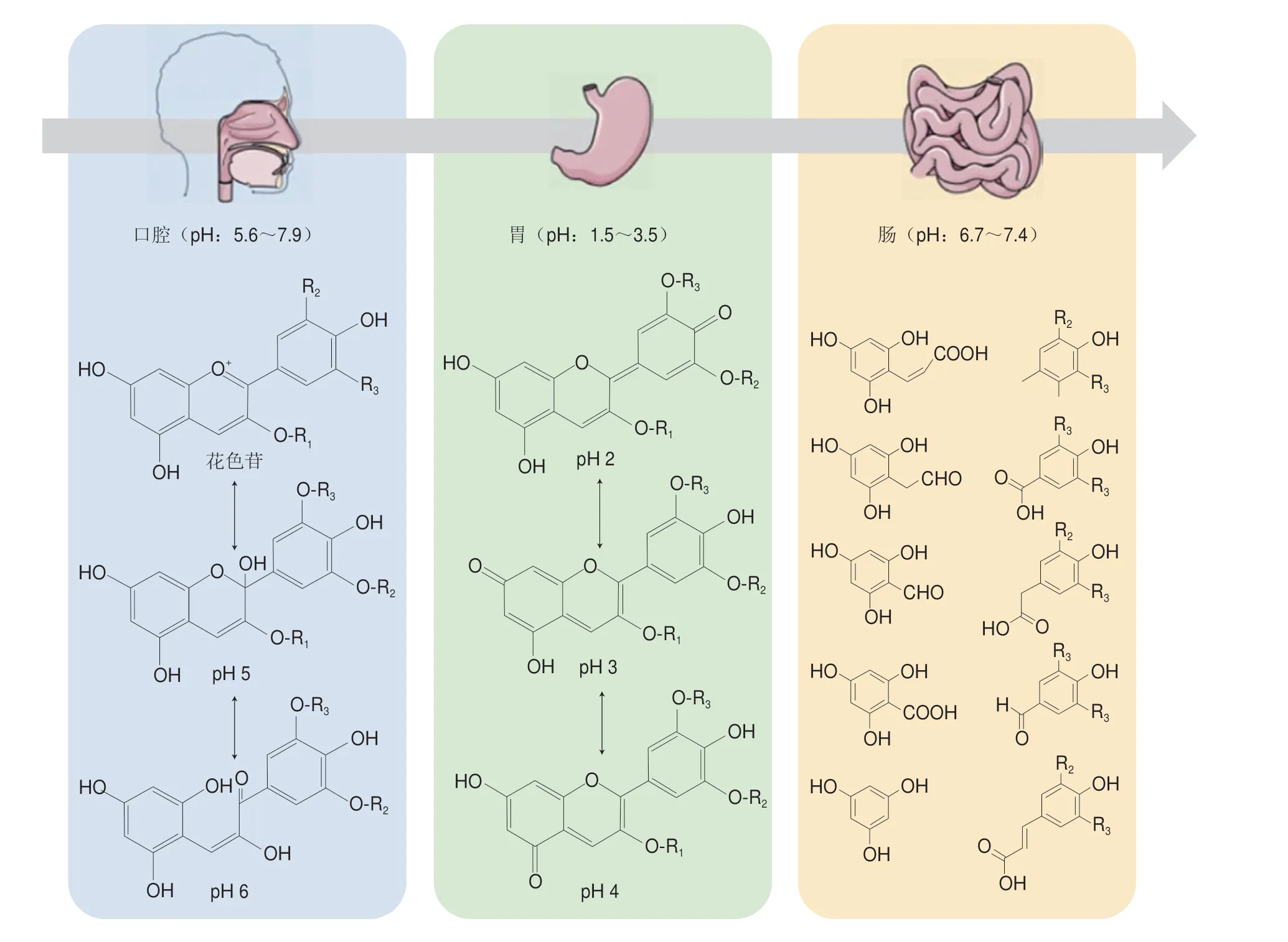
图4 花色苷在消化过程中的结构变化Fig.4 Structural changes of anthocyanins during digestion
蛋白质可以保护花色苷在摄入和同化过程中免受酶促降解和氧化降解[46]。花色苷-蛋白质复合物可保护花色苷在胃内不被降解,控制花色苷在肠道内的释放,增加肠道和结肠内花色苷的含量。目前体外模拟消化是测定花色苷生物利用率最简单的方式,可以探究消化和吸收过程的每个步骤对花色苷生物利用率的影响[45]。另外,体内研究表明,花色苷在模拟肠道环境中易降解为较小的酚类物质(如原儿茶酸和阿魏酸)。蛋白质可抑制花色苷生物利用率的损失,在消化过程中利用其特有的保护腔,将花色苷包裹在其中,免于消化液及环境改变带来的破坏[46]。
本团队前期研究表明,酪蛋白、乳清分离蛋白及牛血清白蛋白在体外模拟消化时对花色苷的稳定性有一定的保护作用[22,46]。通过药代动力学结果对花色苷在体内的生物利用率加以验证,发现α-酪蛋白能够使更多的花色苷以原型的形式被血液吸收[46]。有研究利用体外消化模拟系统(TNO胃肠模型),进一步证明蓝莓花色苷-大豆蛋白颗粒相比于蓝莓汁,能够输送更多的花色苷到达结肠,提高生物利用度[47]。蛋白质-花色苷颗粒通过上胃肠道的过程中保护蓝莓花色苷,以便随后吸收和/或结肠输送/代谢。花色苷在消化过程中很容易从蛋白质-花色苷颗粒分离,用于随后的肠道吸收[47]。综上所述,蛋白质的保护腔包裹花色苷可有效抑制花色苷在消化道环境中降解。
2 花色苷与蛋白质相互作用对蛋白质的影响
蛋白质结合花色苷不仅对花色苷稳定性产生影响,而且会影响蛋白质各级结构的变化[24]。目前关于花色苷对蛋白质影响作用已有报道,实际生产加工中二者易发生相互作用,进而影响蛋白质的功能及营养特性[48-49]。花色苷对蛋白质功能性的影响如表2所示。

表2 花色苷与蛋白质相互作用对蛋白质的影响Table 2 Effects of interaction between anthocyanins and proteins on proteins
2.1 对蛋白质结构的影响
花色苷与蛋白质结合后会影响蛋白质结构变化。蛋白质的氨基酸残基中含有色氨酸、酪氨酸和苯丙氨酸,可以在一定的激发波长下产生固有荧光,称为蛋白质固有荧光团,它们对微环境极性高度敏感,并已被广泛用于监测蛋白质结构变化[53-54]。特别是色氨酸荧光研究通常是为了获得蛋白质色氨酸残基附近构象变化的信息。荧光光谱研究发现随着矢车菊素-3-葡萄糖苷的不断加入,乳清分离蛋白和β-乳球蛋白的荧光强度明显下降,且光谱最大波长发生轻微变化,说明矢车菊素-3-葡萄糖苷可以改变乳清蛋白色氨酸残基周围环境的极性,导致其荧光猝灭[32]。前人研究表明紫马铃薯花色苷与酪蛋白和乳清蛋白相互作用后,改变了酪蛋白和乳清蛋白的构象结构,α-螺旋含量和β-转角含量降低,β-折叠含量和无规卷曲含量增加[31]。除非共价相互作用外,花色苷可以通过酶促(如由多酚氧化酶催化)或自氧化(如在碱性环境中或在氧化剂存在下)产生亲电邻醌,与其他邻醌进行各种连续的缩合反应,进而与蛋白质共价结合[12]。醌通过酚环与蛋白质的巯基和氨基形成共价键(C-N或C-S),且为不可逆反应。Sui Xiaonan等[48]发现花色苷与大豆分离蛋白的共价结合改变了大豆分离蛋白的二级结构,降低了α-螺旋含量和β-折叠含量,由于多肽链的展开,大豆分离蛋白的三级结构也受到花色苷掺入的影响。由于蛋白质本身结构复杂,构象变化研究主要局限于二级结构,目前关于花色苷对蛋白质三级、四级结构影响的研究相对较少。
2.2 对蛋白质溶解性的影响
蛋白质的溶解度是其在许多食品和饮料中应用的先决条件,也可能反过来影响其他功能性质,如乳化和发泡特性。影响蛋白质溶解性的内在因素有氨基酸组成、氨基酸序列,外在因素有pH值、温度、离子强度等[12]。花色苷与蛋白质的结合可以促进蛋白质的交联,改变蛋白质分子的净电荷,进而影响蛋白质的溶解度。本团队前期研究发现,乳清分离蛋白及牛血清白蛋白分别与蓝莓花色苷非共价复合后的溶解性相比于单独的蛋白质样品有所提高[22]。这可能是蛋白质结构中的疏水基团暴露后,表面疏水性降低导致溶解度增加,还有可能是花色苷结构中引入酚类羟基从而提高了蛋白质的溶解度[22]。
2.3 对蛋白质起泡性和乳化性的影响
花色苷会影响蛋白质-花色苷复合物的起泡性质和乳化性质。Sui Xiaonan等[17]发现与非共价结合相比,大豆分离蛋白与富含矢车菊素-3-葡萄糖苷的黑米提取物共价相互作用的乳化和起泡性增强,这归因于蛋白质结构的部分去折叠。花色苷改变了大豆分离蛋白的二级结构,β-折叠含量减少,β-转角含量和无规卷曲含量增加,乳化和发泡性能得到改善[52]。结合后乳化和起泡性能的改进部分归因于在油滴或气泡周围形成的界面层的弹性增加,蛋白质和花色苷的复合物形成的界面层可以防止气泡坍塌或聚结。起泡和乳化能力的增加也可能归因于复合后蛋白质溶解度的增加,因为蛋白质溶解度增加会促进蛋白质向界面层的快速转移[54]。
2.4 对蛋白质消化性的影响
前人研究发现花色苷的存在会诱导蛋白质的结构部分去折叠,因此,增加了敏感肽键的可及性;通过使用模拟胃肠道消化和Caco-2细胞单层作为跨上皮模型,大豆分离蛋白与富含矢车菊素-3-半乳糖苷的提取物共价结合提高了大豆分离蛋白的胃肠消化特性,但降低了消化样品中肽的通透性[54]。总而言之,蛋白质与花色苷的相互作用对蛋白质的吸收产生影响,与二者的种类高度相关[52]。
3 花色苷与蛋白质相互作用的应用
花色苷具有抗氧化、抗癌、抗炎、保护视力、减肥等功效(图5),使得花色苷的高值化应用备受关注,花色苷制品也深受大众青睐[30,55]。随着消费者对营养健康的膳食需求日益增强,为了满足消费者对绿色添加剂的需求,将食物中存在的天然成分与花色苷相互作用以提高花色苷的稳定性是一种受欢迎的方式。花色苷在浆果、蔬菜、薯类和谷物种皮中的含量尤为丰富,保护花色苷的稳定性有助于提升其应用价值,通过花色苷与蛋白质的相互作用可一定程度上实现对花色苷的保护。

图5 蛋白质-花色苷功能产品的应用及功能Fig.5 Applications and functions of protein-anthocyanin functional products
3.1 花色苷-蛋白质复合物在液态体系中的应用
随着人们对食品营养的关注度越来越高,市面上各式新型保健饮料层出不穷。在功能性饮料体系中,常会添加蔗糖和VC等添加剂,易使花色苷稳定性降低,而添加一定量的蛋白质后,果汁的营养价值不仅提高,还能保护花色苷的稳定性[40]。Ren Shuai等[32]发现在抗坏血酸存在时很快降低了花色苷的化学稳定性和颜色稳定性,并缩短半衰期,而乳清分离蛋白的加入,使花色苷在饮料体系中的稳定性显著增加。本团队前期研究发现,在果奶体系中,牛奶蛋白与花色苷形成的复合物,可有效提高蓝莓花色苷的稳定性,并改善蛋白质的功能性质,为果奶产品的加工提供理论基础[22]。
3.2 花色苷-蛋白质复合物在固态体系中的应用
对于含有蛋白质的食品,如冰淇淋、面包等,加入花色苷有助于改善此类食品的感官指标,增加营养功能。研究发现大米蛋白是一种与其他植物蛋白相比具有低过敏性、氨基酸组成较高的营养蛋白,适合大多数人食用,当其与花色苷通过氢键和疏水相互作用结合后,大米蛋白的抗氧化活性、起泡性等得到改善,使其在婴儿配方奶粉和烘焙食品等产品中具有非常好的应用前景[33]。蛋白质与花色苷相互作用后不仅会影响二者之间的功能特性,也可以降低某些食物口味的感知强度[55]。上述研究结果为普遍存在的蛋白质-花色苷相互作用如何影响合成产物的质量提供了理论参考,并为设计具有强化生物活性和功能特性的高质量食品提供理论基础。
4 结语
花色苷具有多种功能性质而深受大众喜爱,但其易降解、稳定性差。花色苷与蛋白质相互作用是一种安全高效且绿色的方法,这种结合会对花色苷稳定性起到一定的保护作用,且使其生物利用率也得到改善,减少功能基团在加工、贮藏和运输等过程中的降解,为花色苷稳态化提供了新方法。与此同时,蛋白质与花色苷相互作用还会影响蛋白质各级结构(如α-螺旋、β-折叠、无规卷曲等结构)的变化,从而影响蛋白质的溶解性、起泡性及乳化性等功能特性,赋予食品更高的营养价值。蛋白质与花色苷复合体系对于食品货架期的延长以及颜色保持都具有积极影响。目前花色苷及蛋白质相关产品的加工应用范围已逐步扩大,可为食品的深加工及利用提供研究基础。虽然花色苷和蛋白质之间的相互作用已经被广泛研究,但仍有许多方面有待进一步阐明。首先,花色苷和蛋白质之间的作用力取决于花色苷及蛋白质的化学结构,不同的花色苷与蛋白质之间存在不同的结合力,需要逐一探讨;其次,在食品加工中,如何最大化地保持花色苷的稳定性及蛋白质的功能特性仍是一项艰巨的任务,未来仍需着力发展产品高值化的新技术,以期实现体内的高效及精准递送。
