香叶醇对柑橘酸腐病菌的抑菌机制
2023-02-12王昱晴龙超安
翁 甜,王昱晴,龙超安
(华中农业大学园艺林学学院,园艺植物生物学教育部重点实验室,国家柑橘保鲜技术研发专业中心,湖北 武汉 430070)
柑橘是全球产量最高的水果之一,因其丰富的营养价值深受消费者的喜爱。然而,柑橘极易受病原菌的侵害,其中柑橘酸腐病是柑橘采后病害中仅次于绿霉病和青霉病的一大真菌病害,由半知菌亚门地霉属真菌酸腐病菌(Geotrichum citri-aurantii)引起[1-2]。该菌通常由果实伤口侵入,参与细胞外内聚半乳糖醛酸酶的分泌,浸渍果实组织,同时会传播至临近的正常果实,造成果实间的交叉侵染,引起大面积果实腐烂,造成严重经济损失[3]。
目前,防治柑橘采后真菌病害的有效措施主要是使用化学合成杀菌剂,例如抑霉唑、噻苯咪唑、嘧霉胺、咪鲜胺等[4]。然而,现阶段针对柑橘酸腐病菌的杀菌剂种类极少,且杀菌剂的大量使用会造成严重的环境污染,增强病原菌的抗药性,同时杀菌剂带来的农药残留对人体健康有害[5]。双弧盐对酸腐病菌有明显的抑制作用,能够显著降低柑橘酸腐病的发生,但长期使用可能会影响人类健康,在一些国家和地区已被禁止使用[6]。因此,寻找安全有效的方法以防治柑橘酸腐病十分必要。
香叶醇又称牻牛儿醇,是一种天然的无环类异戊二烯单萜,存在于许多不同的植物精油中,例如玫瑰、柠檬草、薰衣草、酸橙等[7-8]。近年来,大量的研究表明,香叶醇具有多种生物和药理特性,例如抗氧化、抗炎、抗肿瘤、抗微生物、护肝、神经保护等[7]。Su Yuwen等[9]研究发现香叶醇能够通过抑制COX-2来抑制炎症。El-Bassossy等[10]研究发现,香叶醇可以通过抑制氧化应激来发挥心脏保护作用。de Oliveira Pereira等[11]研究发现香叶醇对红色毛癣菌的细胞壁和细胞膜有损伤作用,对红色毛癣菌具有抗真菌活性。Singh等[12]研究发现香叶醇对白色念珠菌的细胞膜形成和菌丝形态发生具有抑制作用,同时能够破坏线粒体功能及铁的稳定性,降低遗传毒素的毒性。此外,香叶醇还具有抗溃疡、驱蚊、防腐、增甜等作用[13]。多项研究表明,香叶醇是一种纯植物化合物,无副作用,主要通过调节蛋白质表达来发挥多种活性,现已被美国食品和药物管理局批准作为食品添加剂来改善饮料、糖果和冰淇淋的风味[14]。
关于香叶醇的抗菌特性研究主要集中在对细菌性及人类真菌性病害方面,对植物源真菌的抗性研究较少。本实验以酸腐病菌为材料,研究香叶醇对酸腐病菌的抑菌作用,进一步探讨香叶醇对酸腐病菌的抑菌机制,旨在为柑橘酸腐病的防治提供参考。
1 材料与方法
1.1 菌株、材料与试剂
酸腐病菌AY-1菌株由本实验室分离并保藏,在PDA培养基上活化后用于后续实验。
温州蜜柑(Citrus unshiu) 华中农业大学柑橘园。
香叶醇(纯度98%) 上海麦克林生化科技有限公司;钙荧光白(calcofluor white,CFW)试剂、碘化丙啶(pyridine iodide,PI)试剂 美国Sigma公司;2,7-二氯荧光素二氢二乙酸酯(2,7-dichlorodihydr of luorescein diacetate,DCFH-DA)试剂盒、碱性磷酸酶(alkaline phosphatase,AKP)试剂盒 上海索莱宝生物科技有限公司;丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
UV-1500紫外分光光度计 翱艺仪器(上海)有限公司;DL-CJ-IMD-II洁净工作台 北京东联哈尔冰仪器制造有限公司;Centrifuge高速离心机 德国Eppendorf公司;Eclipse E100生物显微镜、Eclipse 90i正置生物显微镜 日本Nikon公司;DDS-307A电导率仪 上海雷磁仪器有限公司;生化培养箱 武汉瑞华仪器设备有限责任公司;VICTOR Nivo多功能酶标仪 美国Perkin Elmer公司;H-7650透射电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 菌株活化
吸取2.5 μL冻存(-80 ℃)于甘油管中的酸腐病菌AY-1菌液接种至马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,置于28 ℃培养3~4 d,备用。
1.3.2 孢子悬浮液的配制
取1.3.1节培养3~4 d的酸腐病菌AY-1,挑取菌丝至1 mL无菌水中,充分摇匀后用血球计数板计数,然后用无菌水调整孢子悬浮液浓度分别为1h 105个/mL和1h 106个/mL,备用。
1.3.3 香叶醇处理对酸腐病菌的抑菌活性测定
参考Yang Shuzhen等[15]的方法测定香叶醇对酸腐病菌的抑菌活性。在PDA培养基中加入香叶醇使其终质量浓度分别为0.125、0.250、0.500、1.000 g/L,以不添加香叶醇为对照(CK)组,将PDA培养基倒入直径为90 mm的培养皿中,待其凝固。取1.3.1节活化后的酸腐病菌AY-1平板,用打孔器取直径6 mm酸腐病菌AY-1菌饼,将菌饼置于PDA培养基中央,在25 ℃恒温培养箱中培养,每24 h观察菌落生长情况并拍照,采用十字交叉法测量菌落直径,共培养5 d。将48 h内完全无菌丝生长的质量浓度作为最小抑菌质量浓度(minimal inhibitory concentration,MIC),96 h内完全无菌丝生长的质量浓度作为最小杀菌质量浓度(minimal fungicidal concentration,MFC)[16]。
1.3.4 酸腐病菌孢子萌发率测定
参考潘佳亮[17]的方法并稍作改动测定酸腐病菌的孢子萌发率。取1.3.1节培养3~4 d的酸腐病菌AY-1,挑取菌丝至马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB)中,用PDB调整孢子终浓度为1h 106个/mL,加入终质量浓度0、1/2 MIC、MIC的香叶醇,于摇床中振荡培养(25 ℃、150 r/min,下同)12 h后置于Eclipse E100生物显微镜下观察孢子萌发情况,按式(1)计算孢子萌发率。

1.3.5 酸腐病菌菌丝体细胞壁完整性分析
1.3.5.1 CFW试剂染色
参考Ouyang Qiuli等[18]的方法并稍作改动,观察酸腐病菌菌丝体细胞壁的完整性。取0.5 mL 1.3.2节1h 106个/mL酸腐病菌孢子悬浮于50 mL PDB中,摇床培养2 d,5000 r/min离心20 min收集菌丝体,取1 g菌丝体加入30 mL无菌水中,加入香叶醇使其终质量浓度分别为1/2 MIC、MIC,以不添加香叶醇为对照组。处理6 h后,取少量菌丝体于2 mL离心管中,加入10 μL CFW试剂处理10 s,再加入等体积的质量分数10% NaOH溶液,于Eclipse 90i正置生物显微镜下观察。
1.3.5.2 AKP活力测定
参照1.3.5.1节方法处理0、3、6、9、12 h后收集不同处理组和对照组的菌丝体,加入提取液,充分研磨,4 ℃、10000 r/min离心10 min,取上清液根据试剂盒说明书步骤测定AKP活力。
1.3.6 酸腐病菌菌丝体细胞膜完整性分析
1.3.6.1 PI染色
参考Ouyang Qiuli等[19]的方法稍作改动观察酸腐病菌菌丝体细胞膜的完整性。参照1.3.5.1节方法处理菌丝体6 h,取少量菌丝体于2 mL离心管中,加入500 μL PI染色液,37 ℃水浴避光染色10 min,用PBS冲洗3 次,去除多余染色液,于Eclipse 90i正置生物显微镜下观察。
1.3.6.2 相对电导率测定
参考Wang Wenjun等[20]的方法稍作改动测定酸腐病菌菌丝体的胞外相对电导率。取0.5 mL 1.3.2节1h 106个/mL酸腐病菌孢子悬浮于50 mL PDB中,摇床培养2 d,5000 r/min离心20 min收集菌丝体,称取1 g菌丝于50 mL离心管中,加入30 mL去离子水重悬菌丝,加入香叶醇使其终质量浓度分别为1/2 MIC、MIC,以不添加香叶醇为对照组。用DDS-307A电导率仪测定0、2、4、6、8、10、12 h酸腐病菌的胞外电导率L/(μS/cm),初始电导率为L0/(μS/cm),12 h后将其煮沸10 min后冷却至室温,再次测定电导率L’/(μS/cm)。并按式(2)计算相对电导率。
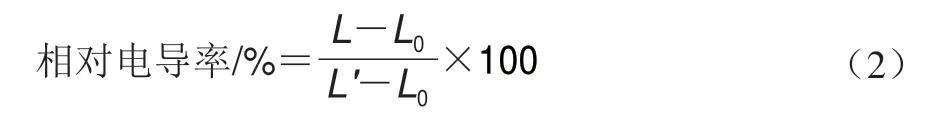
1.3.6.3 核酸泄漏水平测定
参考Wu Yalan等[21]的方法稍作改动测定酸腐病菌菌丝体核酸的泄漏情况。参照1.3.5.1节方法处理菌丝体0、2、4、6、8、10、12 h后取上清液于12000 r/min离心10 min,采用紫外分光光度计测定260 nm波长处吸光度,以表征菌丝体核酸的泄漏情况。
1.3.7 透射电子显微镜观察
取0.5 mL 1.3.2节1h 106个/mL孢子悬浮液于50 mL PDB中,摇床振荡培养24 h,加入香叶醇使其终质量浓度为MIC,以不添加香叶醇为对照组,继续振荡24 h,收集菌丝并将其加入到体积分数2.5%戊二醛溶液中固定,使用透射电子显微镜观察。
1.3.8 酸腐病菌菌丝体丙二醛含量测定
参照1.3.5.1节方法处理0、3、6、9、12 h后收集不同处理组和对照组的菌丝体,根据MDA试剂盒说明书操作测定酸腐病菌菌丝体内MDA的含量。
1.3.9 酸腐病菌菌丝体活性氧水平测定
参照1.3.5.1节方法处理6 h后收集不同处理组和对照组的菌丝体,根据DCFH-DA试剂盒说明书检测菌丝体胞内活性氧水平。
1.3.10 柑橘果实活体接种效果分析
参考Wang Wenjun等[22]的处理方法,选取体积、质量相近且无明显机械损伤的柑橘果实,先用自来水冲洗1 次,然后用质量分数2%的次氯酸钠溶液浸泡3 min,最后用蒸馏水冲洗3 次,室温下于超净台中自然晾干。在每个果实赤道附近用接种针刺出3 个等距离的伤口(直径约为5 mm,深度约为3 mm)。用无菌水配制菌药混合液(含1h 105个/mL酸腐病菌孢子悬浮液和不同质量浓度(MIC、10 MIC、20 MIC)香叶醇)。吸取10 μL菌药混合液接种于伤口处,待伤口自然吸收,同时设置对照组(10 μL 1h 105个/mL酸腐病菌孢子悬浮液)。将接种后的果实放置于经体积分数75%乙醇溶液消毒处理的保鲜盒(30 cmh 21 cmh 12 cm)中,果实底部用无菌塑料盖或玻璃小皿支撑,保鲜盒中加入适量无菌水以控制相对湿度。将保鲜盒室温放置7 d,每隔24 h观察果实发病情况,计算第3、4、5、6、7天的果实发病率(病果数/总果数×100%)并测定发病果实的病斑直径。
1.4 数据处理与分析
实验设置3 个平行,结果以平均值±标准差表示。数据用Excel 2016软件和SPSS Statistics 25软件进行统计分析,采用Duncan检验进行显著性分析,P<0.05表示差异显著,采用Excel 2016软件作图。
2 结果与分析
2.1 香叶醇处理对酸腐病菌抑菌活性的影响
如图1所示,不同质量浓度的香叶醇处理对酸腐病菌有不同程度的抑制作用,且抑制作用随处理质量浓度的升高而增强。对照组培养5 d后菌落直径达到(74.57f 1.39)mm,而0.125、0.250 g/L香叶醇处理组菌落直径仅分别为(48.62f 1.47)、(40.66f 2.25)mm,0.500、1.000 g/L香叶醇处理组酸腐病菌未生长。培养2 d后,0.500 g/L的香叶醇处理即可显著抑制酸腐病菌的生长,表明香叶醇抑制酸腐病菌生长的MIC为0.500 g/L;培养4 d后,0.500 g/L的香叶醇仍能完全抑制酸腐病菌的生长,表明香叶醇抑制酸腐病菌生长的MFC为0.500 g/L。
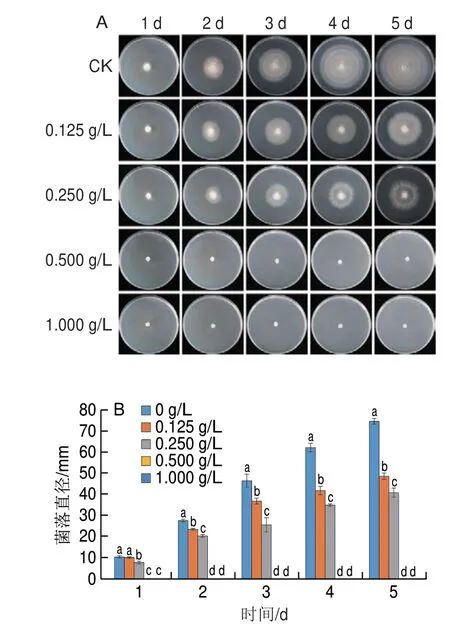
图1 香叶醇处理对酸腐病菌菌丝体生长的影响Fig.1 Effect of geraniol treatment on mycelia growth in G.citri-aurantii
2.2 香叶醇处理对酸腐病菌孢子萌发的影响
如图2所示,与对照组相比,不同质量浓度的香叶醇处理后酸腐病菌孢子萌发率显著降低(P<0.05)。处理12 h后,对照组孢子萌发率达到(92.17f 1.88)%,而1/2MIC和MIC处理组的孢子萌发率仅分别为(5.07f 2.03)%和(3.28f 1.28)%,表明香叶醇处理可以显著抑制酸腐病菌孢子的萌发。

图2 香叶醇处理对孢子萌发的影响Fig.2 Effect of geraniol treatment on spore germination
2.3 香叶醇处理对酸腐病菌菌丝体细胞壁完整性的影响
2.3.1 CFW试剂染色观察结果
CFW试剂能够与真菌细胞壁中的几丁质结合产生蓝色荧光,当荧光减弱时,说明真菌细胞壁完整性遭到破坏。如图3所示,用1/2 MIC和MIC的香叶醇处理菌丝体6 h后,蓝色荧光明显减弱,而对照组蓝色荧光明亮,表明经香叶醇处理的菌丝体细胞壁完整性被破坏,细胞壁中的成分发生改变。
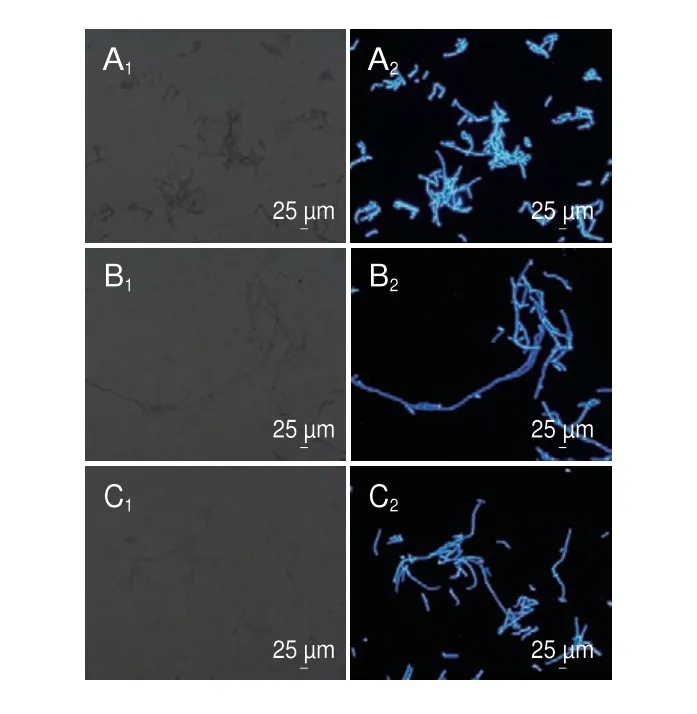
图3 香叶醇处理对酸腐病菌菌丝体细胞壁的影响Fig.3 Effect of geraniol treatment on mycelial cell wall in G.citri-aurantii
2.3.2 AKP泄漏情况
如图4所示,不同质量浓度的香叶醇处理能够引起酸腐病菌AKP活力发生明显变化。培养3 h后,经香叶醇处理后的酸腐病菌AKP活力显著高于对照组(P<0.05),培养12 h后,对照组AKP活力仍处在较低水平,1/2 MIC香叶醇处理的AKP活力达到对照组的3.27 倍,MIC香叶醇处理的AKP活力达到对照组的6.86 倍,均显著高于对照组(P<0.05)。
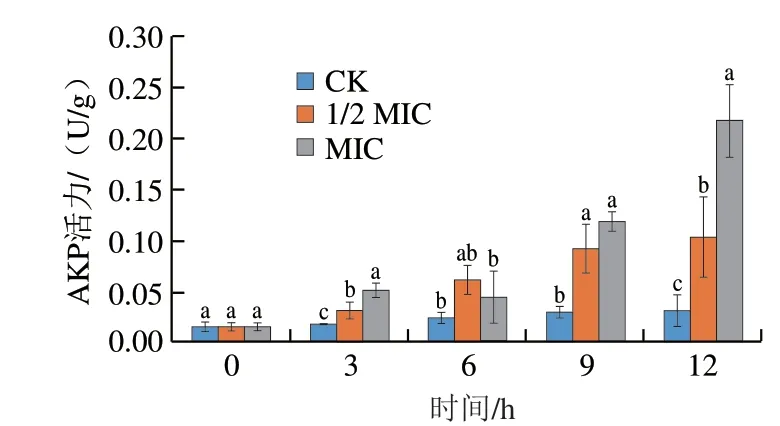
图4 香叶醇处理对酸腐病菌菌丝体AKP泄漏的影响Fig.4 Effect of geraniol treatment on leakage of AKP in G.citri-aurantii mycelia
2.4 香叶醇处理对酸腐病菌菌丝体细胞膜完整性的影响
2.4.1 PI染色观察结果
细胞膜是真菌的基本组织结构,能够维持真菌正常的生理结构,同时能够有效调节菌丝体内外环境的稳态。PI染色液不能穿过活细胞膜,而能穿过破损的细胞膜与双链DNA结合产生红色荧光[23]。如图5所示,用1/2 MIC和MIC香叶醇处理菌丝体6 h后,通过荧光显微镜观察发现菌丝体产生红色荧光,对照组无荧光产生,表明经香叶醇处理的菌丝体细胞膜完整性被破坏。
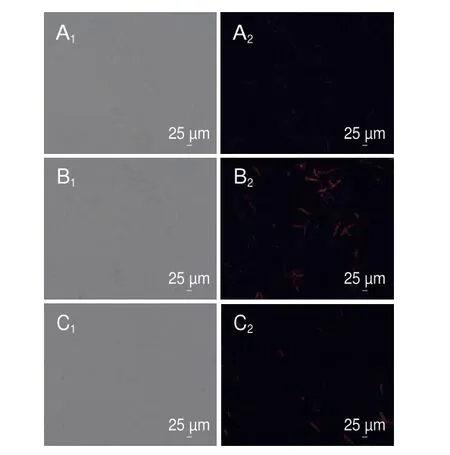
图5 香叶醇处理对菌丝体细胞膜的影响Fig.5 Effect of geraniol treatment on mycelia cell membrane
2.4.2 相对电导率变化
如图6所示,不同质量浓度的香叶醇处理后酸腐病菌相对电导率随处理时间的延长而呈上升趋势。处理2 h后,对照组与处理组之间存在显著差异(P<0.05)。随着处理时间的延长,不同质量浓度香叶醇处理之间均存在显著差异(P<0.05),质量浓度越高,相对电导率越高,表明对酸腐病菌细胞膜的破坏作用越大。
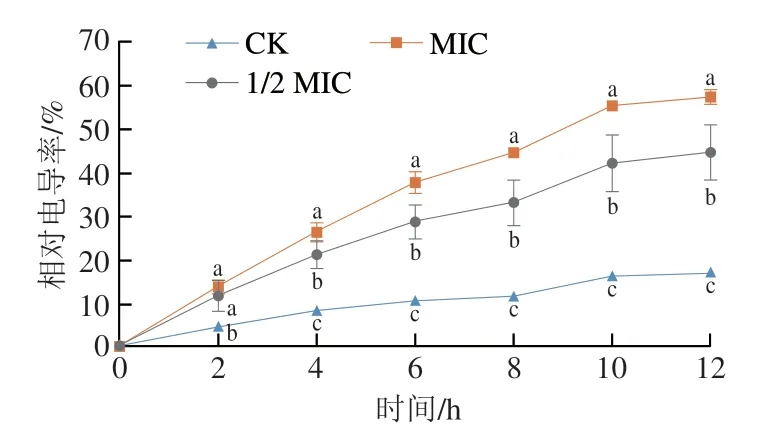
图6 香叶醇处理对酸腐病菌菌丝体相对电导率的影响Fig.6 Effect of geraniol treatment on relative conductivity in G.citri-aurantii mycelia
2.4.3 核酸泄漏水平
如图7所示,香叶醇处理会导致菌丝体核酸的泄漏。在0~12 h内,对照组核酸无明显泄漏情况,而经香叶醇处理的菌丝体核酸泄漏量明显上升,始终高于对照组,表明香叶醇处理破坏了菌丝体的细胞膜,促进了菌丝体内核酸的外泄。

图7 香叶醇处理对酸腐病菌菌丝体核酸泄漏水平的影响Fig.7 Effect of geraniol treatment on leakage of nucleic acid in G.citri-aurantii mycelia
2.5 香叶醇处理对酸腐病菌菌丝体微观结构的影响
如图8所示,香叶醇处理后酸腐病菌受到严重破坏。对照组细胞完整均匀,细胞壁与细胞膜紧密相连,可见明显的细胞器,处理组菌丝体发生质壁分离,细胞壁被破坏,且有增厚现象,细胞膜皱缩,细胞质被降解,细胞内呈现空泡化。

图8 香叶醇处理后酸腐病菌菌丝体透射电子显微镜图Fig.8 TEM of G.citri-aurantii mycelia after geraniol treatment
2.6 香叶醇处理对酸腐病菌菌丝体丙二醛浓度的影响
MDA是膜脂过氧化的主要产物,能够衡量菌丝体的膜脂过氧化水平。如图9所示,对照组MDA浓度在12 h内无明显变化,与对照组相比,相同时间不同质量浓度的香叶醇处理组酸腐病菌菌丝体MDA浓度显著上升(P<0.05),且香叶醇处理组MDA浓度维持在较高水平。
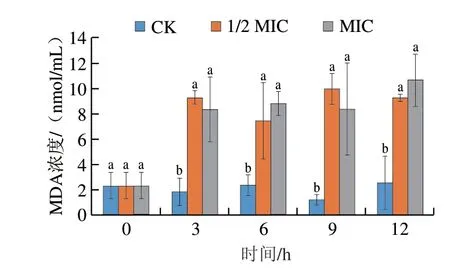
图9 香叶醇处理对酸腐病菌菌丝体MDA浓度的影响Fig.9 Effect of geraniol treatment on malondialdehyde content in G.citri-aurantii mycelia
2.7 香叶醇处理对酸腐病菌菌丝体活性氧的影响
DCFH-DA本身无荧光,可以穿透细胞膜,进入细胞后,可以在细胞内的酯酶作用下水解成2’,7’-二氯二氢荧光素,而2’,7’-二氯二氢荧光素不能穿透细胞膜,细胞内的活性氧与2’,7’-二氯二氢荧光素反应产生具有绿色荧光的2’,7’-二氯荧光素,且绿色荧光强度与活性氧水平成正比[16]。如图10所示,用1/2 MIC和MIC香叶醇处理酸腐病菌菌丝体6 h后,菌丝体产生绿色荧光,而对照组无荧光产生,说明经处理后菌丝体内活性氧水平增加。
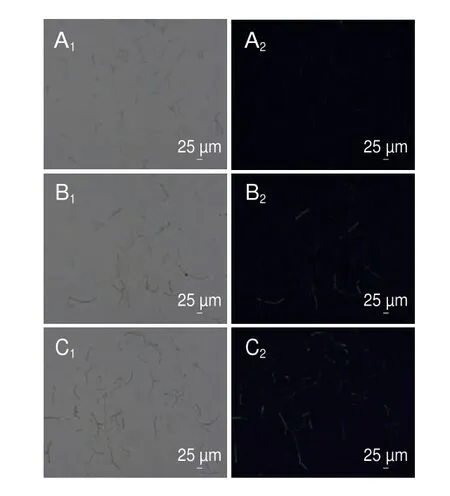
图10 香叶醇处理对酸腐病菌菌丝体活性氧的影响Fig.10 Effect of geraniol treatment on ROS levels of G.citri-aurantii mycelia
2.8 香叶醇处理对酸腐病菌侵染果实发病情况的影响
将香叶醇与柑橘酸腐病菌孢子悬浮液混合后立即接种于果实表面,如图11所示,不同质量浓度的香叶醇对果实表面酸腐病菌的抑菌效果存在差异。对照组果实在第2天开始发病,处理组果实随处理浓度的升高,发病时间越迟。接种3 d后,对照组果实病斑直径达14.52 mm,MIC条件下果实病斑直径达13.11 mm,与对照组之间无显著差异(P>0.05),而10 MIC、20 MIC条件下果实均未发病。随着接种时间的延长,对照组果实病斑直径扩展迅速,接种7 d后,对照组果实病斑直径为39.99 mm,发病率达72.69%,MIC、10 MIC、20 MIC处理组病斑直径依次为31.62、28.33、27.84 mm,发病率依次为45.83%、21.53%、11.11%,均显著低于对照组(P<0.05)。说明香叶醇处理能够抑制果实柑橘酸腐病的发生。
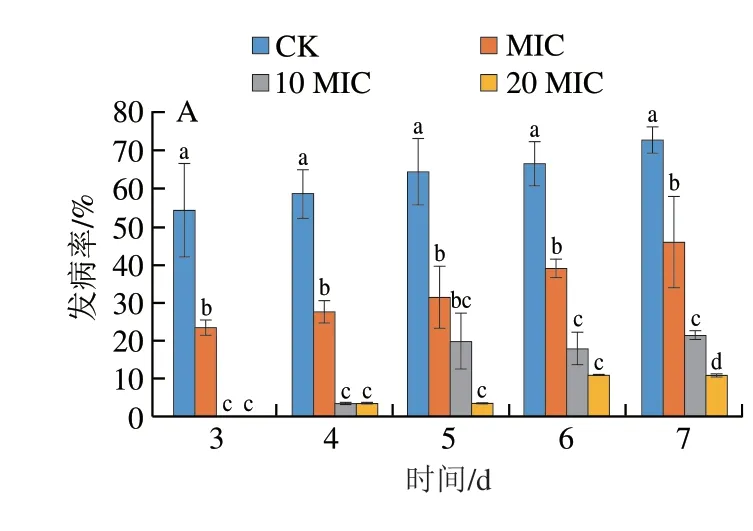
图11 香叶醇处理柑橘果实发病情况Fig.11 Effect of geraniol treatment on incidence of sour rot in citrus fruit
3 讨论
本实验主要研究了香叶醇对酸腐病菌的抑菌机制。抑菌活性测定表明香叶醇对酸腐病菌具有明显的抑制作用。香叶醇在质量浓度为0.125~1.000 g/L之间对酸腐病菌具有不同程度的抑制作用,MIC为0.500 g/L,此时酸腐病菌孢子萌发率仅为(3.28f 1.28)%,基本抑制了酸腐病菌孢子的萌发。这与其他天然植物提取物的抑菌作用相似,例如柠檬醛和辛醛对酸腐病菌的MIC为0.50 μL/mL[24],黑香菜油和茴香油在400 μL/L和600 μL/L时能够完全抑制李子灰霉病菌的生长,从而有效控制灰霉病对李子果实的感染[25]。
细胞壁是真菌抵抗外源物质入侵的第一道屏障,细胞壁的完整性对维持真菌细胞的正常生命活动至关重要,真菌细胞壁主要由几丁质、纤维素、葡聚糖和脱乙酰壳聚糖组成[26]。真菌细胞壁的破坏可以通过观察几丁质的变化来验证,几丁质可以与CFW结合产生蓝色荧光[27],当细胞壁被破坏,几丁质含量降低,CFW无法与几丁质结合,蓝色荧光将减弱。本研究中,经1/2 MIC和MIC香叶醇处理的酸腐病菌菌丝体蓝色荧光强度减弱,表明处理后的酸腐病菌菌丝体细胞壁完整性被破坏。这与盐酸小檗碱对指状青霉细胞壁的作用一致[28]。AKP存在于细胞壁与细胞膜之间,本研究进一步测定了AKP的泄漏情况,结果发现,对照组的酸腐病菌AKP泄漏量较低,12 h后胞外AKP活力仅为0.03 U/g,1/2 MIC和MIC香叶醇处理12 h后胞外AKP活力分别达到0.10 U/g和0.22 U/g,显著高于对照组(P<0.05),且随处理时间的延长,胞外AKP活力不断升高,这与毛霉对指状青霉和酸腐病菌的作用结果[29]相一致。
细胞膜是真菌组织结构的一部分,能够维持真菌正常的生理结构,是细胞与外界环境进行物质交换和信息传递的重要通道,能够有效调节内外环境的稳态,保障真菌的正常生命活动[30],同时,细胞膜是抗真菌剂药物开发的重要作用靶点[31]。已有研究表明,许多抗菌物质均能够通过改变真菌细胞膜的通透性来破坏真菌内外环境的稳态,从而起到抑菌作用,例如苦参碱[16]、百里酚、水杨酸[32]以及碳酸铵[33]等,与本研究结果相同。经香叶醇处理后,细胞膜被破坏,菌丝体胞外相对电导率显著上升(P<0.05),细胞膜通透性增强,菌丝体细胞内核酸发生外泄,且随着处理质量浓度的升高和处理时间的延长,核酸外泄增多,PI染色结果也证实了香叶醇对酸腐病菌细胞膜的破坏作用,这与El-Bassossy[10]以及Bound[34]等的研究结果相同,香叶醇通过细胞内物质的泄漏来破坏细胞膜,以治疗红色毛癣菌的感染,萜类物质香芹酚及其2,3-不饱和1-O-葡萄糖苷对白念珠菌细胞有裂解作用,能够破坏细胞膜的完整性。进一步通过透射电子显微镜观察也发现,香叶醇对酸腐病菌的细胞壁和细胞膜以及细胞器均有破坏作用。
细胞膜的主要成分是脂质和蛋白质,脂质中含有不饱和双键,易发生脂质过氧化反应[35],MDA是膜脂质过氧化反应的重要产物之一,其对生物膜具有损伤作用[36]。活性氧是生物体内氧化代谢的产物,在调节生物体的各种生理功能中具有重要作用,但过高的活性氧水平会对细胞产生伤害,造成细胞死亡[37]。已有研究表明,经碳酸氢钾处理后灰霉菌体内活性氧积累,对灰霉菌产生抑制作用[38]。Yang等[39]研究发现戊二醛处理诱导酸腐病菌细胞内积累大量活性氧,且MDA含量显著高于对照组,表明菌丝体发生了脂质过氧化反应。这与本研究的结果相似,经1/2 MIC和MIC香叶醇处理后,酸腐病菌菌丝体内MDA含量显著高于对照组(P<0.05),同时通过荧光显微镜可以观察到明显的绿色荧光,菌丝体内活性氧发生积累,表明香叶醇处理后菌丝体发生脂质过氧化反应。
4 结论
本研究结果表明,香叶醇处理能够有效抑制酸腐病菌菌丝生长和孢子萌发,0.500 g/L的香叶醇可有效抑制酸腐病菌菌丝的生长,孢子萌发率仅为(3.28f 1.28)%,能够破坏菌丝体的细胞壁和细胞膜,增加细胞的通透性,同时造成活性氧积累,使菌丝体发生脂质过氧化反应,导致菌丝体内外环境失衡,影响菌丝体的正常生命活动。香叶醇能够显著减少柑橘果实酸腐病的发生,降低果实的发病率及病斑直径,本实验可为柑橘采后酸腐病的防治提供理论依据。
