不同聚合度壳寡糖单体在小鼠体内的吸收分布
2023-02-12姜启兴于沛沛夏文水
王 斌,汪 玲,闫 华,姜启兴,于沛沛,夏文水
(1.江南大学食品学院,江苏 无锡 214122;2.江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
甲壳素广泛存在于虾蟹壳、昆虫的表皮和各种真菌的细胞壁中,是自然界中仅次于纤维素的第二大聚合物[1]。壳聚糖是甲壳素降解和脱乙酰得到的自然界中唯一的阳离子多糖,因为其良好的生物相容性、生物可降解性、无毒性和吸附性,作为功能材料得到广泛的应用[2]。但是,甲壳素和壳聚糖都是高分子聚合物,在中性pH值条件下溶解性差,这种特性限制了它们在食品、医药和农业领域应用[3]。然而,壳聚糖水解得到的聚合度在2~20之间的低分子壳寡糖具有很好的水溶性,2014年被国家卫生计生委批准为新食品原料[4]。壳寡糖被证实有很多的生物活性,如抗氧化、抗炎、抗肥胖、抗肿瘤、抑菌、免疫调节、神经保护、降血压、降血脂、降胆固醇、促进组织再生、增强药物和DNA传递以及钙的吸收等[5-7],可有效治疗和预防许多威胁生命的疾病,如癌症、心脏病、糖尿病、肥胖和阿尔茨海默病等[8-10]。
在研究壳寡糖生理活性机制前,必须要明确壳寡糖在体内消化、吸收、分布和代谢等过程。而目前关于壳寡糖的体内消化吸收分布及其代谢途径方面的研究还存在很多的争议。陈佳祎[11]建立了体外静态模型,首次发现聚合度2~5的壳寡糖不受胃肠道消化的影响,其结构和含量保持不变;而聚合度6~10的壳寡糖在胃和肠消化中会降解为聚合度2~5的壳寡糖。早在1999年,有研究就发现异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的50%脱乙酰度壳聚糖在小鼠腹腔给药后,能够快速移动到肾脏并通过尿液排出(大部分在14 h后通过尿液排出),几乎不会分布到肝、脾、腹水和血浆中,排出的壳聚糖分子质量变小,证实了大分子壳聚糖的生物可降解和不蓄积的特性[12]。Zeng Lintao等[13]研究了不同分子质量和不同溶解度壳聚糖在小鼠体内的吸收分布排泄情况,发现壳聚糖能够被小鼠小肠吸收,可以分布到肝、肾、脾、胸腺、心、血液和肺中,在肝中的浓度明显高于其他组织,随着壳聚糖分子质量减小,其水溶性增和肠道吸收率增加。王敏[14]的实验结果进一步表明FITC标记的聚合度1~3的壳寡糖和8~11的壳寡糖混合物入血入肠比例分别为5.68∶1和9.84∶1,认为壳寡糖在肠道的吸收比与壳寡糖的分子质量呈负相关。无标记的壳寡糖单体(聚合度2~5)体内吸收研究结果显示,只有壳二糖(chitobiose,COS2)和壳三糖(chitotriose,COS3)可以吸收入血,壳四糖(chitotetraose,COS4)和壳五糖(chitopentose,COS5)不能[15]。但是,Zhao Qini等[16]的研究表明,无标记的COS5、壳六糖、壳七糖和壳八糖均可在大鼠血清中检测到,随着聚合度的增加吸收量降低。Zhu Limeng等[17]通过体内体外实验证实壳寡糖混合物(聚合度2~7)具有良好的血脑屏障穿透能力。
目前的相关研究表明,高分子壳聚糖和低分子壳寡糖在动物体内均可以被吸收,吸收量与分子质量和水溶性呈负相关,并且可以分布到心、肝、脾、肺、肾等器官中[18],聚合度2~7的壳寡糖还可以跨过血脑屏障[17]。由于目前关于体内吸收分布的研究大多采用壳寡糖混合物,成分难以定性,导致实验难以重现,而且实验结果不能明确可以被吸收并分布到相应靶器官发挥作用的主要结构成分。同时由于壳寡糖口服给药后经过首过效应,血药浓度会降低,受不同检测方法检测灵敏度的影响,会导致实验结果产生较大误差,因此不同检测方法得到的实验结果存在差异性,甚至出现相悖的结果。综上,当前对于不同聚合度壳寡糖单体的体内吸收和各组织中分布的差异性还不明确。
本研究通过FITC标记在消化道不被降解的壳寡糖单体(COS2、COS3、COS4和COS5),并灌胃昆明小鼠,借助小动物活体光学成像系统,直观地观察不同聚合度壳寡糖单体在小鼠体内和离体组织器官中的吸收分布情况,进一步解剖取得组织进行荧光定量检测,分析不同聚合度壳寡糖在小鼠体内的吸收分布的差异性,为壳寡糖功能活性机制和构效关系的研究提供理论支撑和指导。
1 材料与方法
1.1 动物、材料与试剂
雄性昆明小鼠,体质量(39±2)g,7~8 周龄,购买于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2021-0011。实验小鼠自由饮食,在一个可控制的环境中饲养,控制温度为(22±2)℃、相对湿度(50±5)%。光照黑暗各12 h,光照时间从早上8∶00到晚上22∶00。所有动物相关的实验操作都通过江南大学实验管理与动物福利委员会审核,审核编号为JN.No20210415c1080520[077]。
COS2、COS3、COS4和COS5(纯度大于90%)由实验自制;FITC(纯度大于90%) 上海麦克林生化科技有限公司;TLC Silica gel 60 F254薄层硅胶板 德国Merck公司;其他相关试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
P型立式T216200层析缸(200 mmh 200 mm)上海信谊仪器厂有限公司;Scientz-10ND冷冻干燥机宁波新芝生物科技股份有限公司;IVIS Spectrum型小动物活体光学成像系统 美国珀金埃尔默仪器公司;G9800A荧光分光光度汁 美国安捷伦公司。
1.3 方法
1.3.1 FITC标记壳寡糖单体的制备
称取0.2 g制备的壳寡糖单体(COS2、COS3、COS4和COS5)溶解在20 mL二甲基亚砜中,配制为10 mg/mL的溶液;称取0.5 g FITC(与壳寡糖单体质量比大于1∶2.42),溶解在无水甲醇中,配制为10 mg/mL溶液,用5 mol/L的NaOH溶液调pH值大于7.5(FITC溶液颜色为橙黄色后基本不再变化);边剧烈搅拌边向壳寡糖溶液中缓慢滴加FITC溶液;避光搅拌反应12 h,离心,取上清液,加入5 倍体积的丙酮,离心,弃掉上清液,用无水乙醇洗涤沉淀,直到上清液中检测不到FITC的荧光。将沉淀溶解在去离子水中,再次离心,取上清液冷冻干燥得到FITC标记的壳寡糖单体粉末。
1.3.2 FITC标记产物纯度鉴定
通过薄层色谱(thin layer chromatography,TLC)法[18]对制备的FITC标记产物FITC-COS2、FITC-COS3、FITC-COS4、FITC-COS5进行纯度鉴定。以V(异丙醇)∶V(氨水)∶V(水)=15∶7.5∶1为展开剂,点样量为1 μL。待薄层色谱展开结束,用吹风机吹干,在波长为365 nm的紫外灯下观察发光情况,鉴定游离FITC的残留量和合成荧光标记物。在硅胶板上喷洒0.2%的茚三酮显色剂,热风吹至显色,放置1 h,显色后观察壳寡糖残留情况。
1.3.3 FITC标记率的测定
参考文献[19]测定FITC的标记率,准确称取一定量FITC溶于磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.4,下同)溶液中,配制成1 μg/mL的FITC溶液,用PBS稀释得到0.1、0.2、0.4、0.4、0.8 μg/mL一系列标准FITC溶液,于激发波长485 nm、发射波长520 nm、激发光狭缝宽度10 nm、发射光狭缝宽度2.5 nm条件下测定吸光度A,以A为纵坐标,FITC质量浓度/(μg/mL)为横坐标,绘制标准曲线,建立回归方程。
准确称取1~3mg的各FITC荧光标记物溶于500~1000 mL的PBS中,于激发波长485 nm、发射波长520 nm、激发光狭缝宽度10 nm、发射光狭缝宽度2.5 nm条件下测定吸光度A,带入FITC的标准曲线方程中计算出FITC质量,根据下式计算各FITC标记产物的标记率。

1.3.4 定性检测
1.3.4.1 活体成像
17 只雄性昆明小鼠(38~42 g)提前一天进行剃毛。一只作为空白对照,灌胃等量的生理盐水(0.1 mL/10 mg)。剩余16 只随机分为4 组,每组4 只,每组分别灌胃FITC-COS2(210 mg/kgmb)、FITC-COS3(123 mg/kgmb)、FITC-COS4(107 mg/kgmb)和FITC-COS5(97 mg/kgmb),通过不同单体的标记率换算为COS2、COS3、COS4和COS5的剂量统一为65 mg/kgmb(壳寡糖的人体推荐剂量为低于0.5 g/d[4],按照男性平均体质量70 kg[20],转化系数为9.1,得到小鼠剂量为65 mg/kgmb)。每组4 只小鼠分别在灌胃0.5、1、2 h和4 h,于激发波长485 nm、发射波长520 nm条件下,用IVIS SPECTRUM型小动物活体光学成像系统对荧光分布情况进行检测。
1.3.4.2 离体组织成像
对灌胃1 h的小鼠活体成像后,在暗室内解剖,取血、脑、心、肝、脾、肺、肾、胃肠道,将组织放进检测室内,用IVIS SPECTRUM型小动物活体光学成像系统检测离体器官的荧光分布情况。
1.3.5 定量检测
1.3.5.1 FITC-COS的标准曲线的绘制
分别称取一定量的标记产物FITC-COS2、FITC-COS3、FITC-COS4、FITC-COS5,用PBS配制为1~3 μg/mL的溶液,进行梯度稀释,得到一系列FITCCOS标准溶液,于激发波长485 nm、发射波长520 nm、激发光狭缝宽度10 nm、发射光狭缝宽度10 nm条件下测定荧光强度,以荧光强度为纵坐标,FITC-COS质量浓度/(μg/mL)为横坐标,绘制标准曲线,建立回归方程。
1.3.5.2 动物组织采集
雄性KM小鼠(38~42 g)85 只,随机分为17 组,每组5 只。分别为空白组、COS2(0.5、1、2 h和4 h各一组)4 组、COS3(0.5、1、2 h和4 h各一组)4 组、COS4(0.5、1、2 h和4 h各一组)4 组和COS5(0.5、1、2 h和4 h各一组)4 组。空白对照组灌胃等量的生理盐水(0.1 mL/10 mg),实验组各4 组小鼠灌胃FITC-COS2(210 mg/kgmb)、FITC-COS3(123 mg/kgmb)、FITCCOS4(107 mg/kgmb)和FITC-COS5(97 mg/kgmb),通过不同单体的标记率换算为COS2、COS3、COS4和COS5的剂量统一为65 mg/kgmb。4 组小鼠分别在灌胃0.5、1、2 h和4 h各解剖一组,眼球取血后,收集脑、心、肝、脾、肺、肾组织。全血在静置1 h以后,3500 r/min离心10 min,取血清;其他组织分别称质量后收集;所有样品放置在-20 ℃避光保存,以备后续实验操作。
1.3.5.3 各组织荧光强度测定
血清用PBS稀释一定的倍数;收集的各组织取0.3 g左右,记录准确质量,按照体积比1∶9添加预冷的PBS,加入两颗小磁珠,使用高通量组织研磨机60 Hz运行90 s,重复3 次。10000 r/min离心10 min,取上清液;在激发波长485 nm、发射波长520 nm、激发光狭缝宽度10 nm、发射光狭缝宽度10 nm条件下,以空白组小鼠组织匀浆液为空白调零后,测定荧光强度,带入对应的标准曲线方程计算各壳寡糖单体的质量浓度。
1.4 数据统计与图表绘制方法
所有数据均采用平均值±标准偏差的形式表示,采用GraphPad Prism 8.0软件进行图表绘制。
2 结果与分析
2.1 FITC标记壳寡糖分析结果
2.1.1 产物纯度鉴定结果
通过TLC分析定性鉴定了制备得到的荧光标记产物纯度,结果如图1所示。在FITC-COS2、FITC-COS3、FITC-COS4和FITC-COS5的反应产物中均没有检测到游离的FITC(图1A1、B1、C1、D1),说明未反应的FITC已经除净;FITC-COS2、FITC-COS3、FITC-COS4和FITC-COS5的反应产物中没有检测到游离的壳寡糖单体(图1A2、B2、C2、D2),说明标记产物中没有壳寡糖单体残留,得到的均为FITC标记物,可用于后续体内分布实验的研究。
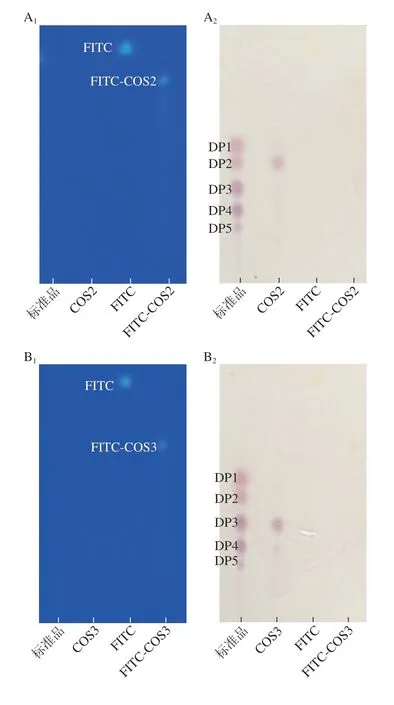

图1 不同聚合度壳寡糖单体FITC标记产物的TLC图Fig.1 TLC profiles of FITC labeled COS monomers with different degrees of polymerization
2.1.2 不同聚合度壳寡糖单体FITC标记率的测定
游离FITC 的标准曲线方程为y=599.0486-4.0458,R2=0.9995。通过测定并计算得到COS2的标记率为0.69,转换为物质的量比为1.95∶1(n(FITC)∶n(COS2)),表明COS2的氨基反应率高;COS3、COS4和COS5的标记率分别为0.47、0.39和0.33,转换为物质的量比分别为1.14∶1(n(FITC)∶n(COS3))、1.09∶1(n(FITC)∶n(COS4))和1.04∶1(n(FITC)∶n(COS5)),反应率比较低。FITC标记壳寡糖的标记率随着聚合度增加而降低,糖链越长,反应效率越低。
2.2 定性检测结果
2.2.1 活体成像检测结果
给小鼠灌胃FITC-COS2~FITC-COS5,采用IVIS SPECTRUM型小动物活体光学成像系统检测,结果如图2所示。FITC-COS2快速分布到全身,1 h达到最大分布;FITC-COS3在0.5 h检测信号强度很弱,在1 h和2 h能够分布到全身,而FITC-COS4和FITC-COS5在小鼠体内检测信号强度很弱,基本检测不到。因为COS3、COS4和COS5的FITC标记率远低于COS2,在寡糖的灌胃剂量一致的情况下,COS3、COS4和COS5的荧光信号强度远低于COS2。
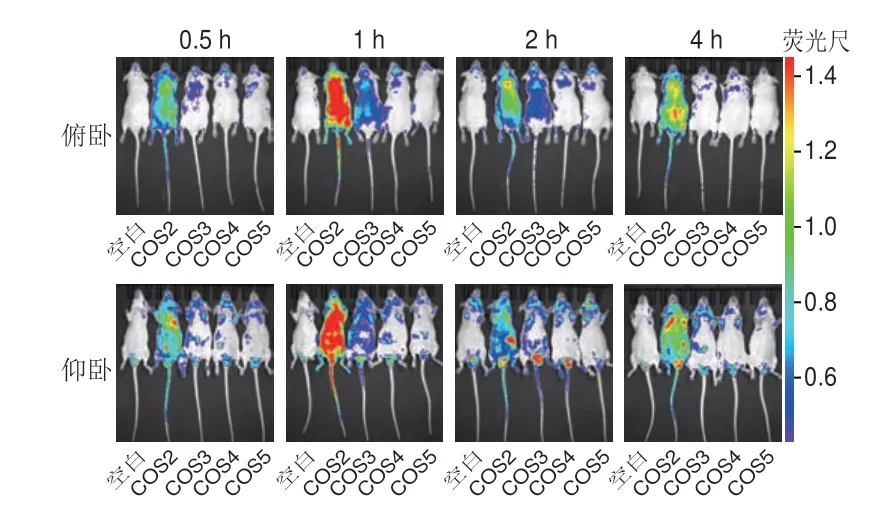
图2 不同聚合度壳寡糖单体在小鼠体内的活体成像Fig.2 In vivo imaging of distribution of COS monomers with different DPs in mice
2.2.2 离体组织成像检测结果
为了更进一步确定不同聚合度壳寡糖单体在小鼠体内的吸收和组织中的分布情况,根据文献报道中血药质量浓度最大的时间点对各组小鼠进行解剖[15],取其主要器官,用IVIS Spectrum型小动物活体光学成像系统检测各器官中的荧光分布情况,结果如图3所示。给小鼠灌胃FITC-COS2~FITC-COS51 h后,FITC-COS2在脑、肝、肺、肾和胃肠道中均检测到荧光信号,在心、脾和血清中几乎检测不到荧光信号;FITC-COS3在脑、肝、肺、肾和胃肠道中检测到荧光信号,在心、脾和血清中没有检测到荧光信号;FITC-COS4在脑、肝、肾、血清和胃肠道中检测到信号,在心、脾、肺和血清中没有检测到荧光信号;FITC-COS5在脑、肝、肺、肾和胃肠道中检测到荧光信号,在心、脾和血清中没有检测到荧光信号。FITC-COS2、FITC-COS3、FITC-COS4和FITCCOS5灌胃给小鼠1 h后,在脑、肝、肾和胃肠道均能检测到荧光信号,而在心、脾和血清中则未检测到明显荧光信号,肺中仅FITC-COS4未检测到荧光信号。
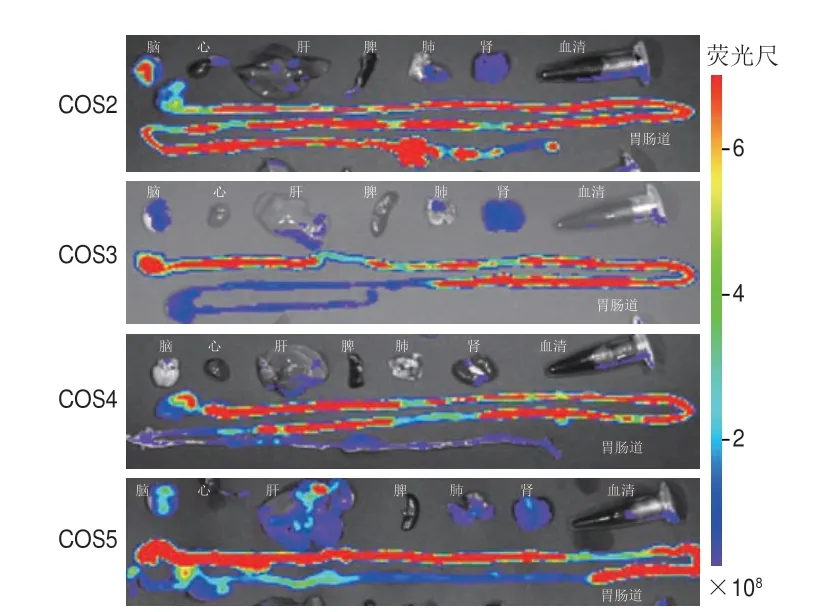
图3 不同聚合度壳寡糖单体的离体组织成像Fig.3 In vitro imaging of distribution of COS monomers with different DPs in mouse tissues
2.3 定量检测结果
2.3.1 不同聚合度壳寡糖单体FITC标记物标准曲线方程不同聚合度壳寡糖单体的荧光标记产物,根据荧光定量得到的标准曲线方程如表1所示。根据各组织上清液测定的荧光强度,通过对应组别的标准曲线方程计算得到该组织中的FITC-COS2~FITC-COS5的质量浓度,再根据不同聚合度壳寡糖单体的标记率转换后可以得到该组织中COS2~COS5的质量浓度,进而可以实现不同聚合度壳寡糖单体吸收分布量的比较。

表1 不同聚合度壳寡糖单体荧光标记物的标准曲线方程Table 1 Standard curves for determination of fluorescence labelled COS monomers with different DPs
2.3.2 不同聚合度壳寡糖单体的吸收
壳寡糖的血清质量浓度一定程度上可以反映壳寡糖在体内被吸收的情况[13]。COS2、COS3、COS4和COS5在灌胃后不同时间点的血清质量浓度如图4所示,在给药后0.5 h和1 h,不同聚合度壳寡糖的血清质量浓度为COS2>COS4>COS3>COS5;在给药2 h时,不同聚合度壳寡糖的血清质量浓度为COS2>COS3>COS5>COS4;在给药4 h时,不同聚合度壳寡糖的血清质量浓度为COS2>COS3>COS4>COS5。COS2和COS4在给药后1 h血清质量浓度达到最大,而COS3和COS5在2 h血清质量浓度达到最大;血清中的峰值质量浓度为COS2>COS4>COS3>COS5。

图4 不同聚合度壳寡糖单体的血清质量浓度Fig.4 Serum concentrations of COS monomers with different DPs at different times after administration
2.3.3 不同聚合度壳寡糖单体在不同组织中的分布
图5显示了COS2、COS3、COS4和COS5灌胃后不同时间点在所测各组织中的分布情况。可以看出,壳寡糖能分布到所有被检测的组织中(脑、心、肝、脾、肺和肾)。COS2灌胃0.5 h后,在各组织器官中的分布量依次为肝>肾>心>脾>肺>脑;在1 h和2 h时的分布趋势一样,由高到底依次为肾>脾>心>肝>肺>脑;在4 h时各组织器官中依次为肾>肝>心>脾,肺和脑中未检测到荧光信号;在各组织器官中峰值含量依次为肾>脾>心>肝>肺>脑。COS3灌胃0.5 h后,在各组织器官中的分布量依次为肝>肾>心≈脾≈肺>脑;在1 h的分布量依次为肾>肝>心>脾>肺>脑;在2 h的分布量依次为肾>肝>心>脾>肺,脑组织中未检测到荧光信号;在4 h时各组织器官中的分布量依次为肾>肝>心≈脾,肺和脑中未检测到荧光信号;在各组织器官中的峰值含量依次为肾>肝>心>脾>肺>脑。COS4灌胃0.5 h后,在各组织器官中的分布量依次为肝>肾>心>脾>肺>脑;在1 h的分布量依次为肾>肝>脾>心>肺>脑;在2 h的分布量依次为肾>肝>心>脾,肺和脑组织中未检测到荧光信号;在4 h时各组织器官中的分布量依次为肾>肝>心>脾,肺和脑中未检测到荧光信号;在各组织器官中的峰值分布量依次为肾>肝>脾>心>肺>脑。COS5灌胃0.5 h后,在各组织器官中的分布量依次为肝>肾>心≈脾>肺>脑;在1 h的分布量依次为肾>肝>心>脾>肺>脑;在2 h的分布量依次为肾>肝>心>脾,肺和脑组织中未检测到荧光信号;在4 h时各组织器官中的分布量依次为肾>肝>心>脾,肺和脑中未检测到荧光信号;在各组织器官中的峰值分布量依次为肾>肝>心>脾>肺>脑。

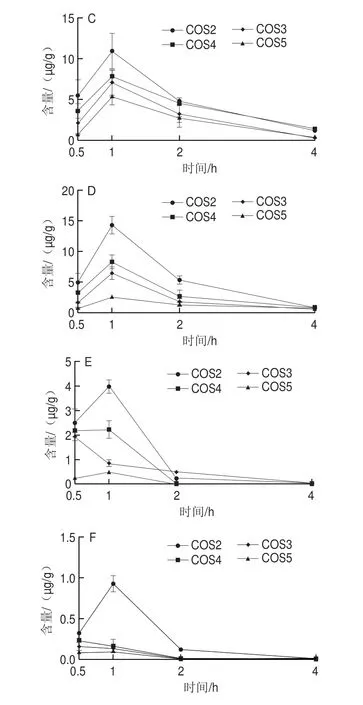
图5 不同聚合度壳寡糖单体在小鼠肾(A)、肝(B)、心(C)、脾(D)、肺(E)和脑(F)中的含量Fig.5 Concentrations of COS monomers with different DPs in kidney(A),liver (B),heart (C),spleen (D),lung (E) and brain (F) tissues at different times after administration
COS2、COS3、COS4和COS5灌胃后0.5~4 h在肾、心、脾、肺和脑组织中的分布量总体呈先升高后降低的趋势,且在1 h达到最大峰值。但是,COS2、COS3、COS4和COS5在肝中的分布量在0.5 h最高,随着时间的延长缓慢下降。COS2、COS3、COS4和COS5在心、脾、肺和脑组织中1 h的分布趋势和血清的峰值浓度趋势具有重合性,均为COS2>COS4>COS3>COS5。而COS2、COS3、COS4和COS5在肝和肾中的分布,不同时间点均为COS5>COS4>COS3>COS2,随着聚合度增加而增加。
3 讨论
壳寡糖的单体结构简单,与体内的多种单糖(葡萄糖、半乳糖等)结构相似,缺乏特征的官能团,经过口服吸收入血含量极低且内源性糖类对其测定也会产生一定的干扰[21]。荧光探针标记操作简单,且荧光的检测敏感性比传统紫外-可见光谱法高3~4 个数量级[22],荧光标记以后,壳寡糖在荧光显微镜、激光共聚焦显微镜、流式细胞仪和双光子激发荧光成像技术等荧光检测仪器下变得“可视化”,从而能够在细胞、组织乃至活体水平上对其进行定位检测[21]。FITC最大吸收光波长为490~495 nm,最大发射光波长为520~530 nm,因具有温度系数低、寿命长、光稳定性好、量子产率高和标记效率高等优点,被用作蛋白质和核酸等生物大分子的荧光探针,在生物医学研究领域已得到广泛的应用,是荧光标记分析方法中常见的方法之一;在碱性条件下,FITC分子中的异硫氰基可通过亲核加成反应与本身具有活性氨基基团的多糖直接共价偶联,完成多糖的FITC荧光标记[23]。FITC作为目前应用最广泛的荧光标记方法之一,已实现了对壳聚糖、麦冬多糖、当归多糖、枸杞多糖、灰树花多糖等多种多糖的标记[24]。已有研究证明FITC标记对壳寡糖的体内吸收代谢几乎没有影响[19],并且FITC在胃肠道消化道内不会从壳寡糖分子上脱落[14]。本研究采用FITC对不同聚合度壳寡糖单体进行标记,每一个聚合度的壳寡糖都有一个游离的氨基,壳寡糖连接FITC的最大结合数即为壳寡糖的聚合度。FITC分子质量为389.4 Da,壳寡糖单糖分子质量为161 Da,故0.2 g壳寡糖可共价结合0.484 g的FITC,即壳寡糖与FITC的质量比为1:2.42[14]。因此选择0.2 g壳寡糖,加入0.5 g FITC进行反应,以保证FITC过量,从而保证壳寡糖单体的标记率。最后,得到4 个标记后的产物FITC-COS2、FITC-COS3、FITC-COS4和FITCCOS5,标记率以质量比公式计算分别为0.69、0.47、0.39和0.33,结果表明随着聚合度增加,壳寡糖的标记率降低,这可能与壳寡糖单体的空间结构有一定的相关性。如果要统一各组壳寡糖单体COS2、COS3、COS4和COS5的灌胃剂量均为65 mg/kgmb,那么每组FITC标记物FITCCOS2、FITC-COS3、FITC-COS4和FITC-COS5的灌胃剂量分别为65/(1-0.69)=210 mg/kgmb、65/(1-0.47)=123 mg/kgmb、65/(1-0.39)=107 mg/kgmb和65/(1-0.33)=97 mg/kgmb。
给小鼠灌胃后,活体成像结果显示FITC-COS4、FITC-COS5的荧光信号基本检测不到。而离体组织成像结果显示,FITC-COS2、FITC-COS3、FITC-COS4和FITC-COS5灌胃小鼠1 h后,在脑、肝、肾和胃肠道均能检测到荧光信号,而在心、脾和血清中则未检测到明显荧光信号,肺中仅FITC-COS4未检测到荧光信号。但是,对解剖的组织处理以后,荧光分光光度计定量检测的结果显示,聚合度2~5的壳寡糖单体均可以吸收入血,能分布到肾、肝、心、脾、肺和脑组织中。这三者实验结果存在矛盾之处。研究表明,动物组织中的成分如水、脂肪、氧血红蛋白、脱氧血红蛋白和黑色素等在200~650 nm波长范围的紫外-可见光区域具有很强的吸收和散射特性,导致FITC荧光染料其组织穿透深度有限,光只可以穿透几百微米到一毫米的深度,组织自身荧光信号强度和摄入食物引起的背景信号强度也比较高,从而可能导致“可视化”水平的检测存在一定的偏差[25-26]。因此,采用活体成像很难进行定量分析,但是采用活体成像技术对离体组织进行观察,可以直观地看到4 个壳寡糖单体均可以跨过血脑屏障分布到脑组织,而实际上进行荧光分光光度计检测时,脑组织中的分布量是最低的。而对于心、脾、血清等血红色的组织,由于浓度低且背景荧光强而导致壳寡糖单体在离体组织成像时检测不到。但是,本实验通过解剖组织进行匀浆处理以后得到澄清透明的液体,不仅可以除去组织和血液中的氧血红蛋白、脱氧血红蛋白,而且可以避免因为穿透深度不够以及背景荧光而导致的结果偏差,进一步确定壳寡糖单体在组织中的分布情况,并进行不同聚合度单体的比较。
胡锦珍[27]的研究结果显示,FITC标记后的壳聚糖,通过荧光分光光度计进行检测,产物在各组织中的决定系数均大于0.9950,在血清和组织样品中的回收率符合药物体内分析的技术要求;标记的产物在各组织液中冷藏24 h和室温贮藏4 h,荧光强度虽然有所下降,但是相对标准偏差均在10%以内,符合药物分析技术要求。因此,本实验根据荧光分光光度计进行定量分析,研究结果显示COS2、COS3、COS4和COS5均能被小肠吸收,但是在血清中的浓度却很低(相比肾、肝、脾和心),这主要与血清高效的壳聚糖清除作用有关。Ricardson等[28]研究发现,125I标记的壳聚糖样品经过静脉注射后很快被血清清除。Chen Ping[29]的研究表明,COS2、COS3、COS4和COS5在肠道的表观渗透系数均大于1h 10-6cm/s,表明壳寡糖在小肠内通过多种方式吸收,被动扩散以及载体蛋白转运并存;COS2、COS3、COS4和COS5的表观渗透系数由高到低依次为COS2>COS4>COS3>COS5,与本次实验各聚合度壳寡糖在血清中峰值浓度趋势表现出一致性。Chen Anshu等[15]研究发现给大鼠口服30 mg/kgmb壳寡糖后,只有COS2和COS3能被小肠吸收入血,并且在给药1 h后血药浓度达到最大,而其他聚合度壳寡糖无法被胃肠道吸收。与本实验结果有一定的矛盾,可能是因为灌胃后COS4和COS5的吸收量低,血液浓度较低,液相色谱的检测方法检出限达不到,也有可能是因为血清中其他杂蛋白和寡糖的影响,屏蔽了壳寡糖信号。陈佳祎[11]在研究壳寡糖体外消化时发现,体外模拟的小肠消化液中,COS2的出峰被影响而不能进行定量。魏鹏等[30]采用高效阴离子交换色谱结合脉冲安培检测器检测非翻转肠囊中壳寡糖吸收,发现COS5和壳六糖检测受到影响,而无法实现检测。而体内实验中,血清和各组织中的组分更加复杂,更加容易受影响。
据文献报道,尿液排出是壳寡糖的主要清除方式[31];本研究表明灌胃1、2 h和4 h后,COS2、COS3、COS4和COS5在肾的分布量最高,在1 h达到峰值后,分布量缓慢降低,表明壳寡糖确实有可能通过尿液在缓慢排泄。肝脏是外源化合物进入体内吸收的第一道屏障[32],因此,壳寡糖在肝脏中的分布是反映吸收情况的一个重要参数[33]。COS2、COS3、COS4和COS5在灌胃后,0.5 h迅速到达肝,随着时间的延长,在肝的含量逐渐降低,各聚合度壳聚糖在肝的含量与聚合度成正比;各聚合度壳寡糖在肝的分布量与其他组织相比明显偏高,说明壳寡糖在肝有一定的累积效应,随着分子质量增加,累积效应增强。这与Zeng Lintao等[13]研究发现壳聚糖在肝中的浓度明显高于其他组织,随着壳聚糖分子质量降低,水溶性增加和肠道吸收率增加。COS2、COS3、COS4和COS5均可以分布到脑组织,这与之前研究所报道低分子质量壳寡糖有良好的血脑屏障通透性[17]是一致的。COS2、COS3、COS4和COS5在心、脾和肺中分布量很少,甚至检测不到,与文献中报道的壳寡糖主要分布在有大血管分布的器官(肝和肾)中[34]具有一致性。
4 结论
本研究通过体内研究发现聚合度2~5的壳寡糖单体均可以吸收入血,分布到肾、肝、心、脾、肺和脑组织中,在肝和肾中的分布与聚合度呈正相关,在其他组织中和血清中的峰值分布呈现出相同的趋势(COS2>COS4>COS3>COS5)。此外,本研究表明聚合度2~5的壳寡糖可以跨越血脑屏障这一障碍,在中枢神经系统相关疾病的研究中有着天然的优势和潜力。聚合度2~5的壳寡糖在肾脏中的分布量最高,且在1 h到达峰值以后,含量下降缓慢,有一定的蓄积趋势;在肝脏的分布量随着聚合度的增加而增加。本实验可为预防脂肪肝、肝癌、肾癌等肝脏和肾脏相关的疾病提供一定的理论参考。明确不同聚合度壳寡糖单体的体内吸收分布的差异性,对于壳寡糖的构效关系以及功能活性机制研究具有一定的指导意义,有助于促进壳寡糖在食品功能性食品的开发和应用。
