双频超声联合柠檬酸处理对大黄鱼冷藏期间品质变化的影响
2023-02-12朱圣赟蓝蔚青浦天霆赵欣宇徐振飞
朱圣赟,蓝蔚青,2,*,浦天霆,赵欣宇,徐振飞,谢 晶,2,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
大黄鱼(Pseudosciaenacrocea)又名大黄花、黄瓜鱼,主要分布于我国东海、黄海、台湾海峡和南海北部,与小黄鱼、带鱼、墨鱼并称为“四大经济鱼类”,现为我国最大的海水网箱养殖鱼类[1]。近年来,我国大黄鱼的养殖产量逐年递增,据统计,2021年我国大黄鱼的养殖产量高达25.42万 t,相较于2020年增幅为0.06%[2]。吴靖娜等[3]经研究得出,大黄鱼氨基酸种类齐全、比例均衡,是一种优质的蛋白源。同时,大黄鱼富含多种常量及微量元素,脂肪酸种类丰富,且肉质鲜嫩细腻,深受消费者喜爱。然而,由于微生物与内源酶的作用,大黄鱼肌肉中的不饱和脂肪酸和可溶性蛋白会迅速降解,影响其货架期和商业价值[4]。因此,亟需寻求一种合适的处理方式以保证其品质,延长贮藏货架期。
超声为一种由振动频率超过人类听力上限(20 kHz)的波所产生的能量形式[5],是非电离、非侵入、非污染形式的机械能[6]。其被广泛应用于食品的冷冻、解冻、肉类腌制、抑菌及嫩化等方面。当超声波在液体中传播时,由于压力变化,其与液体和溶解气体间的相互作用会产生空化气泡[7],即超声的“空化”现象。在一定条件下,空化效应可使致病真菌和细菌的结构发生变化,导致其死亡[8]。近年来,有学者研究证实了将超声应用于水产品保鲜的可行性[9]。周大鹏等[10]使用超声处理海鲈鱼得出,超声处理可较好抑制鱼肉样品贮藏期间的微生物生长,延缓pH值与总挥发性盐基氮(total volatile base nitrogen,TVB-N)含量升高,至少延长海鲈鱼冷藏货架期2 d。目前,学者对于水产品超声处理的研究大多集中于单频超声,而Sivakumar等[11]研究发现,相对于单频超声,双频超声(dual-frequency ultrasound,DUS)具有更高能效;Zhao Xinyu等[12]研究发现,与单频超声相比,20/28 kHz、175 W DUS处理大黄鱼10 min可使大黄鱼在冷藏期间保持更高的持水力(water-holding capacity,WHC),延缓pH值与TVB-N含量的升高,抑制微生物生长。
柠檬酸(citric acid,CA)又名枸橼酸,是由玉米为原料,经发酵、提取和精制等复杂化学工艺制成的物质,其安全无毒,生物体可直接吸收代谢[13]。CA在食品卫生行业中应用较广,具有一定抑菌性。例如,王浚杰[14]研究发现,CA可有效抑制枯草芽孢杆菌、大肠杆菌与金黄色葡萄球菌生长。此外,CA作为一种金属螯合剂,具有抗氧化能力;其较低的pH值可抑制酶活力,延长食品货架期。田光娟[13]在冷藏条件下采用不同浓度的CA对鲫鱼鱼片进行浸渍处理,结果表明鱼片中的细菌总数明显低于空白对照组,CA能够抑制微生物的生长,保鲜效果良好。现有研究表明,超声波与抑菌剂联合作用可改善微生物控制效果[15-16]。He Qiao等[15]研究百里香精油纳米乳对于大肠杆菌O157:H7细胞的抑制作用时发现,超声通过物理损伤和破坏膜脂稳态可使细菌细胞膜崩解,使大肠杆菌数量减少2.16~7.10 个对数值,表明超声对抑菌剂的增强效果显著;Liu Bing等[16]研究发现超声联合竹叶抗氧化剂可有效抑制扇贝冷藏期间的蛋白质和脂质氧化,减缓细菌的生长速度,保持较好的微观结构和纹理特性。
目前,关于DUS结合生物保鲜剂的研究还较少。本实验拟采用DUS联合CA处理大黄鱼,通过检测微生物(菌落总数(total viable count,TVC)、嗜冷菌数(psychrophilic bacteria count,PBC))、理化(pH值、TVB-N含量、硫代巴比妥酸反应物(thiobarbituric acid reaction substance,TBARS)值、质构剖面分析(texture profile analysis,TPA)与色差)、水分迁移(低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)、核磁共振成像(magnetic resonance imaging,MRI)与WHC)等指标,结合感官评价分析不同处理方式对大黄鱼冷藏期间品质变化影响,旨在找到一种安全方便、环境友好的水产品保鲜方式,为延长水产品货架期提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活大黄鱼购自上海市浦东新区芦潮港海鲜批发市场,体长(320f 10)mm,体质量(500f 20)g。
食品级无水CA 中粮生化能源(榆树)有限公司;平板计数琼脂 青岛海博生物科技有限公司;三氯乙酸、硫代巴比妥酸、氧化镁、体积分数95%乙醇溶液、氯化钠国药集团化学试剂有限公司。试剂均为国产分析纯。
1.2 仪器与设备
XEDT-II型多频超声低温平台 济宁谐成超声波设备有限公司;Kjeltec8400型凯氏定氮仪 瑞典FOSS公司;Meso MR23-060H-I型低场核磁共振分析及成像系统 上海纽迈电子科技有限公司;TA.XT Plus型质构仪 英国Stable Micro Systems公司;YS6080型台式分光测色仪 深圳市3nh有限公司;FE20型pH/ORP计上海而立环保科技有限公司。
1.3 方法
1.3.1 原料预处理
将鲜活大黄鱼置于泡沫箱中,加入冰块使其猝死,从中间将鱼分割成两片,用蒸馏水洗净沥干。依据Zhao Xinyu[12]和田光娟[13]等研究方法进行预实验,最终确定超声和CA处理条件,其中质量浓度8.0 g/L为CA最适质量浓度。将鱼片随机分为4 组,其中对照组(CK组)使用无菌蒸馏水浸渍处理样品10 min;DUS处理组(DUS组)将样品和无菌蒸馏水放入无菌袋中,用20/28 kHz、175 W DUS处理10 min;CA处理组(CA组)使用质量浓度8.0 g/L CA溶液浸渍10 min;DUS-CA联合处理组(DUS+CA组)将样品和质量浓度8.0 g/L CA溶液放入无菌袋中,用20/28 kHz、175 W DUS处理10 min。处理完毕后将所有样品沥干后放入聚乙烯无菌袋中,密封后置于4 ℃冰箱中冷藏14 d,每2 d进行微生物指标、理化指标、水分迁移特性测定和感官评价。
1.3.2 微生物指标测定
根据GB 4789.2-2022《食品安全国家标准 食品微生物学检验 菌落总数测定》[17]方法进行TVC和PBC测定。将5 g样品和45 mL无菌生理盐水置于无菌袋中均质,10 倍系列稀释后加入平板计数琼脂培养基并混匀,倒置培养。每个组选取3 个适宜稀释度且每个稀释度做3 个平行。TVC在(30f 1)℃下倒置培养(72f 3)h后计数;PBC在(4f 1)℃下倒置培养240 h后计数。
1.3.3 理化指标测定
1.3.3.1 pH值测定
参照GB 5009.237-2016《食品安全国家标准 食品pH值的测定》[18]进行分析。准确称取5 g碎鱼肉,加入45 mL蒸馏水,静置30 min后用pH计进行测定,每组样品平行测定3 次。
1.3.3.2 TVB-N含量测定
参照GB 5009.228-2016《食品安全国家标准 食品挥发性盐基氮的测定》[19]。准确称取5 g碎鱼肉置于消化管中,加入氧化镁,采用凯氏定氮仪进行分析,每组样品平行测定3 次。
1.3.3.3 TBARS值测定
参照Sun Yuqing等[20]方法测定TBARS值,准确称取5 g碎鱼肉,加入20 mL蒸馏水及25 mL体积分数20%三氯乙酸溶液,均质1 min后静置1 h,8000 r/min、4 ℃条件离心10 min后过滤,取上清液定容至50 mL,摇匀后取5 mL定容液于试管,加入5 mL硫代巴比妥酸溶液混匀,于沸水浴中加热20 min。冷却至室温后于532 nm波长处测定吸光度,结果以每千克样品中含有的丙二醛(malondialdehyde,MDA)含量表示,单位为mg/kg,每组样品平行测定3 次。
1.3.3.4 质地剖面分析
参照吴怡等[21]方法稍作修改,取样时将样品切成方块(2.0 cmh 2.0 cmh 1.5 cm)。采用平底探头P/5=5 mm,测试类型为压缩模式。检测参数设定为压缩比例为40%、测量前探头速率为3.00 mm/s、测定速率为1.00 mm/s、两次下压间隔时间5 s、触发力5 g。测定并记录样品的硬度、弹性与咀嚼性,每组样品平行测定6 次。
1.3.3.5 色差测定
采用色度仪测定样品的亮度(L*值)、红度(a*值)及黄度(b*值)。每个样品至少测定5 个位点,取平均值。
1.3.4 水分迁移特性分析
1.3.4.1 LF-NMR与MRI分析
参照Zhao Yanan等[22]方法进行LF-NMR弛豫分析。采用Carre-Purcelle-Meiboome-Gill(CPMG)序列测定横向弛豫时间(T2)。利用上海纽迈电子科技有限公司提供的软件对大黄鱼的质子密度加权MRI图像进行统一绘图和伪着色。
1.3.4.2 WHC测定
精确称取3 g鱼肉样品,并记录初始质量m1,用滤纸包裹好放入离心管,于8000 r/min、4 ℃条件下离心10 min,离心结束后将样品取出并记录质量m2,平行测定3 次。按下式计算WHC。
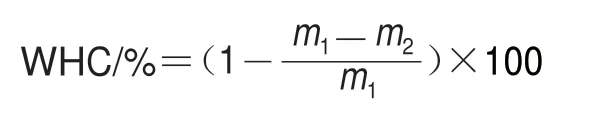
式中:m1为样品离心前质量/g;m2为样品离心后质量/g。
1.3.5 感官评价
参照王蒙等[23]方法进行感官评价。由5 名经验丰富的感官小组成员进行感官分析。评估每个鱼片的感官特征(黏性、气味、质地)。4.0~5.0表示感官品质良好,3.0~4.0表示感官品质可接受,2.0~3.0表示感官品质不可接受,1.0~2.0表示非常不喜欢。
1.4 数据处理与分析
每组样品平行测定3 次,记录数据后采用SPSS Statistics 26软件进行数据分析,采用单因素方差分析法对数据差异显著性进行分析,结果以平均值±标准差表示,P<0.05为差异显著;采用Origin 2021软件作图。
2 结果与分析
2.1 不同处理方式对大黄鱼冷藏期间TVC和PBC的影响
水产品自身携带的或生长环境中的细菌微生物是导致水产品发生腐败变质的主要原因之一[13]。在贮藏过程中,细菌不断分解蛋白质,某些微生物如假单胞菌属、无色杆菌属、产碱杆菌属等细菌会利用游离氨基酸生成具有不良气味的硫化物、胺、有机酸等,使感官品质不可接受[24]。
国际食品微生物标准委员会指出淡水鱼和海洋物种的微生物腐败限值对数值为7.0(lg(CFU/g))[22]。由图1A可知,所有处理组的TVC均呈上升趋势。第8天时,CK、DUS、CA组以及DUS+CA组样品的TVC分别达到(8.26f 0.02)、(7.61f 0.03)、(6.60f 0.06)、(5.89f 0.11)(lg(CFU/g)),其中CK组和DUS组样品超过腐败限值,且DUS组样品的TVC显著低于CK组(P<0.05),表明DUS处理具有一定的抑菌效果,可能由于超声的空化效应使真菌和细菌的结构发生变化,导致其死亡,起到杀菌作用[8]。CA组和DUS+CA组样品的TVC分别于第12天和第14天超过腐败限值,且在整个贮藏期内的TVC显著低于CK组(P<0.05),表明CA抑菌效果良好。这是由于CA的低pH值引起细菌细胞膜电荷改变,影响细菌生长;或由于CA可能会干扰细菌细胞中酶的某些功能,抑制三羧酸循环中琥珀酸脱氢酶和α-酮戊二酸的作用,通过抑制能量代谢中磷酸化酶的功能达到抑菌的作用[25]。熊海燕等[26]发现,CA对革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌)和革兰氏阴性菌(大肠杆菌)均有较强的抑菌效果,本研究结果与其相似。
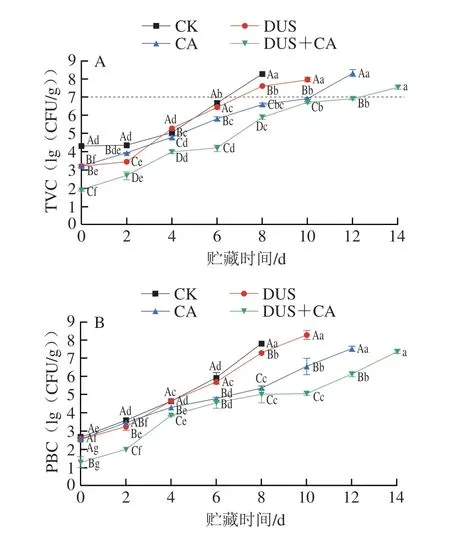
图1 不同处理方式对大黄鱼冷藏过程中TVC和PBC的影响Fig.1 Effects of different treatments on TVC and PBC in Pseudosciaena crocea during refrigerated storage
由以上结果可知,各处理方式对大黄鱼冷藏期间微生物的增长均能有效抑制,其中DUS+CA处理的抑菌效果最佳,表明超声和CA具有协同作用。由于超声波的空化效应,CA可渗透至大黄鱼肌肉中[16],更好地发挥CA的抑菌作用;超声波可使CA离解形成离子形式,降低溶液的pH值,这会破坏细胞酶和营养物质运输系统,抑制细菌生长[27]。由图1B可知,DUS+CA联合处理组的效果最佳,PBC的整体变化趋势与TVC一致。
2.2 不同处理方式对大黄鱼冷藏期间pH值与TVB-N含量的影响
pH值是判定鱼类产品新鲜程度的重要指标之一,其变化与微生物的生长、蛋白质和脂肪的分解密切相关[28]。
由图2A可知,所有样品的pH值在贮藏过程中均呈V型变化趋势。贮藏前期样品pH值下降可能由于水产品死后在初期僵直阶段,体内糖原发生糖酵解反应,产生乳酸;或由于吸收了空气中的CO2,使pH值下降[29],后期样品pH值的增加可能由于蛋白质降解产生了氨、胺和碱性物质[30]。因此,一般情况下贮藏末期样品pH值越低表明腐败程度越低。贮藏前期DUS组样品pH值显著高于其他组(P<0.05),可能由于DUS处理延迟僵直阶段,使pH值上升[31]。CA组和DUS+CA组样品pH值始终较低,其中DUS+CA组在贮藏后期依然保持最低,一方面可能由于CA自身具有酸性;另一方面,联合处理可较好抑制微生物生长,减缓蛋白质分解,使pH值处于较低状态。
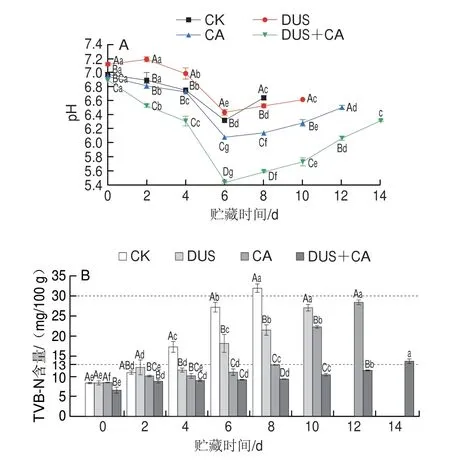
图2 大黄鱼冷藏过程中不同处理方式对pH值(A)与TVB-N含量(B)变化的影响Fig.2 Effects of different treatments on pH (A) and TVB-N content (B)of Pseudosciaena crocea during refrigerated storage
TVB-N是指动物性食品在细菌和酶的作用下分解蛋白质产生的氨以及胺类等碱性含氮物质,其含量是判定鱼类产品新鲜程度的重要指标[32]。根据SC/T 3101-2010《鲜大黄鱼、冻大黄鱼、鲜小黄鱼、冻小黄鱼》,TVB-N含量≤13 mg/100 g属于一级品,TVB-N含量≤30 mg/100 g属于合格品[33]。
如图2B所示,第0天时CK、DUS、CA组样品的TVB-N含量无明显差异(P>0.05),随着贮藏时间的延长,CK组样品的TVB-N含量增加趋势较为明显,表明鱼肉迅速进入腐败阶段,第8天时达到(31.84f 1.05)mg/100 g,已超过腐败限值,显著高于其他组(P<0.05)。DUS组和CA组样品分别于第6、10天超过一级鲜度,其TVB-N含量分别为(18.21f 2.23)mg/100 g与(22.29f 0.32)mg/100 g;而DUS+CA组样品于第14天才超过一级鲜度,TVB-N含量为(13.79f 0.57)mg/100 g。联合处理组样品的TVB-N含量上升速度明显缓于其余各组,此结果与微生物指标分析结果具有一定相关性,DUS的空化效应可使致病真菌和细菌的结构发生变化,导致其死亡[8],使蛋白质免于被细菌分解,减少氨与胺类等碱性含氮物质的生成;同时,CA具有一定的抑菌作用[14],其较低的pH值可抑制酶的活性,延缓蛋白质的分解与TVB-N含量上升。
2.3 不同处理方式对大黄鱼冷藏期间TBARS值的影响
食物中的脂质易受氧化反应的影响,造成脂溶性维生素和其他生物活性化合物损失,且易产生异味。脂质氧化的次生产物也可与氨基酸、蛋白质和多肽发生反应,导致必需氨基酸的损失、蛋白质或多肽结构发生变化及功能丧失[34]。TBARS值的测定原理是不饱和脂肪酸经过氧化得到的降解产物MDA与硫代巴比妥酸反应生成稳定的红色化合物,可反映水产品脂肪氧化酸败程度[35]。
由图3可知,所有组别的TBARS值整体呈上升趋势,其中贮藏前期DUS组的TBARS值高于CK组,如第4天时CK组的TBARS值为(0.40f 0.01)mg/kg,而DUS组达到(0.51f 0.04)mg/kg,可能由于超声产生的活性氧会引发脂质的自由基氧化,导致MDA含量增加[36];CA组和DUS+CA组在整个贮藏期间TBARS值均低于CK组和DUS组,说明CA具有良好的抑制脂肪氧化的作用,可能由于CA能抑制脂肪细胞内肉碱脂酰转移酶1的活力,抑制脂肪酸的β-氧化分解[37],延缓了脂肪氧化产生MDA,降低其MDA含量。此外,贮藏期间DUS+CA组TBARS值显著低于其他组(P<0.05),抑制脂肪氧化效果最佳,表明DUS和CA联合处理对抑制脂质氧化有积极作用,这是由于超声作用促进了CA的渗透[16],可螯合金属离子,阻止活性氧的产生,从而抑制机体内的氧自由基攻击生物膜中的多不饱和脂肪酸,延缓脂质过氧化,降低MDA含量[38]。Liu Bing等[16]研究发现,超声和抗氧化剂联合处理具有协同抗氧化的作用;Lan Weiqing等[9]研究发现,超声和微酸性电解水联合处理可有效抑制鲈鱼TBARS值的增加,与本研究结果相似。
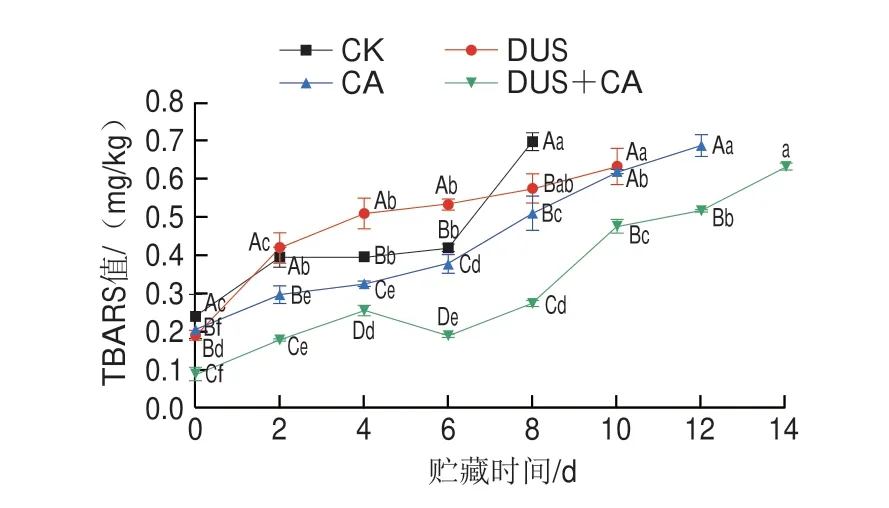
图3 大黄鱼冷藏过程中不同处理方式对TBARS值变化的影响Fig.3 Effects of different treatments on TBARS value of Pseudosciaena crocea during refrigerated storage
2.4 不同处理方式对大黄鱼冷藏期间质构特性的影响
由表1可知,各组样品硬度、弹性、咀嚼性均呈下降趋势,这是由于在贮藏过程中鱼体内微生物的分解和自溶作用导致蛋白质和肌肉纤维组织遭到破坏,鱼片的质构特性随之下降[39]。整体而言,DUS组样品的硬度在整个贮藏期间小于CK组,可能由于超声处理可增大肌肉纤维和肌肉束的空间,促使结缔组织的降解,使肉嫩化[5]。DUS+CA组样品的硬度在贮藏前期较低,可能由于DUS辅助CA渗透入鱼肉中,CA降低了肉(包括高结缔组织含量的肉类)的机械阻力,使其质地变软[40]。贮藏后期CA组和DUS组样品的硬度、弹性、咀嚼性保持在相对较高水平,可能由于CA减弱了微生物对鱼肉蛋白质和肌肉组织的破坏作用,其中DUS+CA处理可更好地维持蛋白质和肌肉纤维的空间结构。
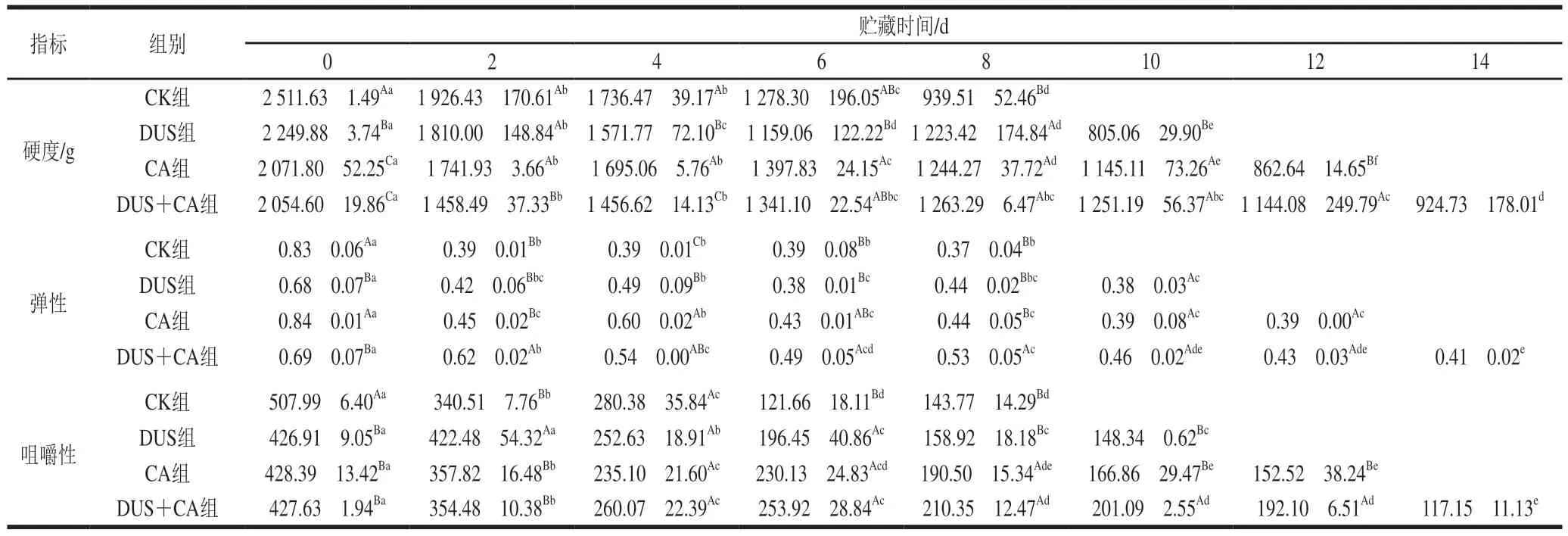
表1 不同处理方式对大黄鱼冷藏过程中质构特性的影响Table 1 Effects of different treatments on texture properties of Pseudosciaena crocea during refrigerated storage
2.5 不同处理方式对大黄鱼冷藏期间色差的影响
色泽是判断鱼肉品质的重要指标之一,其中亮度(L*值)、红度(a*值)和黄度(b*值)是评价肉色的重要指标。L*值越大表明肉色越亮,a*值越大表明肉色越红[41]。
由表2可知,随着贮藏时间的延长,CK组样品的L*值呈下降趋势,与Zhuang Shuai等[42]的研究结果一致;b*值呈上升趋势,这与Li Yilin等[43]的研究结果一致。DUS组样品的L*值整体高于CK组,且第6、8天与CK组差异显著(P<0.05);DUS组样品的L*值较高可能由于超声处理使蛋白网络结构更有序致密,有效保留了鱼肉内部水分,提升其亮度[44]。CA组和DUS+CA组样品的L*值在整个贮藏期间相对CK组均处于较高水平,可能由于CA的pH值达到了鱼肉蛋白的等电点,使鱼片表面的蛋白质发生轻微变性和沉淀,肉色变白变亮[42];此外,在低温酸性条件下,美拉德反应易受到抑制,且在CA浸渍过程中,鱼片中的部分色素也可能溶出,导致L*值较高[45]。各组鱼肉的a*值和b*值基本无显著规律,可能与鱼样间存在差异有关[22]。
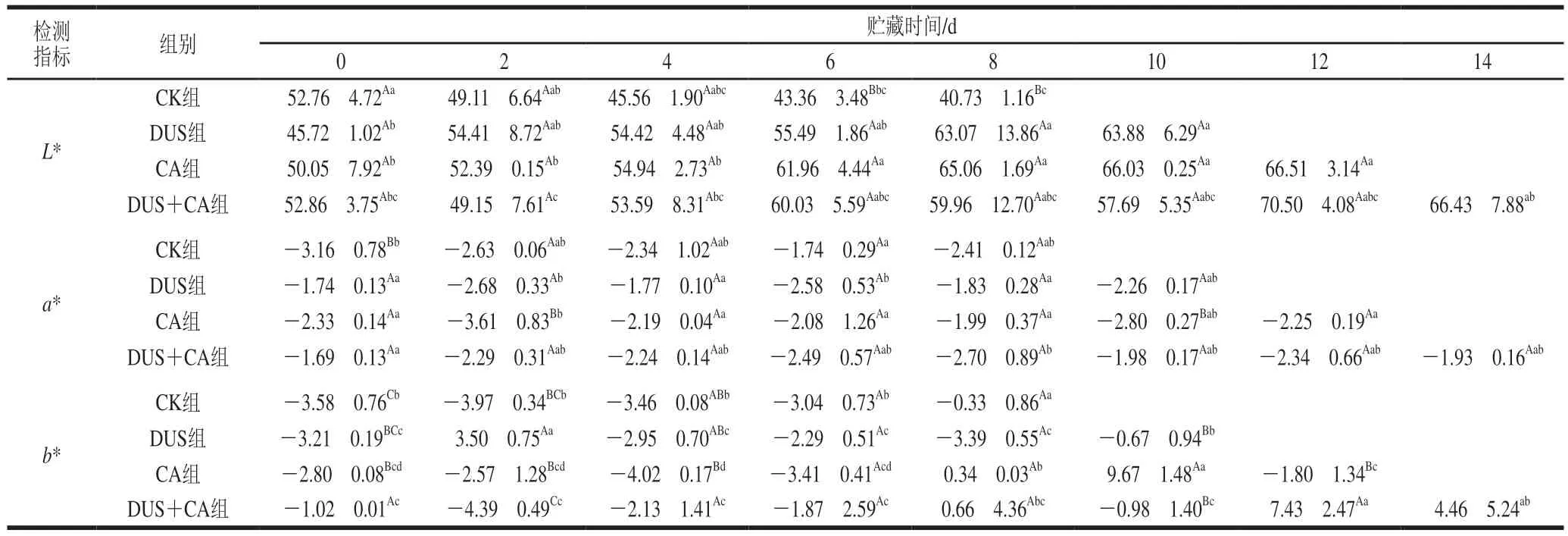
表2 不同处理方式对大黄鱼冷藏过程中色差变化的影响Table 2 Effects of different treatments on color parameters of Pseudosciaena crocea during refrigerated storage
2.6 不同处理方式对大黄鱼冷藏期间水分迁移的影响
2.6.1 LF-NMR与MRI
LF-NMR通过分析横向弛豫时间T2,了解鱼肉样品内部的水分分布以及流动性,得出不同处理方式的大黄鱼在冷藏过程中的水分迁移状况。T2由T21(<10 ms)、T22(10 ms<T22<100 ms)、T23(>100 ms)组成,分别代表结合水、不易流动水与自由水[46]。
由图4A可知,所有组别的T21峰面积在整个贮藏期间内变化不大,说明样品中的结合水较为稳定;而随着贮藏时间的延长,每个组的T22峰面积均呈下降趋势,说明不易流动水发生迁移,可能由于在贮藏过程中,鱼肉肌原纤维蛋白的降解使肌原纤维结构遭到破坏,不易流动水受鱼肉内部束缚力小、水分活跃度高且流动性强,导致不易流动水向自由水转化,使其含量逐渐下降[46]。
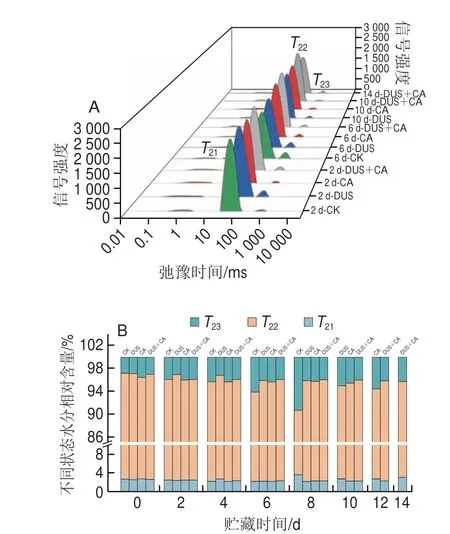
图4 不同处理方式对大黄鱼冷藏过程中弛豫时间(A)与水分相对含量(B)变化的影响Fig.4 Effects of different treatments on transverse relaxation time (A) and water distribution (B) in Pseudosciaena crocea during refrigerated storage
结合图4A、B可知,DUS组样品的T22始终保持稳定且高于CK组,表明DUS处理对大黄鱼的保水性具有积极作用,这与周大鹏等[47]的研究结果一致,可能由于超声处理使大黄鱼蛋白的亲水基团暴露,提高了蛋白与水的结合能力[48]。CK组样品的自由水(T23)呈大幅上升趋势,且CK组样品的T23于第6天起超过CA、DUS+CA组,表明CK组样品随着贮藏时间的延长,肌原纤维蛋白逐渐降解,不易流动水流失,鱼肉趋于腐败。CA组与DUS+CA组样品的T22虽然在贮藏前期较CK组和DUS组低,但随着贮藏时间的延长,T22仅缓慢下降,并未出现如CK组大幅度下降的情况,而T23也上升缓慢。贮藏前期CA组和DUS+CA组样品的T22小于CK组和DUS组,可能由于CA在结缔组织和细胞膜的降解中的作用降低了持水能力;此外,CA的酸性使样品处于酸性环境中,较低的pH值会引起蛋白质变性,改变蛋白质-蛋白质和蛋白质-水间的化学平衡,促进水分释放[40]。贮藏后期CA、DUS+CA组样品的T22依然趋于稳定,其中DUS+CA组样品的水分更不易流失,可能由于CA可较好地抑制酶活力与微生物的生长,减缓鱼肉蛋白质的分解,使肌原纤维结构免于被破坏;DUS暴露了蛋白的亲水基团,使水的流动性降低,水分不易迁移[46]。
MRI可直观反映大黄鱼肌肉组织的空间形态、内部形态和分子分布。质子密度高则显示为红色,表明水分含量高;质子密度低则显示为蓝色,表明水分含量低[49]。由图5可知,随着贮藏时间的延长,所有组别的样品均有由红色逐渐变黄的趋势。其中以CK组变化最明显,CK组样品第8天已达到亮黄色,表明其水分流失非常严重,此时DUS+CA组样品依然显示红色,较其他3 组颜色偏红;DUS+CA组样品在14 d时仍为橙红色,水分流失较缓,表明DUS+CA联合处理对样品水分保持具有积极作用,这与LF-NMR结果一致。

图5 冷藏过程中不同处理方式的大黄鱼MRIFig.5 MRI of Pseudosciaena crocea subjected to different treatments during refrigerated storage
2.6.2 持水力
WHC是指当肉受到外力作用时对肌肉本身所含的水分及添加到肉中水分的保持能力[50]。WHC是评定鱼肉品质的重要指标之一,其大小与鱼肉的风味、色泽、质构、凝结性及多汁性等密切相关[50]。
由图6可知,新鲜大黄鱼的WHC为(66.00f 0.01)%,所有组别样品的WHC在整个贮藏期间均有不同程度下降,可能是鱼类蛋白质-水相互作用的不稳定性、肌原纤维蛋白降解以及细菌生长和其他肌肉结构变化导致细胞外空间增加[51],使WHC下降。CA组和DUS+CA组样品第0天的WHC显著低于CK组和DUS组(P<0.05),与LF-NMR结果相似。可能是CA降解了结缔组织和细胞膜,使鱼肉持水能力减弱;其较低的pH值可引起蛋白质变性从而破坏了蛋白质-水间的化学平衡,使WHC降低[40]。贮藏期间,CK组和DUS组样品的WHC下降迅速,且于第6天起低于CA和DUS+CA组。结合TVC和PBC实验数据分析,可能是贮藏后期鱼肉中的微生物大量繁殖,使蛋白质快速降解,造成水分流失。CK组样品在第8天时的WHC降至(57.63f 0.01)%,而DUS+CA组样品WHC依然保持在(61.97f 0.00)%。从第10天起,DUS+CA组样品的WHC显著优于其余各组(P<0.05)。结合图5的MRI可直观看出,贮藏后期DUS+CA组样品的颜色于贮藏后期为橙红,含水量高于其他组,说明DUS和CA联合处理能保持大黄鱼中的水分稳定。
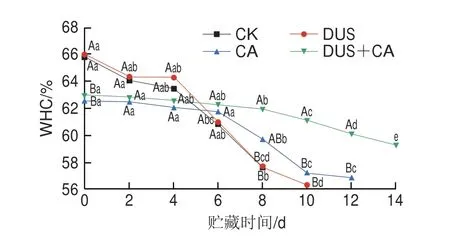
图6 不同处理方式对大黄鱼冷藏过程中WHC变化的影响Fig.6 Effects of different treatments on WHC of Pseudosciaena crocea during refrigerated storage
2.7 不同处理方式对大黄鱼冷藏期间感官评分的影响
感官评价是评价水产品质量的重要指标之一,其可反映消费者对于目标食品的可接受程度和购买意愿。由图7可知,各组样品黏性、气味、质地的感官评分在第0天无明显差异,随着时间的延长,各组感官评分都有所下降。第8天时,CK组样品的黏液浓稠并浑浊,腥味明显,弹性较差,而此时处理组的感官评分均优于CK组。从第0天至第10天,DUS+CA组样品的黏性和气味都在可接受范围内,且其气味在第14天依然可接受,而其质地从第8天起不可接受,这可能与TPA中的硬度降低相关。
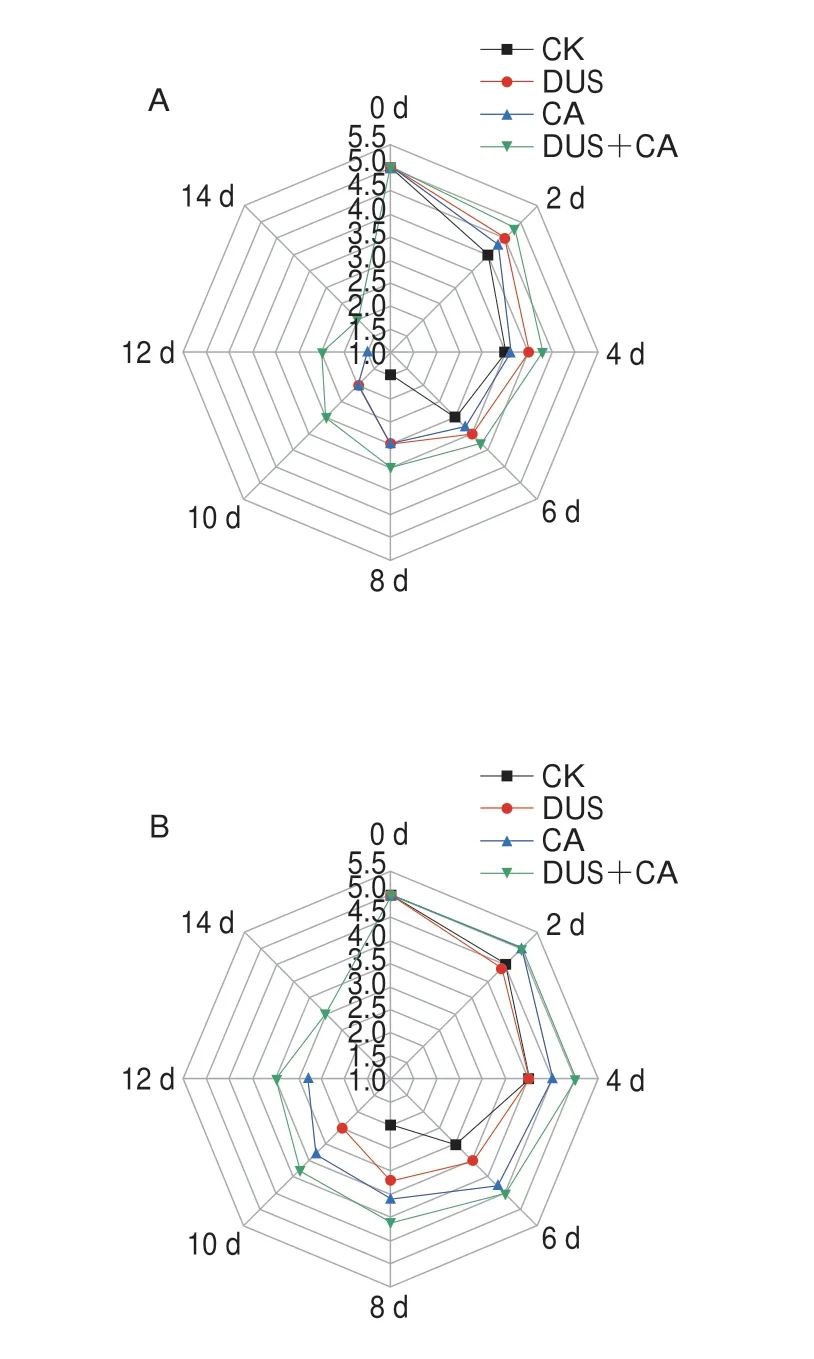

图7 不同处理方式对大黄鱼冷藏过程中感官评分的影响Fig.7 Effects of different treatments on sensory scores of Pseudosciaena crocea during refrigerated storage
2.8 相关性分析结果
由表3可知,微生物指标(TVC、PBC)与其他指标存在显著相关性,其与TVB-N含量、TBARS值、WHC、硬度呈极显著相关(P<0.01),表明微生物对鱼肉在冷藏过程中TVB-N含量、TBARS值、WHC和硬度变化有较大影响。样品TVB-N含量与TVC、PBC、TBARS值极显著正相关(P<0.01);WHC、硬度与TVC、PBC极显著负相关(P<0.01)。大黄鱼在贮藏过程中,鱼体蛋白受微生物和内源酶的作用,产生胺类等碱性物质,其TVB-N含量显著上升,pH值升高[32];鱼体内微生物的分解和自溶作用导致蛋白质和肌肉纤维组织遭到破坏,使硬度下降,WHC相应减弱[45-46]。

表3 不同方式处理大黄鱼冷藏期间的指标相关性分析Table 3 Correlation analysis between different quality indicators of Pseudosciaena crocea subjected to different treatments during refrigerated storage
3 结论
通过对不同处理方式对大黄鱼冷藏期间品质变化的影响研究,结果得出CA与DUS处理均能有效抑制大黄鱼冷藏期间微生物的生长;延缓TVB-N含量和TBARS值的升高,其中联合处理效果最佳。通过水分指标分析和TPA得出,DUS对鱼肉的WHC具有积极作用,可有效延缓水分流失,改善肉质,达到嫩化效果。CA较低的pH值抑制了酶活力和微生物的生长,延缓了蛋白质分解和TVB-N含量升高;其螯合金属离子的能力使其可较好抑制鱼肉脂肪氧化。结合各项指标分析得出,双频超声可辅助保鲜剂更好地发挥其对鱼类的保鲜作用。综合各项指标得出,DUS联合CA处理可使鱼肉品质保持较好状态,保鲜效果最佳。通过TVC与TVB-N含量分析,与CK组相比,20/28 kHz、175 W DUS联合质量浓度8.0 g/L CA处理,可使大黄鱼的冷藏货架期至少延长6 d。
