纤维素甲基丙烯酸酯水凝胶的制备及重金属离子吸附性能研究
2023-02-11陈旭王硕汤相宇吴明宇肖泽芳王永贵谢延军
陈旭,王硕,汤相宇,吴明宇,肖泽芳 ,王永贵,谢延军
(东北林业大学 材料科学与工程学院,哈尔滨 150040)
0 引言
随着农业工业的快速发展,区域铅汞的排放导致的土壤和水源的重金属污染日益严重,尤其是快速增长的汽车运输使得含有铅汞的汽车尾气随着雨水进入土壤和水源[1-2]。土壤和水源作为自然生态环境的基础,重金属含量的上升会导致水生动物和植物的生长发育受限并在他们体内聚集,从而导致人们通过饮食引发重金属中毒,对人类生活安全造成危害。重金属污染可以通过在土壤和水源中加入可吸附胶体的方法,将土壤和水源中的重金属富集到可回收胶体中,从而降低土壤和水源的重金属含量,实现生态环境的安全保护[3]。水凝胶由于良好的亲水性而被广泛用于污水中金属离子的去除,其三维网络结构为金属离子渗透提供了通道和存储空间。
生物质基水凝胶吸附剂具有来源广泛、成本低廉[4-5]、可再生及可生物降解等优点,受到越来越多的关注[6-8]。纤维素具有大量的活性羟基可作为吸附位点,但其吸附能力有限。为了提高纤维素基水凝胶对染料的吸附能力,研究人员对其进行了改性或将纤维素与其他材料结合制备复合水凝胶[9],通过可见光引发聚合制备羧甲基纤维素钠/聚(丙烯酸)微凝胶,对阳离子染料亚甲基蓝的去除率可达97%,吸附容量达1 479 mg/g。Zhou等[10]报道了一种羧化纤维素纳米原纤维填充磁性壳聚糖水凝胶微球型吸附剂对Pb2+的去除率约为90%,吸附容量为171 mg/g。Granstrom 等[11]利用离子液体均相条件下的绿色酯化反应,制备了一种新颖的具有纤维素物理效应与烷基链相结合的纤维素多孔气凝胶材料。
利用离子液体溶解纤维素,在均相条件下利用酸酐与纤维素发生酯化反应合成的纤维素酯具有更高的反应活性,以此制备可用于重金属离子吸附的水凝胶用于处理土壤及水中的重金属离子是可行的。本研究以杨木木粉提取的纤维素为原料,通过酯化反应制备纤维素甲基丙烯酸酯(CM),旨在提高纤维素的反应活性,随后通过热引发交联反应制备纤维素甲基丙烯酸酯凝胶,并利用3-巯基丙酸(MA),L-半胱胺盐酸盐(CH)紫外引发巯基-烯制备改性甲基丙烯酸酯改性水凝胶赋予改性水凝胶。本研究不仅为重金属污染的处理提供一条有效途径,同时实现了农林废弃物的高值化利用,对资源利用和环境保护具有一定的指导意义。
1 材料与方法
1.1 试验材料
硝酸(65%),购于天津科密欧化学试剂有限公司;硝酸锌、硝酸铜、硝酸汞、硝酸镉、硝酸钴、 1-丁基-3-甲基咪唑氯盐、 吡啶(无水级)、甲基丙烯酸酐、 乙醇、 二甲基亚砜(DMSO)、过硫酸铵(APS)、3-巯基丙酸(MA)、L-半胱胺盐酸盐(CH)、氢氧化钠、盐酸和氘代DMSO均为分析纯,购于上海阿拉丁化学试剂有限公司;杨木纤维素为实验室自制。
1.2 纤维素甲基丙烯酸酯(CM)的合成
纤维素原料是根据之前文献中报道的方法在杨木木粉中纯化提取制得[12]。CM的合成反应如图1所示。

图1 纤维素甲基丙烯酸酯合成机理Fig.1 Synthesis mechanism diagram of cellulose methacrylate
取20 g 1-丁基-3-甲基咪唑氯盐和1 g纤维素置于100 mL的三口烧瓶中,在100 ℃ 条件下搅拌至纤维素完全溶解。然后将纤维素溶液温度降至80 ℃,依次向三口烧瓶中加入9.13 mL吡啶和8.86 mL甲基丙烯酸酐,在80 ℃条件下反应4 h。反应结束后,将反应产物倒入大量乙醇中析出。再将产物溶于DMSO 中,重复洗3次。最后将纯化后的CM溶解于DMSO中,避光保存备用取20 g 1-丁基-3-甲基咪唑氯盐和1 g纤维素置于100 mL的三口烧瓶中,在100 ℃ 条件下搅拌溶解至澄清透明的纤维素溶液,然后依次向三口烧瓶中加入9.13 mL吡啶和8.86 mL甲基丙烯酸酐,80 ℃条件下反应4 h。反应机理如图1所示,纤维素上羟基被甲基丙烯酸所取代,生成纤维素甲基丙烯酸酯。反应结束后,将反应产物倒入大量乙醇中析出。再将产物溶于DMSO 中,重复洗3次。最后将纯化后的CM溶解于DMSO中,避光保存。
1.3 CM、CM-MA和CM-CH水凝胶的制备与润胀性能
纤维素甲基丙烯酸酯凝胶的制备及巯基-烯改性机理图如图2所示。向上述制备的15 mg/mL CM的DMSO溶液中加入1% APS(相对于CM质量)并混合均匀,在80 ℃条件下加热1 h制备CM有机凝胶。其中过硫酸铵作为一种常用的自由基交联热引发剂常被用于凝胶的制备等交联反应中[13]。未参与交联的双键还可以作为活性端基为下一步硫醇类化合物修饰提供反应活性位点。将MA和CH分别溶解于DMSO中,配制成浓度为 0.3 mol/L的MA和CH溶液。然后, 将制得的CM有机凝胶(CM绝干质量为500 mg),分别浸没于30 mL MA和CH溶液中。在25 ℃ 条件下浸泡24 h,确保混合液中的MA与CH在CM有机凝胶中扩散均匀。然后将样品放置在紫外灯下(320~400 nm),MA和CH中的巯基与CM有机凝胶中未参与交联的乙烯基在紫外光的引发作用下发生巯基-烯点击反应,制备出接枝有羧基的CM-MA和接枝氨基的CM-CH凝胶。将改性后的有机凝胶置于离子水中浸泡48 h,直至完全去除 DMSO和残留的MA或CH,制得CM-MA和CM-CH水凝胶。再将CM-MA别用pH=12的NaOH溶液,CM-CH凝胶用pH=2的HCl溶液充分润胀,并置于蒸馏水中洗去残余的酸或碱,用于后续金属离子吸附,并通过公式(1)计算水凝胶的溶胀度(SR,g/g)。
(1)
式中:Wt为水凝胶的总质量,g;Wd为绝干水凝胶的质量,g。
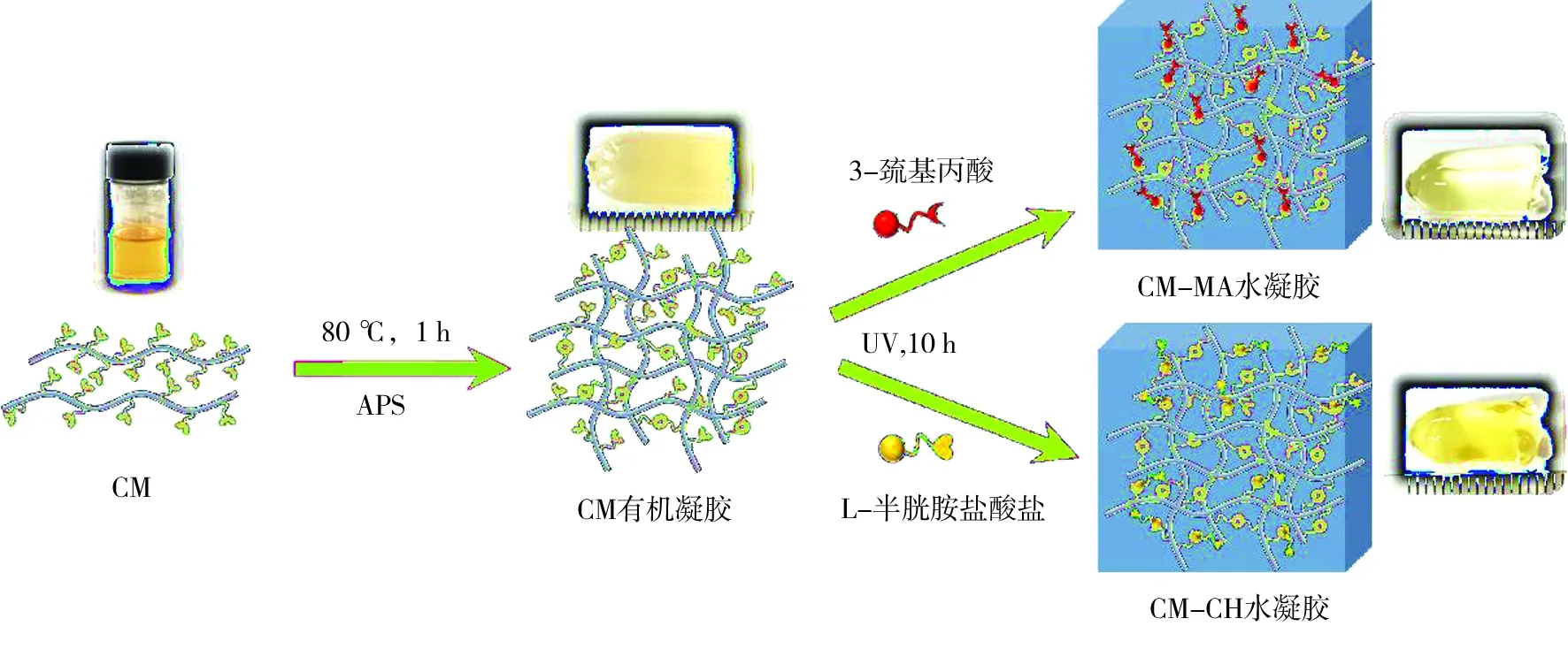
图2 CM-MA和CM-CH水凝胶的合成示意图Fig.2 Preparation of CM-MA and CM-CH hydrogels
1.4 测试表征
通过傅里叶变换红外光谱仪(FTIR-650,赛默飞有限公司)对纯化纤维素和纤维素甲基丙烯酸酯样品进行测试分析,测试波长为4 000 ~500 cm-1,扫描32次/min。CM能够溶解于DMSO中,取洗涤干燥样品0.05 g溶解于1.5 mL的氘代DMSO中,最后用孔径为45 μm的滤膜过滤后装入核磁管中在核磁共振波谱仪(AVANCEIIIHD-500 MHz,布鲁克科学仪器有限公司)进行液态核磁13C-NMR与1H-NMR分析。将经预处理后润胀的CM-MA与CM-CH水凝胶冷冻干燥得到相应的气凝胶,利用扫描电子显微镜(Apreo-S-HiVac,赛默飞有限公司)中观察微观形貌,同时利用能量色散光谱仪(EDX-HDN,赛默飞有限公司)对凝胶样品的S和N元素分布进行检测。
称取干质量为20 mg经过润胀处理的水凝胶加入到20 mL,20 mg/L的Cu2+、Zn2+、Hg2+、Pb2+、Cd2+、Co2+金属离子混合溶液中进行吸附。在48 h取样3次,利用电感耦合等离子体发射光谱仪(ICP-OES)测定混合液中各离子剩余浓度。利用公式(2)和公式(3)评价CM-MA水凝胶的吸附量[14]qe(mg/g)和重金属离子去除率R(%)[14],计算公式如下
(2)
(3)
式中:C0为初始时间的重金属离子质量浓度,mg/L;Ct为当时间达到t时的重金属离子质量浓度,mg/L;V为重金属离子溶液的体积,L ;m为绝干水凝胶的质量,g。
配置浓度为100 mg/L的Pb2+和Hg2+离子溶液,分别取10、20、30、40、50 mL放于10个玻璃瓶中,分别向Pb2+溶液和Hg2+溶液中加入对应干质量为20 mg 的CM-MA和CM-CH水凝胶。将玻璃瓶置于25 ℃ 的机械摇床上进行吸附,每隔一定时间取样,用于测定浓度。利用电感耦合等离子体发射光谱仪(Optima8300,美国PE公司)测定离子浓度,并计算这5种水凝胶的吸附量qe(mg/g)及重金属离子去除率R(%)。吸附实验结果分别用Langmuir吸附模型、Freundlich吸附模型[15]、准一级、准二级吸附动力学模型[16]和颗粒内扩散模型[17]进行拟合。
2 结果与分析
2.1 纤维素甲基丙烯酸酯(CM)的合成


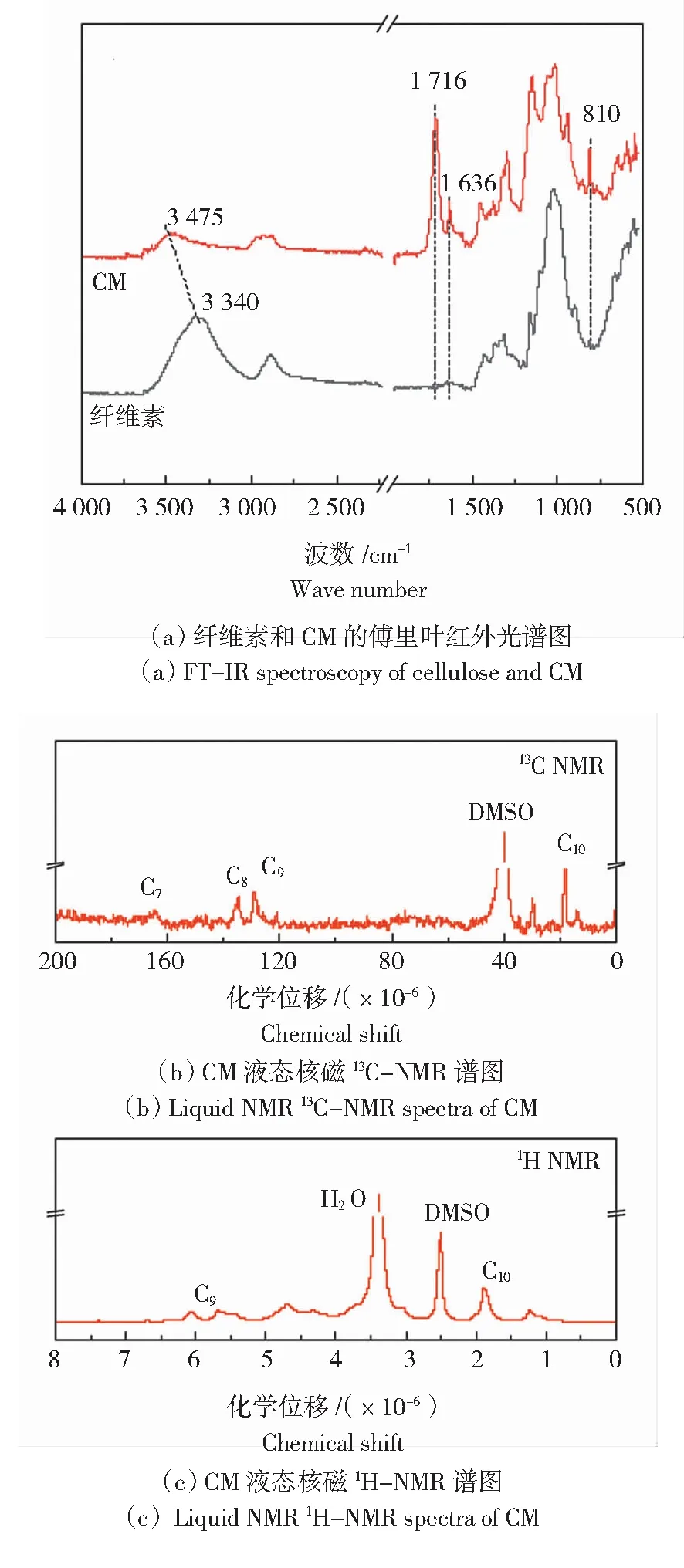
图3 纤维素与CM的红外与核磁表征Fig.3 FT-IR and NMR characterization of cellulose and CM
2.2 CM-MA和CM-CH水凝胶的制备与润胀性能
凝胶的润胀性能是评价凝胶性能的重要参数之一,这一性能极大地影响着重金属离子脱除过程中的吸附行为。从图4(a)、图4(b)可以看出,经pH=7和pH=12溶液处理后的CM-MA水凝胶的润胀性能测试分析结果显示,经pH=12溶液处理后的CM-MA水凝胶的溶胀度是pH=7溶液处理后凝胶的13.65倍。这主要是由于制备的CM-MA水凝胶中含有大量的羧基,CM-MA的羧基间存在分子间氢键作用。因此在pH=12的碱性条件下,-COOH变为-COO-,破坏了CM-MA分子间的氢键,凝胶的三维网络打开,因而凝胶的亲水性增强。从图4(c)—图4(e)中的水凝胶数码照片与扫描电子显微镜结果可以发现,CM-MA水凝胶具有多孔结构,孔隙较大。利用能量色散X射线光谱仪(EDX)对冷冻干燥水凝胶检测S元素与N发现,CM-MA水凝胶中存在分布均匀的S元素,未发现N元素这是由于3-巯基丙酸中不含有N元素。从图4(f)、图4(g)可以看出,经pH=7和pH=2溶液处理后的CM-CH水凝胶的润胀性能测试分析结果显示,经pH=2溶液处理后的CM-CH水凝胶的溶胀度是pH=7溶液处理后凝胶的1.24倍。这主要是由于制备的CM-CH水凝胶中含有大量的氨基因,由于CM-CH水凝胶中含有接枝的亲水性-NH2基团,在酸性条件下,水凝胶网络被打开,氨基质子化成亲水性更强的-NH3+,同时这也破坏了氨基间的氢键,使得水凝胶的亲水性更强。如图4(h)—图4(j)CM-CH水凝胶具有多孔结构所示。利用能量色散X射线光谱仪(EDX)对冷冻干燥水凝胶检测发现S元素的同时也发现了N元素这是因为L-半胱胺盐酸盐的加入不仅通过巯基-烯反应引入了S元素,同时也引入了来自氨基中的N元素。因此可以确定,3-巯基丙酸(MA)与L-半胱胺盐酸盐(CH)在紫外光引发作用下,与CM凝胶中剩余双键发生巯基-烯反应。S元素均匀分布于CM-MA和CM-CH水凝胶的内壁褶皱及孔隙壁上。

图4 CM-MA和CM-CH水凝胶性能表征Fig.4 Characterization of CM-MA and CM-CH hydrogels
2.3 CM-MA和CM-CH水凝胶对重金属离子吸附的选择性
为了评价CM-MA和CM-CH水凝胶对不同重金属离子吸附效果,配置了相同浓度的6种(Cu2+、Zn2+、Hg2+、Pb2+、Cd2+、Co2+)溶液,称取相同干质量(0.2 g)的水凝胶浸泡至混合离子溶液中。48 h后取部分对溶液浓度进行测定。根据1.4中公式(2)和公式(3)分别计算各重金属离子的吸附量和去除率。CM-MA和CM-CH水凝胶对离子吸附量结果如图5所示。由图5(a)和图5(b)可以看出,CM-MA水凝胶均对这6种离子都有一定的吸附效果。 CM-MA水凝胶的吸附性由低到高为Co2+、Cd2+、Zn2+、Cu2+、Hg2+、Pb2+,尤其是对Hg2+、Pb2+表现出了良好的吸附效果,最大吸附量分别为80.11 mg/g和99.02 mg/g。由于CM-MA水凝胶中含有大量的羧基, 易与金属离子之间形成的离子键。由图5(c)可知,静电相互作用为金属离子的吸附提供重要驱动力。由图5(d)、图5(e)可以发现CM-CH水凝胶对Hg2+具有良好的吸附特异性,其对Hg2+的吸附量可达14.81 mg/g,去除率可达70.93%。CM-CH对Hg2+的吸附机理如图5(f)所示,主要基于CM-CH中的氨基与金属离子间形成电荷作用,此外羟基对金属离子也有一定的氢键作用。而该凝胶对于其余的五种金属离子吸附量均小于2.5 mg/g,去除率均低于10%。根据酸碱理论[23],属于弱碱的胺基和属于弱酸的汞离子更容易通过静电相互作用进行吸附。另一方面,由于不同原子的电负性差异,与O原子相比,N原子对孤对电子束缚力更弱,因此N原子的孤对电子更容易与过渡金属汞离子的空轨道形成稳定配位的络合物。对于元素周期表右边的过渡元素,氨的键合能力大,由于汞形成稳定配位化合物的能力上与传统的过渡元素相似因此易于形成稳定的配合物[24-25],由此可以解释氨基比羧基有更高的吸附选择性,并且表现出对汞离子的特异性吸附。
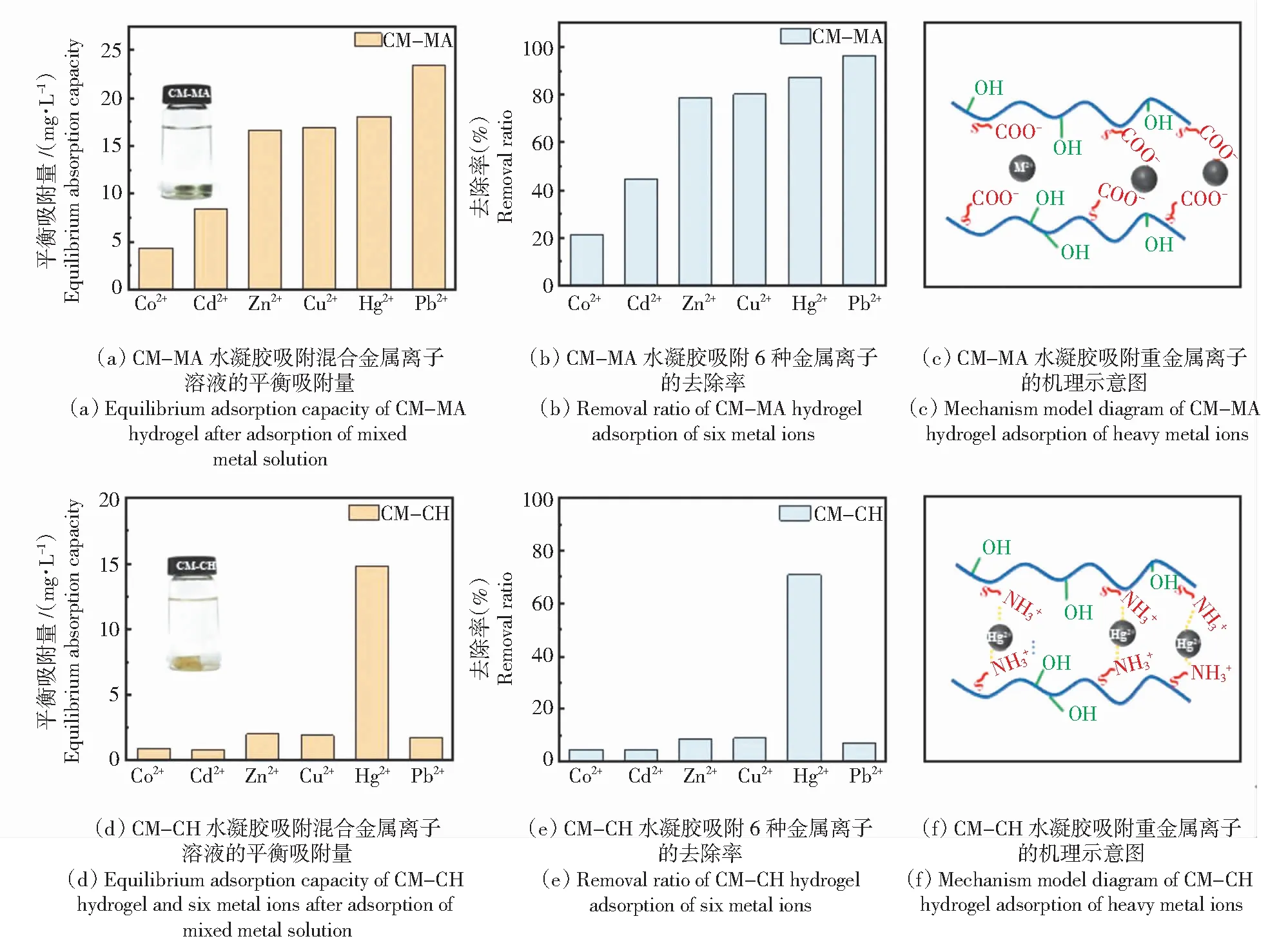
图5 CM-MA和CM-CH水凝胶对重金属离子吸附的选择性实验结果Fig.5 Experimental results of selective adsorption of heavy metal ions by CM-MA and CM-CH hydrogels
2.4 CM-MA对Pb2+和CM-CH对Hg2+的吸附
利用电感耦合等离子体发射光谱仪对吸附过程中溶液中剩余离子的浓度进行测试,并按照1.5中的公式(2)和公式(3)分别计算吸附量与去除率,结果如图6(a)和图6(b)所示,CM-MA和CM-CH水凝胶对Pb2+和Hg2+吸附量qe随吸附时间的延长而逐渐增大,在初始12 h吸附速率较快,随后逐渐减缓,并于24 h之后基本趋于平衡。这是由于CM-MA和CM-CH水凝胶表面具有大量的吸附活性位点,吸附过程的前12 h,由于活性位点未饱和[26-27],因此吸附速度较快,而当吸附位点逐渐被金属离子占满之后, Pb2+和Hg2+随之吸附速率下降,并在24 h之后吸附量趋于稳定。CM-MA水凝胶对Pb2+和CM-CH水凝胶对Hg2+的最大吸附量分别为99.02 mg/g和80.11 mg/g,去除率分别为91.75%和72.52%。
为验证CM-MA和CM-CH水凝胶分别对Pb2+和Hg2+产生有效吸附,通过扫描电子显微镜与能量色散X射线光谱仪对冻干凝胶断面进行测试分析。结果如图6(c)和图6(d)所示,CM-MA和CM-CH水凝胶的SEM图像,看出CM-MA水凝胶具有多孔结构,因此具有吸附重金属离子所需要的孔道,并且孔隙充满褶皱因此该凝胶具有大的比表面积。结合Pb与Hg元素的EDX图像中,可以看到Pb2+和Hg2+分别在 CM-MA和CM-CH水凝胶中能够均匀分布。因此确定CM-MA和CM-CH水凝胶分别对Pb2+和Hg2+产生吸附作用。
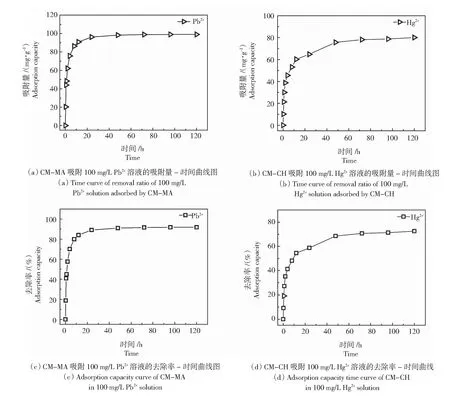
图6 CM-MA对Pb2+和CM-CH对Hg2+的吸附Fig.6 Adsorption of Pb2+ by CM-MA and of Hg2+ by CM-CH
2.5 吸附动力学和吸附机理研究
为了进一步探究吸附机理,本研究利用吸附动力学模型和吸附等温线模型对吸附过程进行拟合。图7(a)—图7(c)是利用不同模型对CM-MA水凝胶吸附Pb2+过程进行拟合的曲线,图7(a)是CM-MA水凝胶对Pb2+吸附过程的拟合曲线,具体拟合参数详见表1,可以发现该吸附过程与Langmuir等温吸附模型的拟合度更高(RL2>RF2),CM-MA水凝胶吸附对Pb2+主要表现为单分子层吸附,由此可以推测吸附过程可能为化学吸附。图7(b)为CM-MA水凝胶吸附Pb2+的准一级和准二级吸附动力学模型拟合曲线,拟合参数见表2,准一级和准二级吸附动力学模型的相关系数R2分别为0.94和0.99,这表明该吸附过程更符合准二级吸附动力学模型,进一步证明了Pb2+的去除机制主要是化学吸附。图7(c)为颗粒内扩散模型对该吸附过程的拟合曲线图,其相关拟合系数见表3,Pb2+的扩散过程可以分为2部分,第一部分斜率较高,表明Pb2+扩散到水凝胶周围的边界层或通过边界层扩散到水凝胶外表面;第二部分斜率较低,表明吸附过程处于温和阶段,此时发生颗粒内扩散或孔隙填充,并逐渐达到平衡。
类似地,图7(d)—图7(f)是利用不同模型对CM-CH水凝胶吸附Hg2+过程进行拟合的曲线,通过对比不同模型的相关系数,可以发现CM-CH水凝胶对Hg2+的吸附过程同样适应于Langmuir等温吸附模型和准二级吸附动力学模型,证明了Hg2+的吸附主要也是化学吸附,此外,颗粒内扩散在整个吸附过程中同样分为2个步骤。
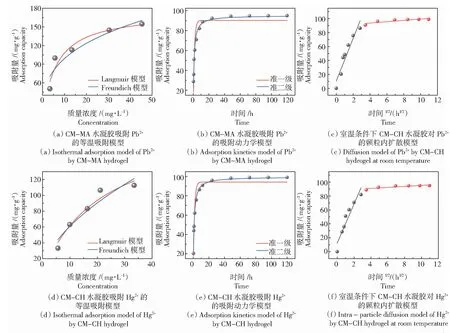
图7 吸附模型机理Fig.7 Adsorption mechanisms
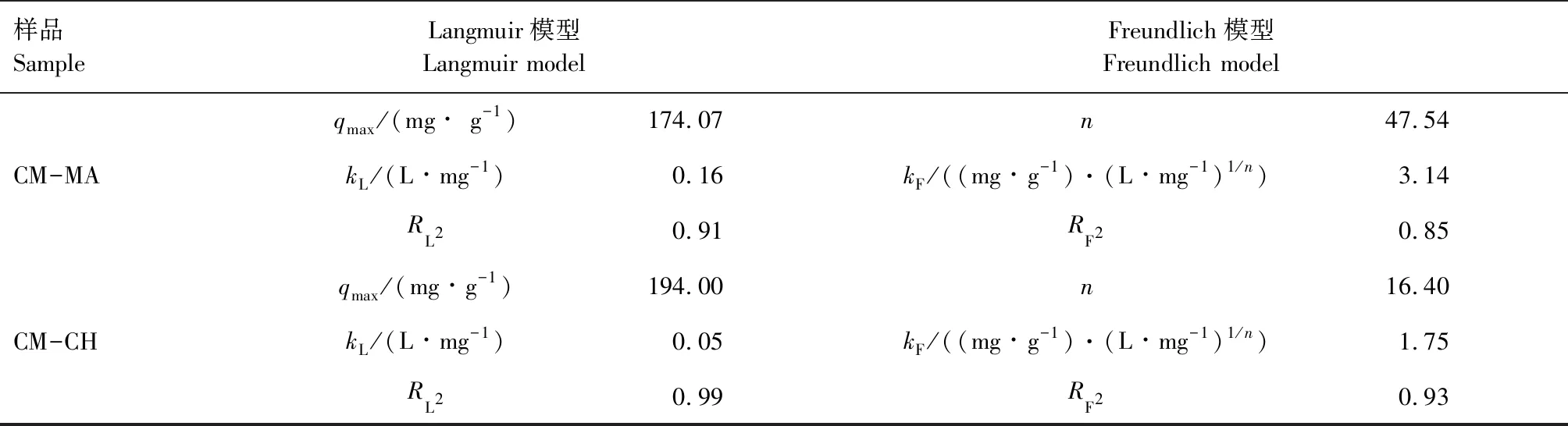
表1 Pb2+和 Hg2+等温吸附模型Tab.1 Isothermal adsorption models of Pb2+ and Hg2+
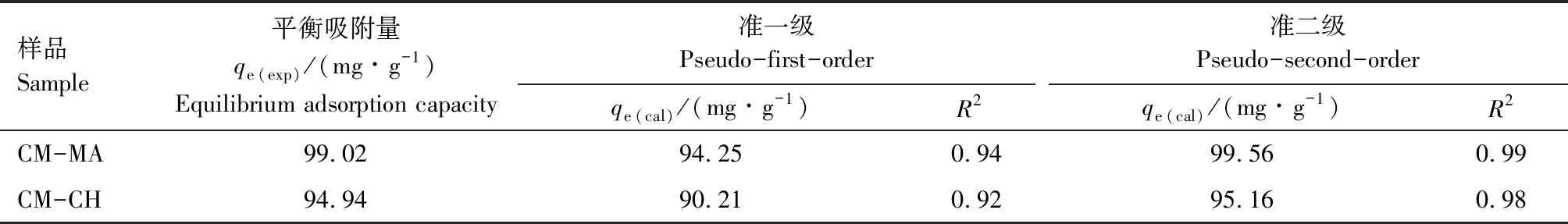
表2 Pb2+ 和 Hg2+ 吸附动力学模型
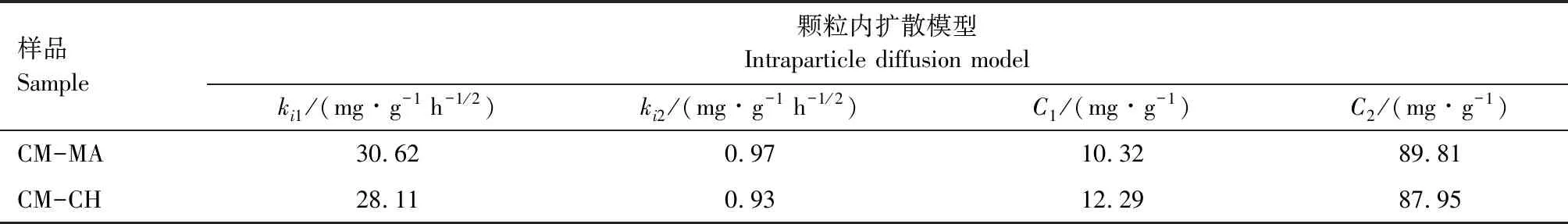
表3 Pb2+ 和 Hg2 颗粒内扩散模型
3 结论
利用杨木木粉中提取的纤维素为原料在离子液体均相条件下与甲基丙烯酸酐发生酯化反应,成功合成出纤维素甲基丙烯酸酯(CM),运用自由基交联反应制备CM有机凝胶。通过3-巯基丙酸(MA)与L-半胱胺盐酸盐(CH)中的巯基与CM中的不饱和双键发生巯基-烯反应对CM凝胶进行吸附活性位点修饰,成功制备出高吸附性多孔CM-MA及CM-CH水凝胶。虽然2种凝胶吸附离子的过程均属于单分子层的化学吸附,但在对土壤和水体主要的6种污染重金属Co2+、Cd2+、Zn2+、Cu2+、Hg2+、Pb2+的吸附去除实验中表现出了不同的选择性吸附特性。CM-MA水凝胶的吸附性由低到高为Co2+、Cd2+、Zn2+、Cu2+、Hg2+、Pb2+,尤其是对Pb2+表现出了良好的吸附效果,最大吸附量分别为154.63 mg/g。而CM-CH水凝胶则仅对Hg2+表现出优异的特异性选择吸附,其最大吸附量为112.55 mg/g。本研究可为主用于吸附Hg2+、Pb2+重金属离子的纤维素基吸附功能材料的拓展提供可行方案,为以Hg2+、Pb2+为主要重金属污染的土壤和水体的吸附处理提供一条有效途径,同时实现了农林废弃物的高值化利用,对资源利用和生态环境保护具有一定的指导意义。
