基于探究式教学模式对预阳极化前后的玻碳电极测定对乙酰氨基酚的伏安图差异的分析及机理讨论
2023-02-11李晶仉华吴呈珂李慧杰冯素玲李全民上官恩波
李晶,仉华,吴呈珂,李慧杰,冯素玲,李全民,上官恩波,*
1河南师范大学化学化工学院,河南 新乡 453003
2河南师范大学材料科学与工程学院,河南 新乡 453003
循环伏安法(CV)往往是首选的电化学分析测试技术,被广泛地应用于化学、生命科学、能源科学和环境科学等领域中相关体系的测试与表征。对乙酰氨基酚(AC)是与生命科学有关的一种临床上使用极其广泛的苯胺类药物,也是最常用的非抗炎解热镇痛药之一。由于AC分子中含有电活性活泼基团,可以在玻碳电极表面发生电化学氧化反应。因此,通过伏安法可以对其进行定量分析与测定。但事实上当以玻碳电极为工作电极测定时,循环伏安曲线图上所显示AC的电极反应过程并不具有所期望的可逆性,从而会导致对其测定的灵敏度降低,甚至会影响结果的可靠性。试验表明,若将同一支玻碳电极在碱性溶液中经过简单的“预阳极化”处理后使用,AC循环伏安曲线图上所呈现的电极反应的可逆性可获得极大的改善。那么为什么AC在“预阳极化玻碳电极”上的电极反应可逆性会得到极大的改善呢?针对学生在实验中所产生的这种疑惑和好奇心,作为实验课指导教师直接承担着“解惑答疑”和引导学生进行探究性实验研究的责任。教师若把这种“疑惑”只是简单停留在将其现象解释为“电化学催化作用”所致,而没有将与电极表面产生电催化作用有关的耦联反应加以详细分析和阐明,显然这种笼统的结论性解释的教学模式是不会令人信服的,也不能使学生真正理解在预阳极化的玻碳电极上发生这种现象的成因。其教学效果只会使学生仍然停留在只“知其然,而不知其所以然”的尴尬处境,也不利于激励学生进行探究性学习的兴趣和科学研究能力素养的培养。
本文正是在教师引导下,不仅使学生能够从理论上探究AC在预阳极化前后玻碳电极上所出现的伏安图差异现象形成的原因,还大大加深理解了课堂上理论教学的相关内容,使学生从由单一“照方抓药”的实验课教学模式向“探究性”学习模式进行观念上转变。这种教学模式不仅大大提高了实验课的教学质量,也有利于培养本专业大学生科研素养,同时还会促进教师自身业务能力的提高。
1 对乙酰氨基酚的电化学测量
AC分别在预阳极化玻碳电极(PAGCE)和未预阳极化的玻碳电极(NPAGCE)上的循环伏安曲线见图1。循环伏安图中0.5904 V和0.7514 V处的氧化峰是由于AC分别在PAGCE和NPAGCE上被氧化成了对亚胺基苯醌,而0.5170 V和0.0012 V处的还原峰则是对亚胺基苯醌又还原成AC所致。可见,AC在电极反应过程中正向扫描则被氧化为对亚胺基苯醌,反向扫描时其氧化产物又可以被还原为AC分子,其电极反应机理如图2所示。从图1中可以看出,AC在NPAGCE上氧化还原峰电流均远低于在PAGCE上的氧化还原峰电流,而氧化峰电位(0.7514 V)则远正于它在PAGCE上的氧化峰电位(0.5904 V)。此外,AC在NPAGCE上的氧化还原峰电位差为750 mV,而在PAGCE上仅为73 mV。上述现象表明,与AC在NPAGCE上的电化学行为相比,AC在PAGCE上具有更好的电极反应可逆性[1]。

图1 AC分别在PAGCE (a)和NPAGCE (b)电极上循环伏安行为

图2 AC电极反应
2 问题的提出及讨论
由第1节中的讨论可知,相较于NPAGCE,在PAGCE上AC的氧化峰电流不仅比NPAGCE上的氧化峰电流提高了68.4%,氧化峰电位比后者也负移了0.161 V,并且氧化峰与还原峰电位差从NPAGCE上的750 mV,在PAGCE上则减小到了73 mV。对于同一支玻碳电极,预阳极化前后测得的AC的电化学信号为什么会有如此大的差别呢?面对于这样两种试验结果差异,学生也感到无比惊讶和兴奋。他们惊讶的是通过简单的在碱性溶液预阳极化的方式就能将玻碳电极表面进行修饰,从而就能极大地改善电极反应的电化学性能;他们对在坚硬光滑的玻碳电极表面上经过所谓的“预阳极化处理”后,以肉眼不能观察到电极表面上所发生的微观变化,获得了一种性质不同于“未预阳极化”的“新型玻碳电极”感到兴奋。那么为什么AC能在预阳极化后“新型玻碳电极”上的氧化峰电流会得到显著的增大,同时氧化还原峰电位之差减少了677 mV,电极反应的可逆性得到极大的提高呢?这可能与下面将要讨论的几个因素有关。
2.1 电极反应的自由(活化)能的改变
我们知道,无论对于吸热还是放热的化学反应,通过升温(加热)都能够加快其反应速度。而通过改变电极电位可以改变电极反应的速度是电极反应不同于化学反应的一个重要特征。这是因为电极反应速率常数不仅与温度有关,还与电极电位的改变有关。根据文献[2],阳极反应活化能ΔGa= ΔGӨ0a−(1 − a)nFE,其中ΔGӨ0a为E = 0时阳极反应的活化能,a可以在0到1范围内变化,为讨论问题方便取a = 0,上式又可写成:ΔGa= ΔGӨ0a− nFE。可见,对于阳极反应,电极电位增加ΔE时,阳极反应的活化能则降低了nFΔE (kJ∙mol−1)。因此,随着工作电极电位增加,电极反应速度也会随之增加。图3表明了电极反应过程中线性扫描伏安图的形成过程[3],其中线段“1–2”代表充电电流。当电极电位增加到超过电活性组分最初发生反应的临界电位“2”时,实质上也就是将外加电极电位达到产生临界反应活化能时,电极表面产生了能够发生氧化反应的电活化分子,从而在工作电极上产生氧化电流。随着外加ΔE的继续增加,阳极反应的活化能则继续降低,相应地电极表面的电活化分子数则继续增加,氧化电流随ΔE的继续增加而逐渐增大,以至于图2中AC在PAGCE上的氧化行为的i(电流)–E(电压)曲线正好与图3中i–E曲线的“2–4段”完全相类似。当外加ΔE继续增加至刚好出现峰(极限扩散)电流时,也就是说电极反应的活化能也刚好降低至电极表面电活性组分完全反应时所对应的临界电位“4”时,电极表面的电活性组分才能全部发生快速的电极反应,从而使其在电极表面浓度达到完全的浓差极化。可见,随着工作电极电位逐渐增大,阳极反应的活化能降低导致了电极反应速度加快,氧化电流也随之增大,当工作电极电位达到临界电位“4”时,扩散电流才能达到其相应的极限扩散电流,这与实验事实相符。当外加ΔE增加至超过峰电流所对应的临界电位“4”时,尽管阳极反应的活化能还会随电极电位的增加而降低,或者说电极反应速度随电极电位的增加还会加快,但由于扩散层厚度增大,本体溶液中电活性组分向电极表面扩散速度低于其电极反应速度,因而导致了图2中峰电流又随电极电位的增加而降低,这种现象同样类似于图3中的线段“4–6”。
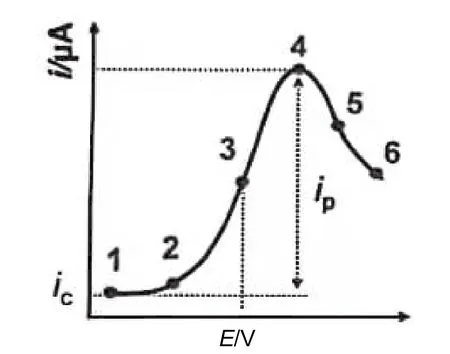
图3 氧化反应过程中线性扫描伏安图形成过程
由上述讨论可知,图2表明AC在PAGCE和NPAGCE上氧化峰电流的临界电位分别为0.5904 V和0.7514 V。依据ΔGa= ΔGӨ0a− nFE可以计算,在预阳极化和未预阳极化的玻碳电极上,AC的氧化峰电流对应的反应活化能分别降了113.95 kJ∙mol−1和145.02 kJ∙mol−1。也就是说AC在PAGCE上发生快速电极反应,并且在电极表面的浓度达到完全浓差极化时,其电极反应的活化能只需要降低113.95 kJ∙mol−1,电极表面的AC分子就会全部转变为活化分子而在电极表面快速反应,产生完全浓差极化,达到其相应的极限扩散电流值。而在未预阳极化的玻碳电极上电极反应的活化能则需要降低145.02 kJ∙mol−1,扩散电流才能达到其极限扩散电流值。可见电极反应达到最大程度(电极表面完全浓差极化)时,电极反应活化能降低的数值可以通过氧化峰电位进行计算,显然在电极表面完全浓差极化时的阳极电极反应的活化能降低的数值越小,表明电活性组分就越容易发生电化学氧化反应。由上述讨论可知,由于AC在PAGCE上具有较低的电极反应的活化能,从而获得了比在NPAGCE上具有较负的氧化峰电位,使得AC在PAGCE上更容易被氧化。这表明AC在PAGCE上电极反应的可逆性得到了极大的改善和提高应该与电极反应的活化能降低有关。
正是通过对这些问题的提出与讨论,从而引导学生学会用已掌握的相关理论知识解释不同试验条件下所产生的实验现象的差异,使学生潜移默化地树立起学以致用和理论联系实际的作风。那么相较于NPAGCE,在PAGCE上为什么氧化峰电流能够大幅度提高呢?
2.2 预阳极化前后电极的表面结构和表面积的改变
依据Randles-Savcik方程,ip= 2.69 × 105n3/2D1/2v1/2Ac,线性扫描伏安法峰电流ip与电极反应电子转移数n,扩散系数D,扫描速度v,工作电极表面积A和活性组分的浓度c有关。当n、D、v、A和c不变时,由上述讨论可知,预阳极化的玻碳电极上氧化峰电流比未预阳极化的提高了68%。很显然无论使用PAGCE还是使用NPAGCE在同一条件下进行测定时,n、D、v、c都不会改变,若不考虑2.1小节中所讨论的AC在PAGCE上电极反应的活化能降低和电极反应可逆性大大改善对氧化峰电流贡献的因素影响,那么引起峰电流增加的另外一个因素只能是经过预阳极化玻碳电极的有效表面积与其理论几何表面积(玻碳电极直径0.3 cm,其几何表面积为0.071 cm2)相比发生了变化。由上述的氧化峰电流提高了68%,可以计算出经过预阳极化的玻碳电极实际有效表面积达到了0.112 cm2。可见,预阳极化后的玻碳电极有效表面积增大可能是氧化峰电流显著增大的一个重要的原因。
那么,为什么经过预阳极化的玻碳电极会有较大的有效工作面积呢?根据文献[4,5],在NaOH溶液中对玻碳电极进行阳极化处理后,所产生的氢氧基团(―OH)会嵌入电极表面以下,引起局部区域应力加强,以致膨胀隆起形成许多“平顶高台”,导致电极表面粗糙度增加,相应的表面积也会随之增大。此外,预阳极化过程中,其表面会产生丰富的带负电荷的含氧基团,像羰基及酸酐基、羧基(―COOH)、酚羟基(―OH)、醚基(―O―)和内酯基等活性基团[5,6],而这些活性基团又可以通过氢键与AC分子中的活性基团相互作用,使得电活性组分在电极表面上的浓度得到富集而增加,这应该是除了电极表面积增大外,AC在预阳极化的玻碳电极上氧化峰电流显著提高的另一个重要因素。
可见,PAGCE测定AC比NPAGCE具有明显的优势和特征。在实验教学过程中通过引导学生对两种实验现象差异的对比和讨论,引据文献,可以把教师简单的输入式教学模式转化为以学生为主体的“主动、求知、探索”的学习模式,尤其是更能够鼓励学生对相悖于实验教学中的某些“反常的实验现象”[7]进行深入探究,从中可能会获得“有所发现、有所创新、解惑释疑”的意外效果,真正使学生在学习中切身感悟到“追求真理、探究真理”的快乐。
通过上述讨论,依据文献引导学生探究了AC在PAGCE上氧化峰电流增大的原因,使学生对实验现象不仅要“知其然”,更重要的是“知其所以然”,即学会透过表面现象看本质。依据AC在NPAGCE和PAGCE上的循环伏安曲线图,为什么在PAGCE上氧化峰电位能够发生负移或者说电极反应的活化能会降低呢?这是否会意味着电极反应中存在着催化作用呢?这又是引导学生对实验现象进行分析、进而提出的另一个值得探究的问题。
2.3 电极表面氢键式过渡态(活化)络合物和氢键催化作用
如图1所示,相较于NPAGCE,AC在PAGCE上的电极反应的可逆性得到了极大的改善和提高,其氧化还原峰电位分别为0.5904 V和0.5170 V,相应的氧化还原峰电流分别为118.4 μA和46.63 μA,氧化峰电位负移了0.161 V。可见PAGCE不仅显著改善了AC电极反应的可逆性,也催化了AC的电化学氧化还原反应。我们知道化学反应中,若反应的“活化能”降低,表明体系中一定会有“催化反应”发生,而引起活化能降低的原因是其反应体系中有中间态的“活化络合物”形成[8]。那么引起AC在PAGCE上反应活化能降低的过渡态“活化络合物”又是什么样的化学形式呢?
根据2.1小节中的讨论可知,与NPAGCE相比,AC在PAGCE上发生完全浓差极化时电极反应的活化能降低了31.07 kJ∙mol−1,这表明AC在该电极上的电极反应历程中也应有相应过渡态“活化络合物”的形成。那么这种所谓“过渡态活化络合物”究竟是怎么样形成的?它又如何在电极上反生反应的呢?这又是值得引导学生进行探究的一个重要问题,况且只有将这个问题探究明白之后,才有可能使学生从根本上理解该体系中电化学催化反应的内涵。
基于如上所述的PAGCE表面上含有丰富的带负电荷的含氧基团,这些带负电性含氧基团上氧原子上的孤对电子与AC分子中酚羟基(―OH)上的氢原子通过形成氢键而相互作用,使它在电极表面上形成了“[电极表面―O…H―O―AC母体]”这种具有低能态的“氢键式过渡态(活化)络合物”,从而使酚羟基活化,削弱了AC分子中O―H键的键能[9]。正是这种“氢键式过渡态(活化)络合物”在PAGCE上发生反应,使得AC能在较负的氧化电位被氧化,降低了电极反应的活化能。这种由于电活性组分通过氢键(O…H)与电极表面含氧基团相互作用,电极反应活化能降低的现象类似于有机合成反应中的“氢键催化”作用[10]。由此可以推理,AC在PAGCE上发生电催化被氧化的机理应归属于化学反应(C)先行于电极反应(E)的机理[1]。即:(1) AC分子中活泼氢原子首先与电极表面所含氧原子上的孤电子对通过氢键作用的“化学反应(C)”在电极表面形成“氢键式过渡态(活化)络合物”;(2) 进而这种具有低能态的“氢键式过渡态(活化)络合物”在电极表面上发生电极反应(E)。而在NPAGCE上表面上没有这种“氢键式过渡态(活化)络合物”的形成,使得AC只能在电极表面直接被氧化,从而导致了AC发生氧化反应时具有较正的氧化电位和较高的电极反应活化能。至于为什么在PAGCE上AC还原峰电流明显小于其氧化峰电流,这可能与具有醌式结构的氧化态难以通过氢键与电极表面发生相互作用以及因其浓度梯度从电极表面向本体溶液中快速扩散有关,从而使得其还原峰电流小于它的氧化峰电流。
这种引导学生深入探究式的实验教学模式,使学生从本质上加深了对电催化现象的理解。而不是像过去传统的教学模式那样在有关伏安法的电化学实验教学中,依据该实验中出现的“氧化峰电流增大和峰电位负移”这种特征,指导教师通常只是简单、笼统地向学生解释在电极上发生了“电催化反应”。至于电极上真正发生了什么样的“电催化反应”和“反应机理”,指导教师通常不会引导学生作出进一步的思考。这种传统的教学模式不仅会抑制学生对不同实验现象探究的主动性和能动性,也可能还会助长某些教师在教学中本身也就存在“只知其然”而“不知其所以然”的不求甚解的教风。若在教学中对这样类似的问题不进行深入分析,甚至教师自身就很难明理电极表面究竟发生了什么样的“隐形化学反应”,也就更难理解电极表面究竟发生了什么样的“隐形电催化反应”。通过这种理论与实验现象相结合的分析探究问题模式,不仅使学生在学习中真正既“知其然”又“知其所以然”,同时也会大大促进教师的教学水平和理论水平的提高。
3 实验部分
3.1 PAGCE极制备
将直径3 mm玻碳电极表面用氧化铝匀浆抛光,再用稀硝酸、去离子水清洗其表面。然后将其置于0.20 mol∙L−1NaOH中,在−0.30 – 1.50 V之间以100 mV∙s−1的扫速循环扫描50周,取出,以去离子水淋洗3–5次后,晾干备用。
3.2 实验方法
将一定量的对乙酰氨基酚溶液于10 mL刻度管中,用pH = 6.0 PBS缓冲溶液稀释至刻度,摇匀后转移至电解池中。采用三电极系统,分别以预阳极化和未预阳极化的玻碳电极为工作电极,于0.2–1.2 V范围内以100 mV∙s−1扫速下扫描,记录其循环伏安图。
4 结语
本文基于探究式实验的教学模式,尤其是在不断的提出问题和质疑的基础上,引导学生从理论上对预阳极化前后的玻碳电极测定AC的伏安曲线图所产生的显著差异现象的原因进行机理分析和讨论。从中不仅使学生明晰了电催化氧化AC的机理,也提高了理论联系实际、分析问题和解决问题的能力,同时也激发学生自觉“探究学习”的积极性。
