3个中国遗传性对称性色素异常症家系ADAR基因新变异的鉴定
2023-02-11杨雪婷郭可欣王蓉蓉马东来
杨雪婷,郭可欣,孙 阳,王蓉蓉*,马东来,张 学
1.中国医学科学院基础医学研究所 北京协和医学院基础学院 麦库西克-张孝骞协和遗传医学中心医学分子生物学国家重点实验室,北京100005;2.中国医学科学院 北京协和医学院 北京协和医院 皮肤科疑难重症及罕见病国家重点实验室 国家皮肤与免疫疾病临床医学研究中心,北京100730
遗传性对称性色素异常症(dyschromatosis symmetrica hereditaria, DSH, MIM#127400)是一种罕见的、呈常染色体显性遗传的色素性皮肤病。DSH多发于中国、日本等东亚地区,此外,在亚洲其他地区如印度、以及欧洲地区如西班牙等地也有报道[1-2]。日本人群发病率约为 1.5/10万,中国人群发病率不详,约73%的患者于7岁前发病[3-4]。DSH的主要临床特点是手背和足背的色素沉着减少斑及色素沉着过度斑,部分患者面部表现出雀斑样斑点[5]。DSH的病理表现为色素减少斑皮肤基底层内黑色素细胞减少,电镜检查可见黑色素细胞变性[6]。2003年,学者将DSH致病基因确定为位于1q21.3的双链RNA特异性腺苷脱氨酶(adenosine deaminase acting on double-stranded RNA,ADAR)基因[3, 7]。
本研究结合临床表型、全外显子组测序技术(whole exome sequencing, WES)、Sanger测序以及生物信息分析软件等,运用相关分子诊断技术和遗传学分析方法,对3个中国DSH家系进行研究,为该病的基因诊断、遗传咨询以及精准治疗提供依据。
1 材料与方法
1.1 研究对象
家系1:先证者1,男,18岁,双手背侧皮肤色素异常8年余。家系2:先证者2,男,12岁,双手、足背侧皮肤色素异常2年余。家系3:先证者3,女,5岁,面部、双手、双足皮肤色素异常3年余。
3名先证者均于北京协和医院皮肤科门诊就诊。在获得患者及其家庭成员知情同意并签订知情同意书后,收集患者及其家系成员临床资料、家族史,进行临床诊断及家系分析(图1)。该研究遵循赫尔辛基宣言(Helsinki Declaration),并获得中国医学科学院基础医学研究所伦理委员会的审查批准(2022170)。
1.2 研究方法
1.2.1 采集样本与DNA的提取:获取知情同意后采集患者及其父母外周静脉血各2 mL,EDTA抗凝,-20 ℃低温保存,使用全血细胞DNA提取试剂盒(Qiagen公司,51106)提取样本基因组DNA。
1.2.2 WES检测与变异的筛选:取患者外周血基因组DNA 1 μg 送至北京诺禾致源科技股份有限公司进行WES检测,使用Illumina平台PE150高通量测序系统进行人类全外显子组测序,利用ANNOVAR软件对检测出的基因变异进行功能注释。致病变异的分析筛选策略如下:1)按照遗传方式关注呈常染色体显性遗传的变异;2)选择最小等位基因频率≤ 0.001的变异;3)关注位于基因编码区的变异以及位于非编码区但可能影响剪接的变异;4)针对已报道的候选致病基因,利用生物信息软件对候选基因上的变异进行致病性预测。

The squares represent males, the circles represent females, the blackened symbols represent affected individuals,and the probands are indicated by the arrows
1.2.3 Sanger测序验证变异位点:对WES结果中筛选出的变异位点进行家系验证,从NCBI数据库(https://www.ncbi.nlm.nih.gov)获取基因序列信息,利用Primer3web在线软件(https://primer3.ut.ee/)针对变异位点设计引物,由北京天一辉远生物科技有限公司合成。对患者及其父母基因组DNA样本进行变异位点的PCR扩增,扩增产物送至北京诺赛基因组研究中心有限公司进行Sanger测序。
1.2.4 蛋白保守性及功能的预测:应用Clustal Omega在线软件(http://www.clustal.org/omega/)预测基因变异位点的保守性,使用Jalview软件分析结果。使用REVEL、CADD等在线软件预测基因变异的致病性。
2 结果
2.1 临床表型
先证者1,男,18岁,双手背部散在分布点状、小片状白斑8年余,局部掺杂色素沉着过度斑(图2),白斑随年龄增长数量有所增多、面积有所扩大,无痛痒症状,否认家族史。
先证者2,男,12岁,双手、足背部散在分布点状白斑和褐色斑块近2年(图2),且随年龄增长逐渐加重,否认家族史。
先证者3,女,5岁,双手、足背部散在分布点状白斑和色素沉着过度斑(图2),面部有雀斑样斑点,否认家族史。
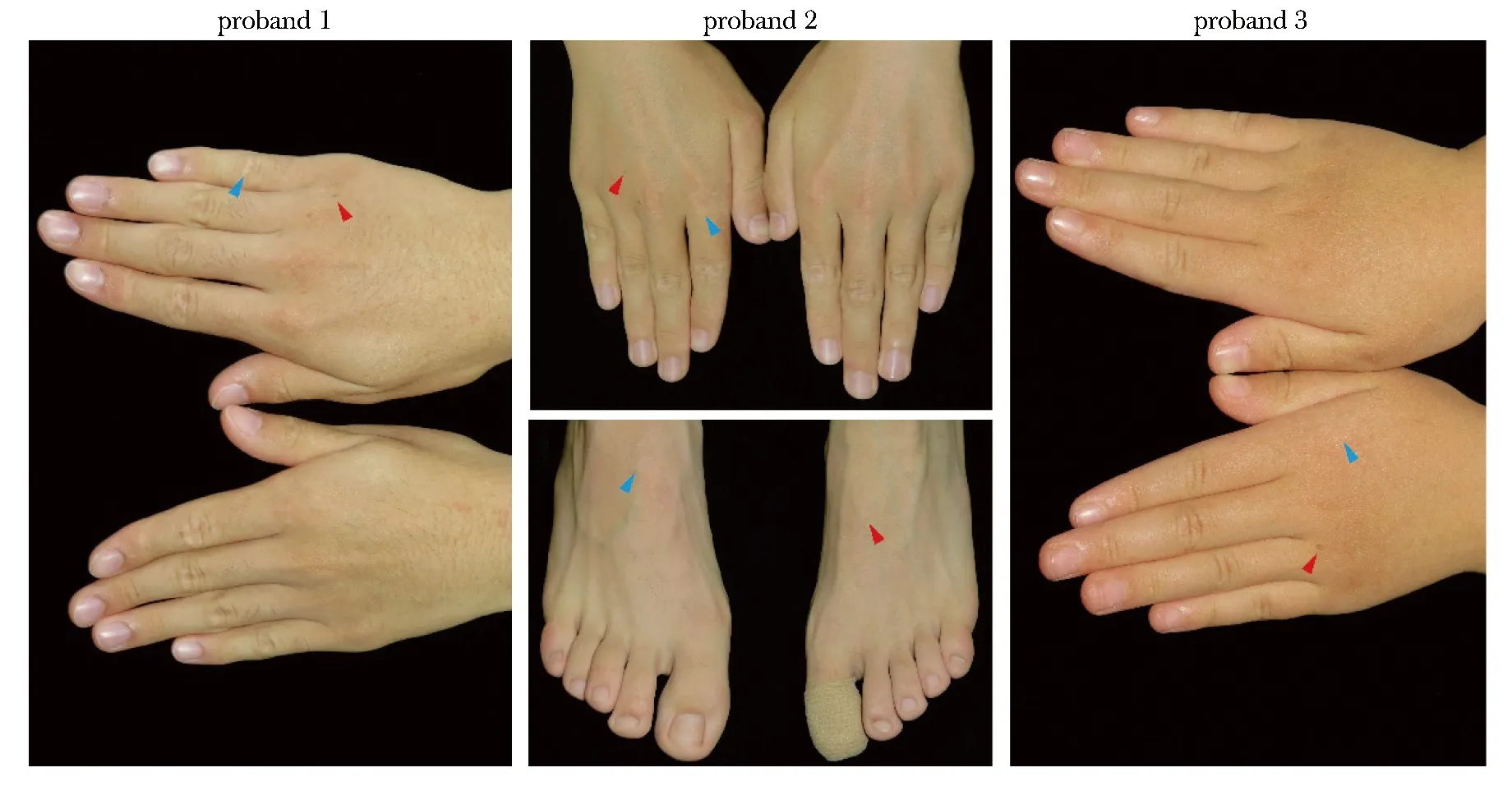
The hyperpigmented macules are indicated by the red triangles, while the hypopigmented macules are indicated by the blue triangles
2.2 WES结果分析与Sanger测序验证
根据上述策略,对WES结果进行分析及变异筛选,发现3名先证者均携带ADAR(NM_001111.5)基因杂合变异。先证者1携带ADARc.3546T>G(p.Tyr1182*)无义变异,先证者2携带c.2770T>G(p.Tyr924Asp)错义变异,先证者3携带ADARc.3116A>C(p.Lys1039Thr)错义变异。这3个变异均未在gnomAD数据库等公共数据库中收录。前两个变异在人类基因突变数据库(Human Gene Mutation Database,HGMD)未见报道。Sanger测序结果表明这3个家系中先证者的父母均未携带相应变异,提示为新发变异(denovovariants)(图3)。
2.3 变异致病性预测分析结果
这3个ADAR基因的变异位点在不同物种间高度保守(图4)。ADAR基因c.3546T>G(p.Tyr1182*)无义变异CADD预测分值为38,判定为“Damaging”,LRT预测分值为0,判定为“Deleterious”;c.2770T>G(p.Tyr924Asp)错义变异SIFT、REVEL、CADD预测分值分别为0、0.981、29.8,判定为“Damaging”; c.3116A>C(p.Lys1039Thr)错义变异SIFT、REVEL、CADD预测分值分别为0、0.985、31,判定为“Damaging”。 根据美国医学遗传学和基因组学学会(ACMG)指南,ADAR基因c.3546T>G无义变异被判定为致病(PVS1+PS2+PM2+PP3+PP4);c.2770T>G、c.3116A>C错义变异分别被判定为致病(PS2+PM1+PM2+PP3+PP4)以及(PS1+PS2+PM1+PM2+PP3+PP4)。

The variants are indicated by the red arrows图3 3个家系ADAR基因变异位点测序图Fig 3 Sanger sequence chromatograms of the ADAR variants in the three families

The variant sites are highlighted in red图4 ADAR基因编码蛋白924位酪氨酸(Y)、1039位赖氨酸(K)、1182位酪氨酸(Y)位点保守性分析(NP_001102.3)Fig 4 Conservation of the variant sites, Tyr (924), Lys (1039) and Tyr (1182) in ADAR protein
3 讨论
DSH是一种呈常染色体显性遗传的色素性皮肤病。2003年,中国学者Zhang等通过定位克隆的方法发现DSH致病基因定位于1号染色体1q11~1q21区域,同年,日本学者Miyamura等将DSH致病基因确定为该区域内编码双链RNA特异性腺苷脱氨酶的基因ADAR[3, 7]。ADAR基因全长26.13 kb,包含15个外显子,所编码的双链RNA特异性腺苷脱氨酶(double-stranded RNA-specific adenosine deaminase,DSRAD)由1 226个氨基酸组成。DSRAD发挥RNA编辑作用,能够催化腺嘌呤核苷脱氨基生成次黄嘌呤核苷,导致密码子改变或剪接位点的改变,从而影响蛋白质功能,参与某些发育相关基因的调控[8-9]。DSRAD包含2个Z-DNA结合结构域(Z-alpha)、3个双链RNA结合结构域(DSRM)以及1个腺苷脱氨酶催化结构域(ADEAMc),其中Z-alpha、DSRM结构域能够结合底物,提高RNA编辑的效率,ADEAMc结构域催化腺嘌呤核苷脱氨基生成次黄嘌呤核苷[10]。
DSH发病机制尚不明确,ADAR变异导致的单倍剂量不足可能是DSH的一种分子发病机制[11]。本研究中ADARc.3546T>G(p.Tyr1182*)无义变异导致提前终止密码子的产生,可能引起无义介导的mRNA降解,导致单倍剂量不足,引起先证者1 对称性色素异常的表型。先证者2携带的ADARc.2770T>G(p.Tyr924Asp)错义变异和先证者3携带的c.3116A>C(p.Lys1039Thr)错义变异均位于ADEAMc结构域,且924位酪氨酸(Tyr)和1 039位赖氨酸(Lys)在物种间均高度保守,因此这两个变异可能通过影响DSRAD的功能导致疾病的发生。Murata等报道了一例日本DSH散发病例携带ADARc.2770T>G(p.Tyr924Asp)错义变异[12]。目前HGMD数据库中已收录DSH相关的ADAR致病变异234个,包括错义变异128个、无义变异38个、移码变异80个、剪接变异24个,大部分均位于ADEAMc结构域(128个,54.7 %)。本研究中的3个变异均位于ADEAMc催化结构域,生物信息软件预测结果显示极有可能为致病变异,ACMG将其分类为致病变异。因此,3个家系中的新发变异c.3546T>G,c.2770T>G和c.3116A>C可能分别是3位先证者DSH的发病原因。
综上所述,本研究结合患者临床表型和遗传学检测结果,鉴定并分析了3个DSH家系的致病变异,为患者的基因诊断、临床治疗以及遗传咨询提供了依据;发现了ADAR基因新的变异位点c.3546T>G(p.Tyr1182*)、c.2770T>G(p.Tyr924Asp),丰富了ADAR基因的突变谱。
