电针对缺氧缺血性脑损伤小鼠抗神经细胞凋亡及促进神经可塑性的作用机制
2023-02-11乔梁李荣霞胡山岗
乔梁 李荣霞 胡山岗
(1河南省中医院,河南 郑州 450002;2青海省人民医院)
在我国,缺氧缺血性脑损伤(HIBI)可导致不同程度神经功能障碍〔1〕。神经功能障碍的主要原因有氧化应激、自由基损伤、神经细胞凋亡、细胞毒性等〔2,3〕。电针是在传统的针灸基础上进行改革创新,是利用结合电刺激发展起来的一种治疗技术。电针对脑缺氧缺血后导致的半暗带有很好的修复作用,改善脑能量代谢,并能明显改善患者后期的恢复情况,非常具有临床价值〔4〕。转录因子NF-E2相关因子(Nrf)2介导的信号通路是机体防御性抗氧化的重要通路,Nrf2可以对细胞抗氧化反应进行调节,并与抗氧化反应元件(ARE)共同作用对抗氧化应激过程〔5〕,在生物体中的防御抵抗机制中扮演着举足轻重的作用〔5〕。本研究探讨电针法对HIBI雄性小鼠抗神经细胞凋亡及促进神经可塑性的作用及其可能机制。
1 材料与方法
1.1实验动物 80只雄性SPF级C57BL/6小鼠购于河南省康华药业股份有限公司(许可证号:SYXK(豫)2017-0015),体重(18±3)g,在本院动物实验中心进行饲养,自由饮食,实验中心的环境温度为(24±3)℃,相对湿度(50±5)%,每天12 h循环光照。
1.2药品与主要试剂 PowerLab生理记录仪(澳大利亚AD Instruments公司),韩氏电针仪HANS-200(南京济生医疗科技有限公司),倒置显微镜(日本奥林巴斯公司),水迷宫(东乐自然基因生命科学公司),2,3,5-氯化三苯基四氮唑(TTC,美国Sigma公司,批号:T8877-25G);末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)测定法试剂盒(美国Sigma公司,批号:S7110),Nrf2 inhibitors(美国TargetMol公司,批号:M00240),反转录试剂盒(美国Sigma公司,批号:K1622),Trizol 试剂盒(TaKaRa,批号:9108-1),全蛋白抽提试剂盒(德国QIAGEN公司,批号:37901),Western印迹试剂盒(美国BD公司,批号:SNM464)。
1.3动物模型建立及分组 将实验小鼠随机分为假手术组、模型组、电针组和电针+Nrf2 inhibitors组,每组20只。根据参考文献中描述的Rice法建立HIBI模型〔6〕,对模型组、电针组和电针+Nrf2 inhibitors组建立模型:用戊巴比妥钠对小鼠进行麻醉,仰卧法固定,在颈中部消毒切开,分离左颈总动脉,采用4-0号手术线进行血管结扎,缝合伤口;2 h进行恢复后,将实验小鼠放入37℃水浴中进行密闭缺氧环境处理,给予8%O2+92%N2混合气体进行缺氧处理持续2.5 h。假手术组仅进行手术后缝合,不对其进行血管结扎和缺氧处理。参考《实验针灸学》,电针组选取部位为“内关”穴,双极电针为0.28 mm×25 mm的针灸针制成,针刺深度为1~2 mm,电针参数为:2 Hz/100 Hz,电流终刺激强度为2 mA,治疗时间20 min,每天治疗2次,持续5 d。电针+Nrf2 inhibitors组在电针刺激结束后,向小鼠腹腔注射Nrf2 inhibitors(ML385)30 mg/kg,1次/d,持续5 d。造模成功标准:模型组小鼠的神经功能评分≥2分。
1.4小鼠神经功能评分 采用盲法进行小鼠的神经功能评分。根据Bederson法〔7〕,抓取小鼠尾巴并把它抬高至离桌面10 cm处,观察各组小鼠形态并打分。标准:0分:前肢是伸展状态(无神经功能损伤);1分:对侧腕、肘屈曲,肩内收屈曲;2分:前肢抵抗对侧推力的能力水平下降;3分:对侧转圈。
1.5小鼠空间学习记忆能力考察 干预结束7 d后,随机从每组中取6只实验小鼠,采用Morris水迷宫检测方法对实验小鼠的空间学习记忆能力进行检测。其中前5 d进行平台训练:平台高30 cm、直径12 cm,然后放于迷宫的其中1个象限中,放入的水下深入为水下1 cm处;然后将小鼠分别放于4个方向,分5次进行3 min的探索直至找到平台,以小鼠到达平台的时间作为逃避潜伏期;若小鼠在2 min内没有找到平台,则被引导至平台停留15 min。从第6天开始为空间搜索阶段:将平台进行移除,把小鼠放入水迷宫中,同样的方法进行2 min的测试,以穿过平台位置的次数作为穿台指数。利用MT-200 Morris自动跟踪系统软件对实验小鼠的实验情况进行记录,以此来分析逃避潜伏期和穿台指数。
1.6小鼠脑组织梗死情况观察 干预结束后,随机从每组中另取4只实验小鼠断头处死,取出脑组织,放入4℃的磷酸盐缓冲液(PBS)中进行5 min冷却处理,然后进行切片,厚度为2 mm。然后将切片浸入2%的TTC溶液中(35℃恒温,30 min),用4℃的PBS进行2次清洗,随后进行10%甲醛溶液固定,扫描拍照。红色部位是正常的脑组织,白色部位是梗死区域的脑组织。采用Image J软件统计测量切片脑组织梗死面积,梗死面积比为梗死面积占同侧缺血脑组织总面积的百分比。
1.7海马区脑组织神经细胞凋亡情况观察 干预后,随机从每组中另取10只实验小鼠断头处死,取实验小鼠海马区脑组织,进行4%多聚甲醛固定,石蜡包埋处理后进行切片处理(厚度为4 μm),之后进行脱蜡,染色,脱水,透明,封片。采用TUNEL染色法对脑组织细胞凋亡进行检测。TUNEL阳性细胞核呈现棕褐色,镜下观察时随机选取5个视野(×400),凋亡率=阳性细胞数/总细胞数×100%。
1.8RT-qPCR检测mRNA的表达 依据Trizol法提取各组样本的总RNA,使用引物如下:B细胞淋巴瘤(Bcl)-2:上游引物:5′-GGTGGGGTCATGTGTGTGG-3′,下游:5′-CGGTTCAGGTACTCAGTCATCC-3′;半胱氨酸天冬氨酸蛋白酶(Caspase)-9:上游引物:5′-CTTCGTTTCTGCGAACTAACAGG-3′,下游:5′-GCACCACTGGGGTAAGGTTT-3′;Bcl-2相关X蛋白(Bax):上游引物:5′-CCCGAGAGGTCTTTTTCCGAG-3′,下游:5′-CCAG CCCATGATGGTTCTGAT-3′,β-actin:上游引物:5′-GTGCTATGTTGCTCTAGACT-3′,下游:5′-ATGCCACAGGATTCCATACC-3′。反应条件:75℃预变性,2 min,进入以下循环90℃变性,5 min;60℃退火,60 s;72℃延伸,30 s;共40个循环。相对表达量用2-ΔΔCT表示。独立重复实验3次。
1.9免疫组化检测Nrf2和血红素加氧酶(HO)-1 表达 组织切片进行脱蜡至水,然后再PBS溶液中进行修复,室温下3%的过氧化氢浸泡,封闭,然后进行一抗4℃孵育过夜,第2天用PBS清洗3次,加入二抗,室温孵育30 min,PBS清洗3次。加二氨基联苯胺(DAB)孵育5 min,去离子水终止反应,然后用苏木素复染5 min,清洗后进行不同浓度梯度的乙醇脱水2 h,中性树胶封片,最后用光学显微镜观察并拍照。每张切片随机选取5个高倍镜视野(×400),每个视野内计数100个细胞中阳性细胞数,阳性细胞为细胞出现棕黄色或棕褐色颗粒。
1.10Western印迹检测碱性成纤维细胞生长因子(bFGF)、脑源性神经营养因子(BDNF)、突触后密度蛋白(PSD)95和突触小泡蛋白(SYP)表达 分别收集各组样本,用总蛋白提取试剂盒提取每组中的总蛋白,二喹啉甲醛(BCA)蛋白定量试剂盒测定蛋白含量。制备蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转至聚偏氟乙烯(PVDF)膜,加含有5%牛血清白蛋白(BSA)的封闭液室温条件下封闭2 h。加入一抗在4℃条件下封闭过夜。次日用缓冲液清洗PVDF膜3次,然后加入二抗,室温孵育1 h后,加入显色液曝光显影。
1.11统计学方法 采用SPSS19.0软件进行t检验,作图工具采用Graphpad5.01软件。
2 结 果
2.1小鼠神经功能评分 与假手术组(0分)相比,模型组神经功能评分〔(2.6±0.75)分〕明显升高(P<0.05);与模型组相比,电针组神经功能评分〔(0.8±0.12)分〕明显降低(P<0.05);电针+Nrf2 inhibitors组神经功能评分〔(1.8±0.37)分〕明显低于模型组,明显高于电针组(P<0.05)。
2.2小鼠空间学习记忆能力 水迷宫实验结果显示在平台训练阶段,随着训练时间的推移和次数的增加,模型组、电针组、电针+Nrf2 inhibitors组逃避潜伏期逐渐缩减(均P<0.01);与假手术组相比,模型组逃避潜伏期在各时间点均显著变长(P<0.05);与模型组相比,电针组逃避潜伏期在各时间点均显著变短;电针+Nrf2 inhibitors组逃避潜伏期较模型组明显缩短,较电针组明显延长(P<0.05)。在空间搜索阶段,与假手术组相比,模型组穿台指数显著降低;与模型组相比,电针组穿台指数显著升高,电针+Nrf2 inhibitors组穿台指数明显高于模型组,明显低于电针组(P<0.05)。见表1。

表1 各组逃避潜伏期和穿台指数比较
2.3电针对小鼠脑组织梗死的影响 假手术组脑组织呈红色,无白色区域,表明无梗死现象发生;与假手术组相比,模型组脑组织中的白色梗死区域明显变大,梗死面积比显著上升;与模型组相比,电针组脑组织的白色梗死区域面积明显缩小,梗死面积比显著降低;电针+Nrf2 inhibitors组白色梗死区域面积介于模型组和电针组之间,以上差异均有统计学意义(P<0.05)。见图1、表2。
2.4电针对小鼠神经细胞凋亡的影响 假手术组未见TUNEL阳性细胞,与假手术组相比,模型组的脑组织切片中TUNEL阳性细胞数量显著增多,细胞凋亡率明显升高(P<0.05);与模型组相比,电针组TUNEL阳性细胞数量显著减少,细胞凋亡率明显降低(P<0.05);电针+Nrf2 inhibitors组脑组织切片中TUNEL阳性细胞数量,细胞凋亡率明显低于模型组,明显高于电针组(均P<0.05)。见表2、图2。

图1 各组脑组织的TTC染色(×10)

表2 各组脑组织梗死面积比、细胞凋亡率结果及Bax、Caspase-9、Bcl-2的mRNA表达量比较

图2 各组脑组织(TUNEL染色,×400)
2.5Bax、Caspase-9、Bcl-2 mRNA表达 与假手术组比较,模型组Bax和Caspase-9 mRNA表达明显升高,Bcl-2 mRNA表达明显降低(P<0.05);与模型组比较,电针组Bax和Caspase-9 mRNA表达明显降低,Bcl-2 mRNA表达明显升高(P<0.05);电针+Nrf2 inhibitors组中Bcl-2、Bax和Caspase-9 mRNA表达水平介于模型组和电针组之间,组间差异均有统计学意义(P<0.05)。见表2。
2.6免疫组化检测Nrf2和HO-1表达 与假手术组相比,模型组中Nrf2和HO-1蛋白阳性细胞数明显降低(P<0.05);与模型组相比,电针组Nrf2和HO-1蛋白阳性细胞数明显升高(均P<0.05);电针+Nrf2 inhibitors组中Nrf2和HO-1蛋白阳性细胞数介于模型组和电针组之间,组间差异均有统计学意义(均P<0.05),见表3,图3。
2.7bFGF、BDNF、PSD95 和 SYP 蛋白表达量检测结果 与假手术组相比,模型组脑组织中bFGF、BDNF、PSD95和SYP蛋白表达水平均明显下调(P<0.05);电针组中上述蛋白的表达水平较模型组均明显上调;电针+Nrf2 inhibitors组中bFGF、BDNF、PSD95和SYP蛋白表达水平介于模型组和电针组之间,组间差异均有统计学意义(P<0.05)。见图4,表3。

表3 各组Nrf2和HO-1阳性染色细胞数量、bFGF、BDNF、PSD95和SYP蛋白表达比较

图3 Nrf2和HO-1海马区脑组织中的表达变化(免疫组化,×400)
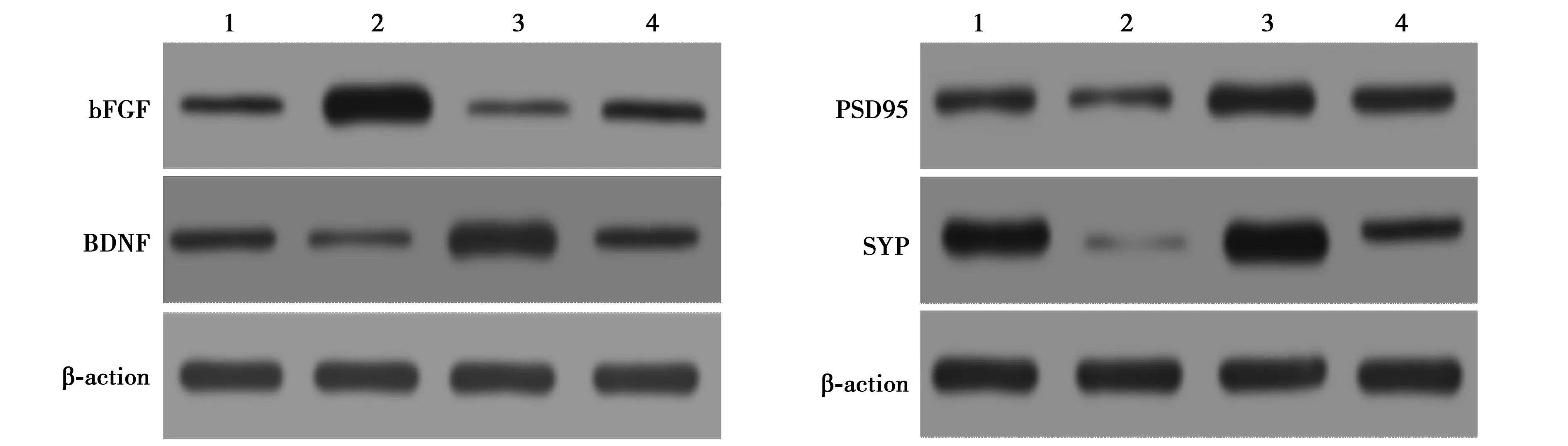
1~4:假手术组、模型组、电针组、电针+Nrf2 inhibitors组
3 讨 论
电针是近些年来在传统针灸技术基础上通过改革创新而发展起来的一种治疗技术,利用结合电刺激方式被广泛地应用于临床治疗中,尤其是在缺氧缺血性脑损伤及神经损伤恢复等方面引起广泛关注〔8〕。刘波等〔9〕研究发现,电针法发挥脑保护效应可能是通过减少自由基和抑制大脑皮质内凋亡诱导因子,进而对受损的神经细胞进行改善和修复。然而,目前关于电针治疗脑缺氧缺血的具体作用机制尚不十分清楚〔10〕。本研究结果证明,电针可对HIBI小鼠的神经功能损伤具有改善效果。
研究表明,当小鼠脑组织发生缺氧缺血损伤时,神经细胞由于会产生活性氧和自由基等,最终将会使神经细胞发生凋亡〔11〕。其中Bcl-2、Caspase-9及Bax是与细胞凋亡息息相关的基因,通过激活Caspase-9和Bax可以促进细胞凋亡,而Bcl-2可以抑制细胞凋亡〔12〕。马竞等〔13〕通过构建HIBI小鼠模型指出,党参多糖可以通过调控Bax和Bcl-2等细胞凋亡相关的基因表达来抑制HIBI所导致的神经细胞凋亡。本研究结果表明,电针可以降低HIBI小鼠脑组织的神经细胞凋亡。
Nrf2信号通路在抗氧化还原、氧化应激等方面具有非常重要的作用〔14〕,Nrf2是在细胞进行氧化应激过程中的关键因子,通常情况下Nrf2与Keap1在细胞质中结合,此时是未激活状态;当受到刺激被激活时,Keap1-Nrf2结合体变得不稳定,Keap1发生降解,Nrf2被释放出来转移到细胞核内,促进下游GST、HO-1或NQO1等一系列启动保护性蛋白基因的表达〔15〕。Gao等〔16〕发现,通过对Nrf2/HO-1通路进行调控,可以减轻HIBI模型大鼠的氧化应激和炎症反应,提示Nrf2/HO-1通路的神经保护作用潜力。研究表明,电针可以促进Nrf2和ARE的表达,从而启动细胞氧化应激机制〔17〕。本研究结果可能与HIBI模型小鼠抗氧化还原、氧化应激有着密切关系。神经生长因子对中枢和外周神经元的生长发育分化具有促进作用,维持神经系统的正常功能,加快神经功能损伤后的修复〔18〕。bFGF和BDNF是神经生长因子家族的一种,能促进神经细胞增殖、生长、分化,促进缺氧缺血性脑损伤修复〔19〕,PSD95和SYP也是突触后信号转导和整合的关键物质,与HIBI也密切相关〔20〕。Sheng等〔21〕指出,BDNF-TrkB途径可以通过稳定离子稳态、抑制兴奋性递质释放和减弱中断的神经元传递来保护神经元,对HIBI具有神经可塑性;邬春久等〔22〕则表明,上调PSD95蛋白表达对HIBI具有改善作用。本研究表明电针可以促进HIBI模型小鼠的神经可塑性,进一步发挥神经保护作用。
