Beclin1在大鼠糖尿病溃疡创面组织中表达变化
2023-02-11麻华胆黄庆郑爱甜刘贤彬李政王琳曾娜吴标良
麻华胆 黄庆 郑爱甜 刘贤彬 李政 王琳 曾娜 吴标良
(右江民族医学院 1附属医院内分泌科,广西 百色 533000;2研究生学院)
糖尿病溃疡创面为糖尿病常见的并发症,其中糖尿病足溃疡是非外伤性低位截肢的主要原因〔1〕,给家庭与社会带来严重的医疗负担。糖尿病溃疡创面属慢性难愈性创面,愈合机制复杂,其潜在机制尚未完全阐明。细胞自噬是一个保守的细胞降解过程,在维持体内平衡和预防营养、代谢和感染介导的应激中起重要作用,自噬与凋亡之间存在错综复杂的关系,在糖尿病溃疡创面的发生发展中扮演重要角色。自噬相关蛋白(Beclin)1可单独或以Beclin1-B细胞淋巴瘤(Bcl)-2复合物的形式参与自噬和凋亡的调节〔2〕。本实验通过观察糖尿病创面愈合过程中Beclin1表达的变化,探讨糖尿病溃疡创面愈合不良的机制。
1 材料与方法
1.1实验动物 SPF级Wistar雄性大鼠18只,体重230~260 g,由长沙市天勤生物技术有限公司提供。该实验经右江民族医学院动物伦理委员会批准。
1.2主要试剂 链脲佐菌素(STZ) 北京华越洋生物科技有限公司生产;Beclin1、p-Beclin1(phos Ser 14)抗体:Abcam公司生产;二抗、β-actin抗体:北京中杉金桥生物技术有限公司生产;Beclin1、β-actin引物:上海捷瑞生物工程有限公司合成;总RNA提取试剂盒、cDNA第一链合成试剂盒、SYBR Green荧光定量检测试剂盒:天根生化科技(北京)有限公司生产。
1.3动物分组及创面模型建立 大鼠予适应性喂养1 w后随机分为对照组、模型组各9只。对照组不建立糖尿病模型,在背部备皮后即行全层皮肤切除(面积约2.5 cm×2.5 cm);模型组给予STZ诱导建立糖尿病模型,模型复制成功后进行全层皮肤切除,即完成糖尿病创面大鼠模型的建立〔3〕。
1.4标本采集与处理 各组分别于皮肤切除后第1天、第11天、第18天各随机取3只大鼠,麻醉后剪取创面组织,分别用于制作苏木素-伊红(HE)染色切片及行实时荧光定量-聚合酶链反应(qRT-PCR)和Western印迹检测。
1.5HE染色观察创面组织病理改变 创面组织予10%甲醛溶液固定48 h后依次用乙醇梯度脱水、二甲苯透明、浸蜡包埋、切片、HE染色制片,光学显微镜下观察炎症细胞浸润、血管形成及再上皮化情况。
1.6Western印迹检测Beclin1、p-Beclin1的表达 将预先加入磷酸酶抑制剂的组织裂解液裂解组织样品,提取总蛋白,制作十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后等体积上样,以Beclin1和p-Beclin1一抗孵育聚偏氟乙烯(PVDF)膜过夜,次日进行二抗孵育,化学发光凝胶成像系统显影,蛋白质灰度分析采用ImageJ软件。
1.7qRT-PCR法检测Beclin1 mRNA的表达 以未造模大鼠背部正常皮肤组织作为对照样本,Trizol法提取总RNA,测定总RNA浓度并进行质量分析,按照反转录说明书将质量合格(A260/A280比值在1.8~2.1之间)的总RNA进行反转录,合成cDNA后进行qRT-PCR,采用公式F=2-ΔΔCt对Ct值进行转换。
1.8统计学分析 采用SPSS17.0软件进行独立样本t检验、单因素方差分析。
2 结 果
2.1创面愈合情况及组织病理改变 第11天,对照组创面干燥平整,表面覆盖少许痂皮,模型组创面水肿明显,表面凹凸不平,对照组创面面积明显小于模型组。显微镜下,对照组胶原及毛细血管形成情况优于模型组,而炎症细胞浸润较轻。第18天,对照组创面基本愈合,镜下可观察到完整表皮及皮肤附属器;模型组创面红润,轻微水肿,镜下可见炎症细胞浸润及广泛分布的毛细血管网,但均较第11天明显减少。见图1、图2。
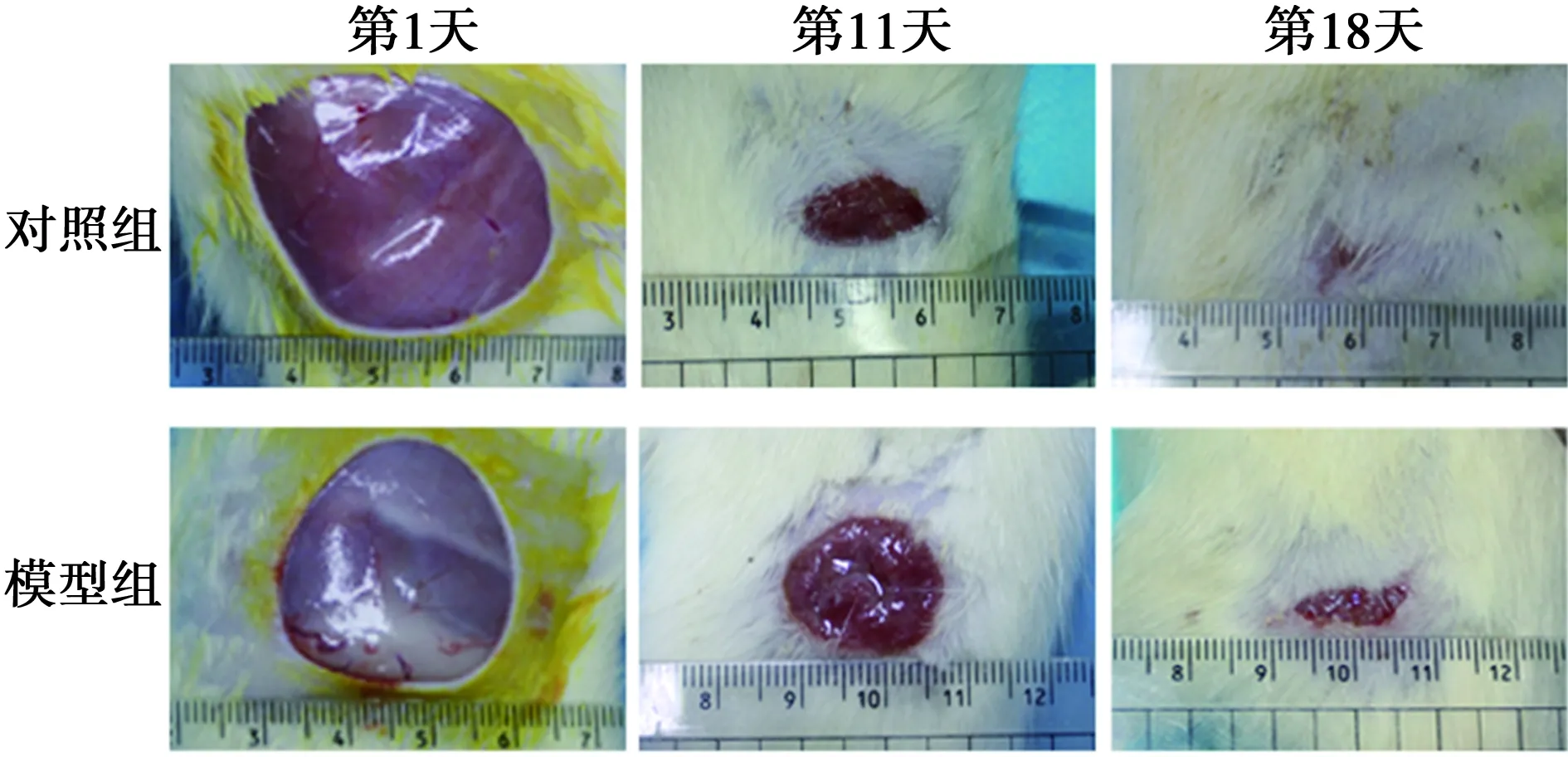
图2 两组创面愈合情况
2.2Beclin1、p-Beclin1蛋白检测 Western印迹结果显示,第1天、第11天,对照组Beclin1、p-Beclin1表达明显高于模型组,第18天,对照组Beclin1、p-Beclin1表达明显低于模型组(均P<0.05)。创面愈合过程中,对照组Beclin1、p-Beclin1表达升高后下降,第11天的表达量最高;模型组Beclin1、p-Beclin1表达升高后趋于平稳或轻微下降,第11天的表达量最高,第1天的表达量最低。见表1、图3。
2.3Beclin1 mRNA检测 qRT-PCR结果显示,第1天、第11天,对照组Beclin1 mRNA表达明显高于模型组,第18天,对照组Beclin1 mRNA表达明显低于模型组(P<0.05)。创面愈合过程中,对照组Beclin1 mRNA表达升高后下降,第11天的表达量最高,第1天的表达量最低;模型组Beclin1 mRNA表达升高后趋于平稳,第11天的表达量最高,第1天的表达量最低。见表1。
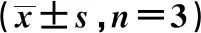
表1 两组创面组织内Beclin1蛋白p-Beclin1蛋白及Beclin1 mRNA表达水平比较

图3 两组创面组织内Beclin1/p-Beclin1蛋白表达
3 讨 论
细胞自噬在创面愈合中发挥重要作用,在创面形成早期,自噬通过激活炎症细胞、增强其吞噬功能而发挥高效的抗感染免疫,在炎症反应后期,巨噬细胞自噬促进其向M2转化,启动创面修复,此后,细胞自噬一方面加强血管形成,促进成纤维细胞的增殖分化及胶原合成,别一方面促进角质形成细胞的迁移而加快创面组织上皮化〔4〕。反之,细胞凋亡的增加被认为是创面愈合延迟的主要原因之一。Beclin1是UNC-51样激酶(ULK)1的下游分子,活化的ULK1通过磷酸化Beclin1的Ser 14位点,进一步激活膜泡分拣蛋白(VPS)34,以诱导自噬的发生〔2〕。自噬活性亦与Beclin1-Bcl-2复合体的状态相关,Bcl-2通过与Beclin1的BH3结构域结合而抑制Beclin1的活性,反之,Beclin1-Bcl-2复合体的解离则恢复Beclin1活性,有利于提高自噬水平〔5〕。Bcl-2作为重要的抗凋亡蛋白,与Beclin1的稳定结合亦影响其生物学功能而促进细胞凋亡〔6〕。
本研究结果表明,糖尿病状态抑制创面的愈合,主要原因为胰岛素相对或绝对不足引起的细胞代谢异常、糖基化终产物(AGEs)的堆积〔7〕、免疫功能紊乱〔8〕等,上述众多因素相互影响、共同作用,导致糖尿病创面炎症反应迁延不愈、成纤维细胞增殖分化受限、胶原合成减少、再上皮化延迟。本研究结果表明,细胞自噬在糖尿病创面组织中受到抑制,可能与糖尿病状态下的细胞功能受损及蛋白合成障碍有关。研究表明,高糖可直接〔9〕或通过AGEs〔10〕的堆积,引起溶酶体功能受损并阻断自噬流。另有研究指出,高糖环境下,自噬相关蛋白(Atg)基因的转录受抑制,进而导致自噬失活〔11〕。本研究结果提示,创面形成早期高度的应激及缺血缺氧有关的细胞饥饿状态抑制哺乳动物雷帕霉素靶蛋白复合体(mTORC)1,进而激活自噬启动因子ULK1,引发自噬。在此过程中,Beclin1的表达及磷酸化水平与自噬体的形成密切相关。研究表明,Beclin1的磷酸化是Beclin1从Beclin1-Bcl-2复合体解离而恢复其生物活性所必须〔2,5〕,可见,在特定情况下,Beclin1的磷酸化水平与其表达量及活性相辅相成,共同影响自噬活性。创面愈合晚期,对照组Beclin1、p-Beclin1蛋白及Beclin1 mRNA表达水平的显著降低可能是随着创面的愈合,缺血缺氧改善,蛋白合成增加,mTORC1抑制解除,引起Beclin1低表达并发生去磷酸化。由于模型组创面愈合延迟,至第18天仍未完全上皮化,细胞仍处于能量缺乏状态,而对照组在此时已基本愈合,血运的恢复使局部缺血缺氧改善,蛋白质充分合成,因此模型组较对照组具有更强的自噬诱导作用,从而表现为模型组Beclin1、p-Beclin1蛋白及Beclin1 mRNA在第18天的表达量高于对照组,且与组内第11天的表达量无明显差异。该结果同时表明,虽然糖尿病状态抑制创面组织细胞自噬,但该抑制作用远不如能量缺乏对自噬的诱导作用。
自噬和凋亡为两种主要的细胞程序性死亡机制,在诸多情况下,二者表现为相互抑制的关系,Beclin1-Bcl-2复合体被认为是细胞自噬和细胞凋亡的“切换开关”,Beclin1及其磷酸化水平的升高在激活自噬的同时,抑制细胞凋亡〔6〕。因此,模型组创面愈合早期Beclin1、p-Beclin1蛋白及Beclin1 mRNA的低表达也可能与细胞凋亡的激活有关,即糖尿病通过影响Beclin1的表达及磷酸化水平,进而抑制细胞自噬,促进细胞凋亡。
综上,糖尿病状态抑制Beclin1表达,可能为糖尿病溃疡创面愈合延迟的机制之一。
