异柠檬酸脱氢酶1突变相关胶质瘤MRI特征及预后
2023-02-11李鹏陈颖李艳玲张文静
李鹏 陈颖 李艳玲 张文静
(济南市人民医院影像科,山东 济南 271100)
胶质瘤在中枢神经系统肿瘤中约占27%,在原发性恶性肿瘤中约占80%〔1〕。研究表明〔2〕,O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子甲基化、1p/19q缺失及异柠檬酸脱氢酶(IDH)1突变是表征胶质瘤的分子标志物。IDH1/2主要见于Ⅱ、Ⅲ级星形细胞瘤和少突胶质细胞瘤,很少见于原发性胶质母细胞瘤或毛细胞型星形细胞瘤〔3〕。在胶质瘤中也存在IDH2基因突变,但IDH1突变比IDH2突变更常见。研究表明〔4〕,IDH1突变体存活期与IDH1野生型存活期显著不同。目前,对少突胶质细胞瘤及多形性成胶质细胞瘤患者研究中发现MRI特征与基因表型存在相关性〔5〕。本研究旨在探讨IDH1突变与胶质瘤患者MRI特征及预后间的关系。
1 对象与方法
1.1研究对象 选取2013年5月至2015年5月在济南市人民医院收治的106例胶质瘤患者。其中男50例,女56例,平均年龄(65.4±4.6)岁。IDH1突变型胶质瘤57例,IDH1野生型胶质瘤49例。低级别胶质瘤56例,高级别胶质瘤50例。纳入标准:(1)临床和影像学资料完整。(2)术前未进行其他放疗,化疗等辅助治疗;(3)手术后经组织病理学诊断为胶质瘤。排除标准:(1)患者有其他恶性肿瘤病史;(2)患者有相关的术后并发症,如颅内血肿,颅内感染等;(3)因其他疾病死亡的患者。本研究经医院伦理委员会批准,所有患者同意参加并签署知情同意书。
1.2IDH1突变检测 IDH1突变采用直接测序法检测。将测序序列与IDH1的原始序列进行比较,以分析特定碱基位置是否突变。根据EZNA TISSUE DNA KIT(美国OMEGA)操作手册从肿瘤组织中提取DNA。采用分光光度计测量DNA纯度和含量。根据IDH1基因组序列设计引物,上游引物序列:5′-CGGTCTTCAGAGAAGCCATT-3′,下游:5′-GCAAAATCACATTATTGCCAAC-3′。退火温度为60℃,PCR产物的长度129 bp。DNA的纯化和测序由上海生工生物工程股份有限公司完成。
1.3影像学检查 采用德国Siemens公司Verio 3.0T超导型磁共振扫描仪进行扫描。患者术前接受常规MRI和增强MRI扫描,包括T1加权成像(T1WI)、T2WI、液体衰减反转恢复(FLAIR)、T1WI+C。扫描参数:(1)T1WI:重复时间(TR) 2 270 ms,回波时间(TE) 20 ms,视野(FOV) 196 mm×196 mm,矩阵288×190,激励次数(NEX)为2,层厚6 mm,层间距1 mm。(2)T2WI:TR 2 500 ms,TE 90 ms,FOV 230 mm×230 mm,矩阵420×306,NEX为2,层厚6 mm,层间距1 mm。(3)FLAIR:TR 8 000 ms,TE 120 ms,FOV 230 mm×230 mm,矩阵:304×216,NEX为2,层厚6 mm,层间距1 mm。(4)T1WI+C:TR 200 ms,TE 2 ms,FOV 230 mm×230 mm,矩阵256×256,NEX为2,层厚6 mm,层间距1 mm。对比剂采用钆喷酸葡胺(Gd-DTPA),剂量为0.1 ml/kg。
1.4评价指标及随访 肿瘤的影像学特征包括:肿瘤位置、肿瘤边界、肿瘤信号、强化程度、占位效应、水肿、越过中线、室管膜下瘤、肿瘤直径等。肿瘤位置:单脑叶受累包括额/颞/顶/枕叶;多脑叶受累包括额/顶/颞叶-胼胝体或额/颞叶-岛叶;脑干/丘脑受累。占位效应:轻度为移位<肿瘤直径1/4;中度为肿瘤直径1/4≤移位<肿瘤直径1/2;重度为移位≥肿瘤直径1/2。水肿程度:轻度为水肿<肿瘤直径1/2;中度为水肿≥肿瘤直径1/2,但小于肿瘤直径;重度为水肿≥肿瘤直径。肿瘤信号强化程度根据病灶增强后信号强度减去病灶增强前信号强度,并根据增强前后背景噪声差进行校正,将强化程度分为:轻度强化(<100)、中度强化(100~300)、重度强化(>300)。卡氏功能状态(KPS)得分越高,健康状况越好,>80分者术后状态较好,存活期较长。
随访方式包括查阅住院病历及电话查询。随访的内容包括术后5年生存状况,如果患者存活,则记录其术后放疗及化疗后的身体状况。
1.5统计学方法 采用SPSS19.0软件进行χ2检验或Fisher确切概率法。单因素生存分析采用Kaplan-Meier曲线法,组间比较采用Log-rank检验;多因素生存分析采用Cox回归模型。
2 结 果
2.1IDH1突变与胶质瘤MRI特征之间的关系 与IDH1野生型胶质瘤比较,IDH1突变型胶质瘤单脑叶受累、肿瘤信号均匀、轻/中度强化比例明显升高(P<0.05)。IDH1突变型与IDH1野生型胶质瘤患者在肿瘤边界、占位效应、水肿、越过中线、室管膜下瘤、肿瘤直径等MRI特征之间无显著差异(P>0.05),见图1、图2、表1。
2.2IDH1突变与脑胶质瘤预后之间的关系 Kaplan-Meier生存曲线结果示,IDH1突变型总生存期〔23.00(13.75,49.00)〕显著高于IDH1野生型患者〔11.00(5.00,18.00),χ2=40.810,P<0.001〕,KPS评分≤80分总生存期〔11.00(6.25,15.00)〕显著低于KPS评分>80分患者〔21.00(14.00,25.75),χ2=42.827,P<0.001〕,高级别胶质瘤总生存期〔11.5(6.00,18.00)〕显著低于低级别胶质瘤患者〔18.50(10.50,49.00),χ2=43.854,P<0.001〕。见图3。
2.3胶质瘤预后多因素Cox回归分析 多因素Cox回归分析结果显示,KPS评分≤80分、高级别胶质瘤是胶质瘤预后的独立危险因素,IDH1突变型为独立保护因素(均P<0.001)。见表2。
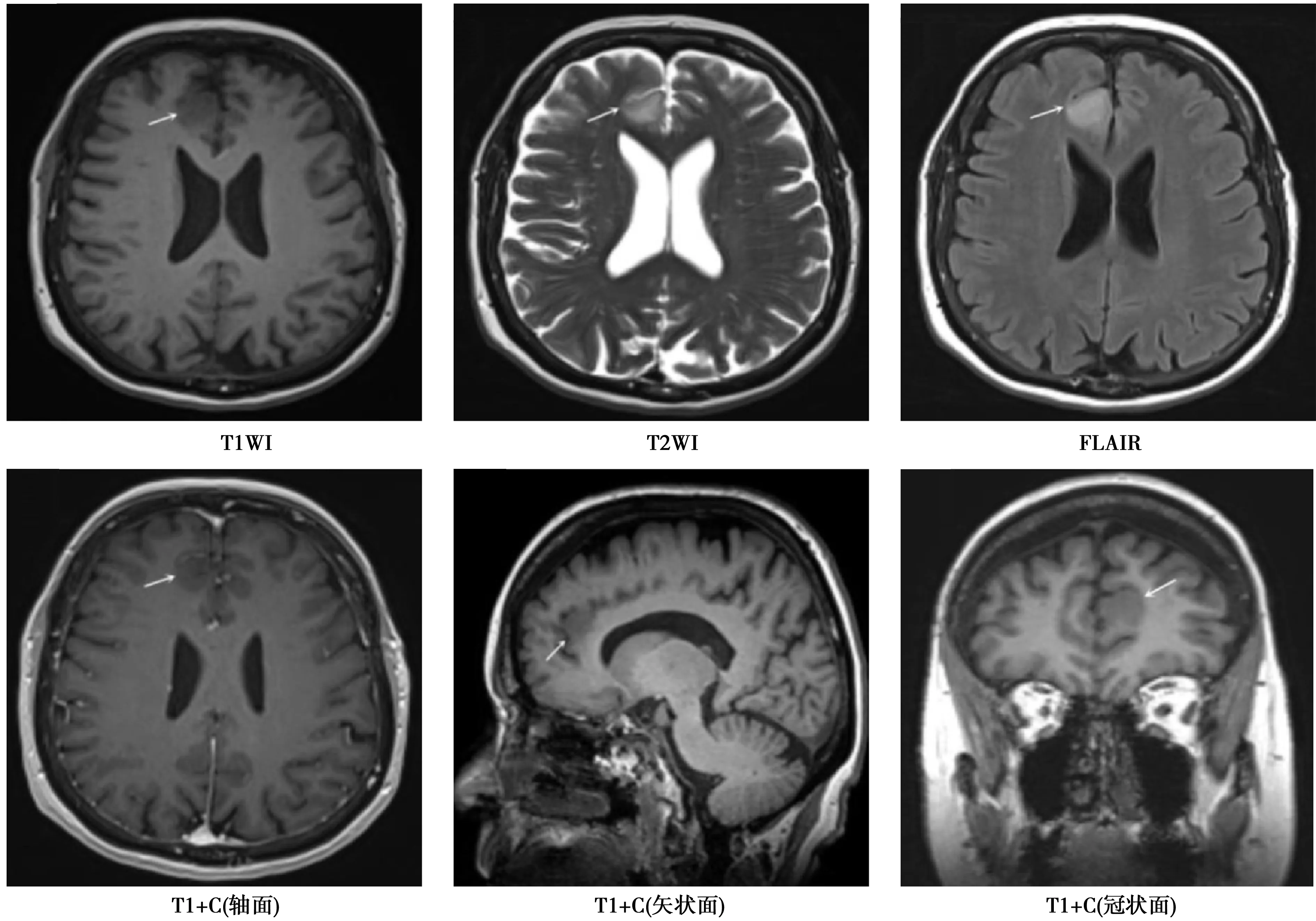
病变边界清晰,T1WI、T2WI及FLAIR信号强度均匀。病变在T1WI增强后呈现轻度增强
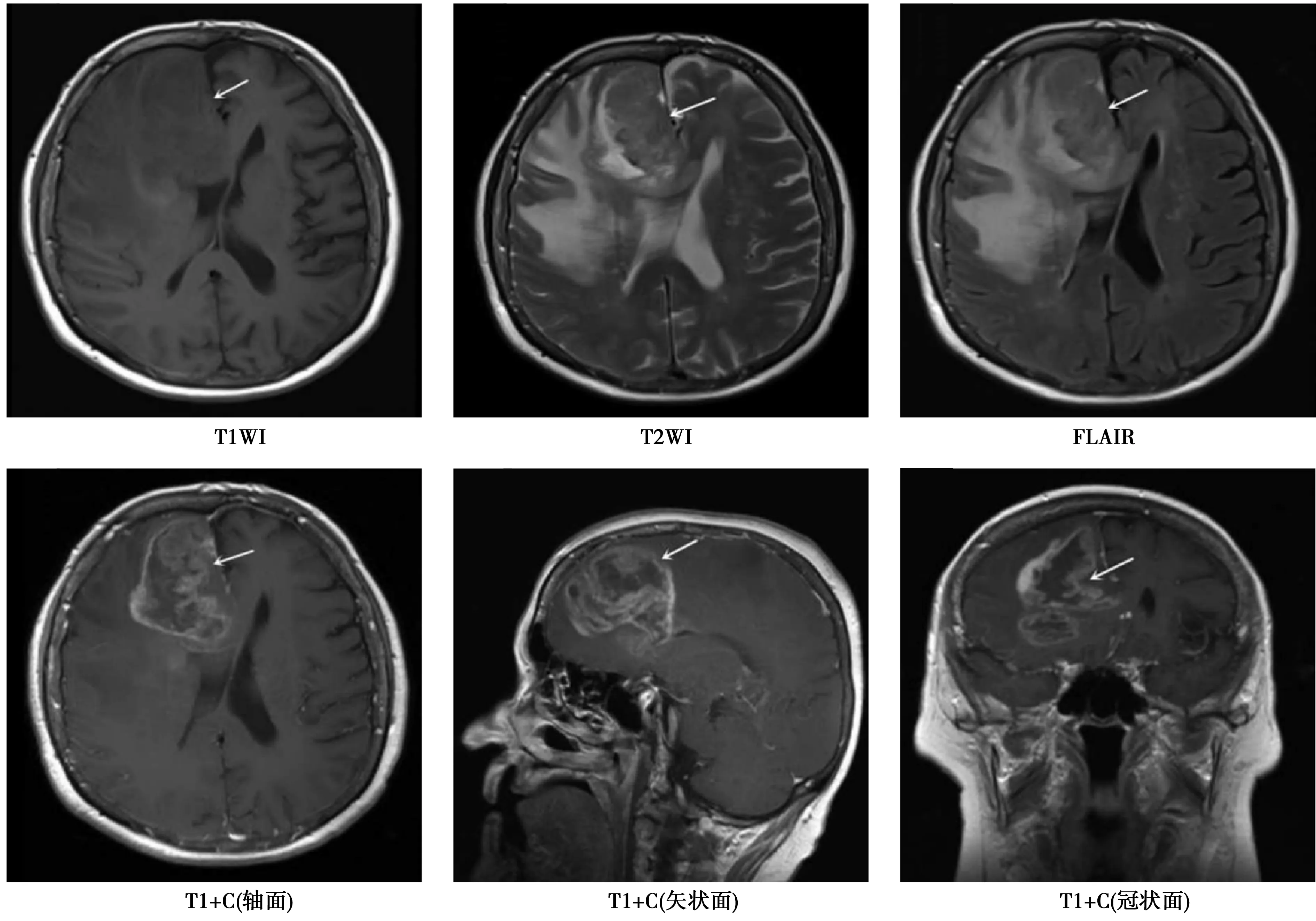
病变边界模糊,T1WI、T2WI及FLAIR信号强度不均匀。病变在T1WI增强后呈现重度增强

表1 IDH1突变与胶质瘤MRI特征之间的关系(n)

图3 胶质瘤患者Kaplan-Meier生存曲线

表2 胶质瘤预后多因素Cox回归分析
3 讨 论
临床上对颅内肿瘤首选的影像学检查为MRI,可根据肿瘤的形态、信号及强化程度等特征对颅内肿瘤进行诊断〔6〕。研究表明〔7〕,不同突变状态的胶质瘤具有不同的MRI特征。Delfanti等〔8〕在Ⅱ/Ⅲ级胶质瘤的研究中发现IDH突变型肿瘤更多的位于额叶。Malueka等〔9〕对Ⅱ级星形细胞瘤研究中发现,IDH野生型多脑叶受累较IDH突变型显著升高。此外,Villanueva-Meyer等〔10〕对Ⅱ级弥漫型星形细胞瘤的研究中发现,位于脑干的6例肿瘤均为IDH野生型。本研究中IHD1突变型单脑叶受累主要位于额叶或颞叶等手术易切除部位,这可能与IDH1突变型胶质瘤具有较长的生存期和较好的预后有关。IDH1突变型胶质瘤肿瘤信号表现为均匀,且强化程度更低,这与先前报道的结果一致〔11〕。Bahrami等〔12〕在对Ⅱ/Ⅲ级胶质瘤的MRI特征分析中发现,IDH突变型FLAIR表现出更高的信号,而IDH野生型更易表现出边缘强化特征。此外,Kim等〔13〕在研究低级别胶质瘤的MRI特征中发现IDH野生型胶质瘤边界更为模糊,T2WI上肿瘤最长径较IDH1突变型更长,肿瘤全切除率和次全切除率更低,提示IHD1突变型胶质瘤侵袭性可能更弱。
本研究结果与Ren等〔14〕研究结果一致。Tateishi等〔15〕报道中指出IDH1突变胶质瘤的预后与化疗药物的使用无显著相关性,提示了IDH1突变型胶质瘤的预后较好可能与其生物学行为较低有关,而并非化疗的治疗效果。本研究结果与大多数研究报道一致〔16,17〕,术前KPS评分是评估患者总体功能状态的指标,术前KPS评分越高,患者的功能状况越好,对手术、放疗及化疗的耐受性越好〔18〕。高级别胶质瘤指WHO Ⅲ~Ⅳ级胶质瘤,其恶性程度高、生长较为迅速、手术切除率低且术后易复发等,通常具有较差的预后〔19〕。
综上,IDH1突变型胶质瘤MRI特征表现为单脑叶受累、均匀的信号强度及轻/中度强化。此外,IDH1突变、术前KPS评分>80分且低级别胶质瘤的患者可能具有更好的预后。
