LncRNA LINC01503调控miR-331-3p/Nrf2/Keap1信号通路对缺氧诱导PC12细胞损伤的影响
2023-02-11符瑾文立陈丽丽
符瑾 文立 陈丽丽
(海南医学院附属海南医院康复医学中心高压氧科,海南 海口 570311)
缺血性脑卒中等急性脑血管疾病具有高病发率、高死亡率等特点,已严重威胁人类生命安全,缺血缺氧可引起神经细胞损伤而造成神经系统功能障碍,目前急性脑血管疾病的发病机制尚未阐明,因而探究其发病机制有助于提高其治疗效果及改善患者预后〔1〕。长链非编码RNA(LncRNA)在缺氧诱导的大鼠肾上腺嗜铬细胞瘤细胞PC12中表达异常,沉默LncRNA MEG3可通过抑制TIMP2启动子甲基化而减轻缺氧诱导的PC12细胞损伤〔2〕。LncRNA EFNA3表达下调通过上调miR-101a加重缺氧诱导的PC12细胞损伤〔3〕。微小RNA-331-3p(miR-331-3p)在脊髓损伤中表达下调,并可通过靶向RAP1A减轻脊髓损伤,Starbase预测显示LncRNA LINC01503与miR-331-3p存在结合位点,已知LINC01503表达上调可促进胆管癌细胞增殖及侵袭〔4,5〕。脑组织氧化应激可激活核因子相关因子(Nrf)2/Kelch样ECH相关蛋白(Keap)1信号通路从而造成脑组织损伤〔6〕。本研究探究LINC01503对缺氧诱导PC12细胞增殖、凋亡及氧化应激的影响,及其对miR-331-3p/Nrf2/Keap1信号通路的调控作用。
1 材料与方法
1.1材料与试剂 上海通派生物提供大鼠肾上腺嗜铬细胞瘤细胞PC12;上海联迈生物提供Trizol试剂;北京天根生化提供反转录试剂与荧光定量PCR试剂;上海吉玛制药提供si-NC、si-LINC01503、miR-NC、miR-331-3p mimics、anti-miR-NC、anti-miR-331-3p;美国Invitrogen提供pcDNA3.1、pcDNA-LINC01503、Lipofectamine2000;上海江林生物提供噻唑蓝(MTT)试剂;上海翊圣生物提供细胞凋亡检测试剂盒;南京建成生物提供丙二醛(MDA)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)检测试剂盒;美国Santa Cruz提供兔抗鼠细胞周期蛋白(Cyclin)D1、裂解半胱天冬酶(Cleaved-caspase)-3抗体;武汉博士德生物提供辣根过氧化物酶(HRP)标记的山羊抗兔二抗。
1.2方法
1.2.1实验分组 PC12细胞培养于含10%胎牛血清与青霉素-链霉素混合溶液的DMEM培养液内,于37℃、95%O2、5%CO2恒温培养箱内培养,PC12细胞接种于6孔板(5×103个/孔)或96孔板(3×103个/孔),置于37℃、1%O2、95%N2、5%CO2恒温培养箱内缺氧处理24 h〔7〕,记为hypoxia组。同时将正常培养的细胞作为NC组。采用Lipofectamine2000试剂分别将si-NC、si-LINC01503、miR-NC、miR-331-3p mimics、anti-miR-NC、anti-miR-331-3p、si-LINC01503与anti-miR-NC、si-LINC01503与anti-miR-331-3p转染至PC12细胞48 h后进行缺氧处理24 h,分别记为hypoxia+si-NC组、hypoxia+si-LINC01503组、hypoxia+miR-NC组、hypoxia+miR-331-3p组、anti-miR-NC+hypoxia组、anti-miR-331-3p+hypoxia组、si-LINC01503+anti-miR-NC+hypoxia组、si-LINC01503+anti-miR-331-3p+hypoxia组。
1.2.2实时荧光定量聚合酶链反应(qRT-PCR)检测细胞中LINC01503、miR-331-3p的表达水平 采用Trizol法提取各组PC12细胞总RNA,反转录。按照荧光定量检测试剂盒说明书进行qRT-PCR,应用罗氏LightCycler480荧光定量PCR仪检测各组细胞中LINC01503(内参β-actin)、miR-331-3p(内参U6)相对表达量。
1.2.3MTT检测细胞增殖 取各组PC12细胞接种于96孔板(3×103个/孔),分别加入MTT溶液(20 μl/孔)与二甲基亚砜(DMSO,150 μl/孔),培养4 h后弃上清,加入DMSO(室温孵育5 min),检测各组相对吸光度(A)值。
1.2.4流式细胞术检测细胞凋亡率 取各组PC12细胞加入预冷PBS洗涤,弃上清,加入结合缓冲液200 μl重悬细胞,分别加入5 μl膜联蛋白V异硫氰酸荧光素(Annexin V-FITC)与碘化丙啶(PI),避光孵育15 min,加入300 μl结合缓冲液后应用CytoFLEX流式细胞仪检测各组细胞凋亡率。
1.2.5检测MDA、LDH、SOD的含量 取细胞培养上清液,严格按照试剂盒说明书检测LDH、MDA、SOD的含量。
1.2.6双荧光素酶报告基因检测LINC01503与miR-331-3p靶向关系 构建含有结合位点的野生型载体LINC01503-WT与含有突变位点的突变型载体LINC01503-MUT,分别将miR-NC、miR-331-3p mimics与LINC01503-WT、LINC01503-MUT共转染至PC12细胞,检测其相对荧光素酶活性。
1.2.7Western印迹检测CyclinD1、Cleaved-caspase-3、Nrf2、Keap1蛋白表达 取各组PC12细胞加入放射免疫沉淀(RIPA)裂解液(400 μl)提取细胞总蛋白,取50 μg蛋白样品进行SDS-PAGE电泳,转膜、封闭,孵育一抗稀释液(1∶1 000)24 h(4℃),TBST洗涤后孵育二抗稀释液(1∶5 000)1 h(室温),滴加电化学发光液(ECL),曝光、显影后应用ImageJ软件分析各条带灰度值。
1.3统计学方法 采用SPSS21.0软件进行t检验、方差分析。
2 结 果
2.1缺氧诱导的PC12细胞损伤模型中,LINC01503和miR-331-3p表达情况 与NC组比较,hypoxia组LINC01503的表达水平明显升高(P<0.05),miR-331-3p的表达水平明显降低(P<0.05),见表1。
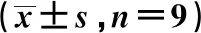
表1 缺氧诱导的PC12细胞模型中,LINC01503和miR-331-3p表达
2.2低表达LINC01503对缺氧诱导PC12细胞损伤的影响 与NC组比较,hypoxia组A值、CyclinD1蛋白水平、SOD含量明显降低,凋亡率、Cleaved-caspase-3蛋白水平、MDA、LDH明显升高(P<0.05);与hypoxia+si-NC组比较,hypoxia+si-LINC01503组A值、CyclinD1蛋白水平、SOD含量明显升高(P<0.05),凋亡率、Cleaved-caspase-3蛋白水平、MDA、LDH含量明显降低(P<0.05),见图1、表2、图2。

图1 流式细胞仪检测细胞凋亡
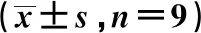
表2 低表达LINC01503对缺氧诱导PC12细胞损伤的影响

1~4:NC组,hypoxia组,hypoxia+si-NC组,hypoxia+si-LINC01503组
2.3高表达miR-331-3p对缺氧诱导PC12细胞损伤的影响 与hypoxia+miR-NC组比较,hypoxia+miR-331-3p组 miR-331-3p、A值、CyclinD1蛋白水平、SOD含量明显升高,凋亡率、Cleaved-caspase-3蛋白水平、MDA、LDH含量明显降低(P<0.05),见图3、表3。

1~2:hypoxia+miR-NC组,hypoxia+miR-miR-331-3p组
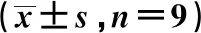
表3 高表达miR-331-3p对缺氧诱导PC12细胞损伤的影响
2.4LINC01503靶向miR-331-3p,调控miR-331-3p的表达 Starbase预测显示LINC01503与miR-331-3p存在结合位点,见图4。miR-331-3p过表达可降低野生型载体LINC01503-WT的荧光素酶活性(P<0.05),见表4。qRT-PCR检测miR-331-3p表达,si-NC组miR-331-3p为(1.00±0.10),si-LINC01503组miR-331-3p为(1.68±0.15),pcDNA-NC组miR-331-3p为(1.02±0.11),pcDNA-LINC01503组miR-331-3p为(0.48±0.03)。转染si-LINC01503可促进miR-331-3p表达,转染pcDNA-LINC01503可抑制miR-331-3p表达(P<0.05)。
2.5低表达miR-331-3p可以逆转LINC01503低表达对缺氧诱导PC12细胞损伤的影响 与anti-miR-NC+hypoxia组比较,anti-miR-331-3p+hypoxia组miR-331-3p、A值、CyclinD1蛋白水平、SOD含量明显降低(P<0.05),凋亡率、Cleaved-caspase-3蛋白水平、MDA、LDH含量明显升高(均P<0.05);与si-LINC01503+anti-miR-NC+hypoxia组比较,si-LINC01503+anti-miR-331-3p+hypoxia组miR-331-3p、A值、CyclinD1蛋白水平、SOD含量明显降低,凋亡率、Cleaved-caspase-3蛋白水平、MDA、LDH含量明显升高(P<0.05),见图5、表5。

图4 Starbase对LINC01503和miR-331-3p结合进行预测
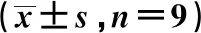
表4 miR-NC或miR-331-3p与LINC01503-野生型及突变型报告质粒共转染PC12细胞后双荧光素酶活性检测
2.6各组Nrf2/Keap1信号通路蛋白表达 与NC组比较,hypoxia组Nrf2、Keap1蛋白水平明显升高(P<0.05);与anti-miR-NC+hypoxia组比较,anti-miR-331-3p+hypoxia组Nrf2、Keap1蛋白水平明显升高(P<0.05);与hypoxia+si-NC组比较,hypoxia+si-LINC01503组Nrf2、Keap1蛋白水平明显降低(P<0.05);与si-LINC01503+anti-miR-NC+hypoxia组比较,si-LINC01503+anti-miR-331-3p+hypoxia组Nrf2、Keap1蛋白水平明显升高(P<0.05),见图6、表6。

1~4:anti-miR-NC+hypoxia组,anti-miR-331-3p+hypoxia组,si-LINC01503+anti-miR-NC+hypoxia组,hypoxia+si-LINC01503+anti-miR-331-3p+hypoxia组
表5 低表达miR-331-3p可以逆转LINC01503低表达对缺氧诱导PC12细胞损伤的影响

1~8:NC组,hypoxia组,anti-miR-NC+hypoxia组,anti-miR-331-3p+hypoxia组,hypoxia+si-NC组,hypoxia+si-LINC01503组,si-LINC01503+anti-miR-NC+hypoxia组,si-LINC01503+anti-miR-331-3p+hypoxia组
表6 Western印迹检测Nrf2/Keap1信号通路蛋白表达
3 讨 论
脑缺血发生后可引起脑组织氧化应激、炎症损伤进而导致神经细胞损伤,PC12细胞是目前研究脑缺血损伤的常用细胞模型,既往研究显示LncRNA GAS5通过下调miR-124加重缺氧诱导的PC-12细胞损伤〔8〕。沉默LncRNA MEG3通过靶向miR-21减轻缺氧诱导的PC-12细胞损伤〔9〕。LncRNA UCA1/miR-18a/SOX6分子轴在缺氧诱导的PC-12细胞损伤中可发挥重要调控作用〔10〕。
LINC01503在结直肠癌、神经胶质瘤、肝细胞癌中表达水平升高,并可促进肿瘤细胞增殖、迁移及侵袭〔11~13〕。本研究提示LINC01503高表达可能加重缺氧诱导的PC12细胞损伤。本研究结果显示缺氧诱导PC12细胞后细胞活力降低,凋亡率升高,还能够提高MDA、LDH的含量及降低SOD的含量,与相关文献报道结果相似〔14~16〕。提示成功建立PC12细胞损伤模型。本研究结果显示,抑制LINC01503表达可明显提高缺氧诱导的PC12细胞活力,降低细胞凋亡率,还可降低MDA、LDH的含量及提高SOD的含量。本研究双荧光素酶报告实验证实LINC01503可靶向结合miR-331-3p。miR-331-3p抑制卵巢癌〔17〕、非小细胞肺癌细胞〔18〕增殖和转移。本研究结果提示抑制LINC01503表达可通过上调miR-331-3p的表达从而减轻缺氧诱导PC12细胞损伤。Nrf2/Keap1信号通路在视网膜缺血再灌注损伤及心肌缺血再灌注损伤中可发挥重要调控作用〔19,20〕。本研究结果提示抑制LINC01503表达可能通过调控miR-331-3p/Nrf2/Keap1信号通路从而减轻缺氧诱导PC12细胞损伤。
综上,缺氧诱导PC12细胞中LINC01503的表达上调,而miR-331-3p的表达下调,抑制LINC01503表达可通过上调miR-331-3p的表达而减轻缺氧诱导的PC12细胞损伤,其作用机制可能与抑制Nrf2/Keap1信号通路的活化有关,可为进一步阐释急性脑血管疾病的发病机制奠定实验基础。
