miR-107靶向FGFRL1/AKT通路抑制胃癌耐药细胞迁移
2023-02-11蒋露张燕任伟宏
蒋露 张燕 任伟宏
(河南中医药大学 1第一临床医学院,河南 郑州 450046;2第一附属医院检验科)
胃癌是全球第五大最常见的恶性肿瘤,也是癌症相关死亡的第三大主要原因,对人类的生命健康构成了严重威胁〔1〕。由于缺乏有效的生物分子标志物,胃癌通常被发现时已为晚期,其5年生存率为20%~30%〔2,3〕。包括遗传学,表观遗传学和环境在内的多种因素均能影响胃癌的发生发展〔4〕。现阶段胃癌的临床治疗仍缺乏有效的手段,主要还是采用手术并配合化疗或者化疗与靶向治疗联合的方式,因此不可避免地可能会产生耐药现象〔5〕,已有报道表明,耐药的胃癌细胞可能更易发生转移〔6〕。而影响胃癌转移的因素众多,涉及多条信号通路的调控及多种迁移相关蛋白表达的调节。因此,探究胃癌敏感和耐药细胞迁移的强弱及其调控机制对改善胃癌的治疗提供了临床参考。微小RNA(miR)是长度为20 nt左右是非编码小RNA,通过与靶基因mRNA特异性结合进行转录后负调控靶基因表达〔7〕。有研究表明,miR-107可以调控多种肿瘤的发生发展、增殖、转移等多个生物学过程〔8~10〕。成纤维细胞生长因子受体 (FGFR)5,也被称为FGFRL1,在调节细胞增殖、分化、黏附、融合等过程中发挥重要作用〔11〕。有报道表明,FGFRL1也能调控一些肿瘤细胞的转移过程〔12,13〕,但其是否能调节胃癌细胞的迁移及其与miR-107之间的相互关系并不十分清楚,且miR-107是否通过靶标FGFRL1来调节胃癌细胞的迁移,并没有相关报道。本研究以胃癌敏感和耐药细胞为研究对象,探究miR-107和FGFRL1对其转移的影响,并进一步阐明其调节关系。
1 材料与方法
1.1材料 人胃癌敏感株和5-氟尿嘧啶耐药株细胞(SGC-7901,SGC-7901/5-Fu)购自上海慧颖生物科技有限公司;RPMI1640培养基、胰蛋白酶、青链霉素、RIPA组织/细胞裂解液、蛋白酶抑制剂和苯甲基磺氟(PMSF)购自索莱宝公司;opti-减/低血清培养基(MEM)购自Gibco公司;胎牛血清(FBS)购自Biological Industries公司;TRIzol购自Life Technologies公司;mRNA逆转录试剂盒购自Thermo Fisher公司;SYBR green Premix Ex TaqTM荧光定量检测试剂盒购自TaKaRa公司;miRNA 提取纯化试剂盒、miRNA cDNA合成试剂盒及miRNA qPCR定量分析试剂盒购自康为世纪生物有限公司;Lipofectamine 2000购自invitrogen公司;24孔悬挂transwell(孔径8 μm)购自Millipore公司;抗-FGFRL1抗体购自BBI公司;抗-GAPDH抗体和抗兔二抗购自Proteintech公司;二喹啉甲酸(BCA)蛋白定量试剂盒购自碧云天生物技术有限公司;荧光素酶活性检测试剂盒购自Genecopoeia公司。
1.2划痕实验 将胃癌SGC-7901,SGC-7901/5-Fu或转染的SGC-7901/5-Fu细胞种于12孔板,待细胞融合达95%以上,用无菌小移液器滴头横竖划细胞单层,形成划痕,磷酸盐缓冲液(PBS)洗涤除去划掉的细胞碎片,用1%血清RPMI1640培养基进行培养,分别在0 h和24 h时间点进行拍照记录,计算细胞相对迁移距离:(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。
1.3Transwell小室实验 将胃癌SGC-7901,SGC-7901/5-Fu或转染的SGC-7901/5-Fu细胞种于6孔板,随后用基础细胞培养基饥饿培养24 h。将Transwell小室(孔径8 μm)悬挂于24孔板,下室20% FBS的RPMI1640培养基为诱导剂,上室种200 μl胃癌细胞悬液,用无血清RPMI1640培养基培养。培养48 h后,用棉签擦去滤膜上面未迁出的细胞,用4%多聚甲醛和0.1%结晶紫对穿过孔径的滤膜下面的细胞进行固定和染色,倒置显微镜进行拍照,并计数。
1.4细胞转染 将胃癌SGC-7901/5-Fu耐药细胞接种到12孔或6孔板中,并分为4组:mimic NC组、miR-107 mimic组、NC组和siFGFRL1组。所用RNA由生工生物工程(上海)股份有限公司合成,miR-107 mimic序列为:上游5′-AGCAGCAUUGUACAGGGCUAUCA-3′,下游5′-AUAGCCCUGUACAAU GCUGCUUU-3′;siFGFRL1序列为:上游5′-CGACGGCUCCUACCUCAAUAATT-3′,下游5′-UUAUUGAGGUAGGAGCCGUCGTT-3′;相对应的对照RNA由生工生物工程(上海)股份有限公司赠送。培养细胞融合度达70%左右,吸弃RPMI1640培养基,加入一定体积opti-MEM培养基,用Lipofectamine2000作为转染试剂,用opti-MEM分别稀释Lipofectamine2000和RNA,并将稀释的RNA逐滴加入到稀释的转染试剂中,静置10 min;将RNA-Lipofectamine2000混合物逐滴滴加到SGC-7901/5-Fu耐药细胞中,轻轻混匀,6 h后,弃上清,加入10%FBS RPMI1640完全培养基培养。
1.5qPCR检测FGFRL1 mRNA和miR-107水平 胃癌SGC-7901,SGC-7901/5-Fu及转染的SGC-7901/5-Fu细胞沉淀重悬在1 ml Trizol中。然后将混合物在室温放置5 min,加入200 μl氯仿,剧烈震荡1 min,12 000 r/min,4℃,离心15 min。再向上清中加入500 μl异丙醇,剧烈震荡1 min,12 000 r/min,4℃,离心10 min。用75%乙醇洗涤沉淀2次,干燥,溶于焦碳酸二乙酯(DEPC)水中。测定RNA样品浓度,用mRNA逆转录试剂盒将RNA(2 μg)反转录为cDNA。用SYBR green Premix Ex TaqTM试剂盒检测FGFRL1基因相对表达水平,内参基因为GAPDH。FGFRL1引物序列为:上游5′-GTGTGAGGAGCATGGGTCTC -3′和下游5′- GTGTGTGTGTGTGTGTGTGGA-3′,GAPDH引物序列为:上游5′-CGCTGAGTACGTCGTGGAGTC-3′和下游5′-GCTGATGATCTTGAGGCTGTTGTC-3′。按照miRNA 提取纯化试剂盒,miRNA cDNA合成试剂盒及miRNA qPCR定量分析试剂盒的说明提取胃癌SGC-7901,SGC-7901/5-Fu细胞的miRNA,并进行miRNA的加Poly(A)尾修饰的过程,修饰后的miRNA再进行逆转录,最后进行定量检测,其中miRNA cDNA合成试剂盒须与miRNA qPCR定量分析试剂盒配套使用,试剂盒提供了下游引物。miR-107上游引物序列为:5′-CGCAGCAGCATTGTACAGGGCTATCA-3′,内参基因U6上游引物序列为:5′-CCGAGAGAAGATTAGCATGGCCCCTG-3′,PCR引物序列由生工生物工程(上海)股份有限公司合成。
1.6Western印迹检测相关蛋白表达 用细胞裂解液(RIPA裂解液,1% 蛋白酶抑制剂和1 mmol/L PMSF)重悬胃癌SGC-7901,SGC-7901/5-Fu细胞,加至玻璃均浆器中进行均浆破碎,将裂解液4℃,5 000 r/min离心15 min,取上清,测定蛋白浓度。将细胞裂解液在100℃下煮沸10 min变性,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),恒流将蛋白转移到聚偏氟乙烯(PVDF)膜上,用5%牛血清白蛋白(BSA)封闭1 h,4℃过夜孵育抗FGFRL1抗体(1∶400),抗p-AKT抗体(1∶500),抗AKT抗体(1∶2 000),抗E-钙黏附蛋白(Cadherin)抗体(1∶1 000),抗波形蛋白(Vimentin)抗体(1∶500),抗基质金属蛋白酶(MMP)9抗体(1∶1 000)和抗GAPDH抗体(1∶3 000),洗涤后与辣根过氧化物酶(HRP)标记的羊抗兔或羊抗鼠二抗(1∶5 000)室温孵育3 h,用增强型电化学发光(ECL)液进行曝光,并用ImageJ软件进行灰度值分析。
1.7荧光素酶报告实验 用TargetScan (http://www.targetscan.org/vert_72/)预测出miR-107对FGFRL1的靶标结合位点有2处,并用高斯荧光素酶(Gluc)报告载体(pEZX-MT05)构建了FGFRL1野生型表达载体(插入序列为:5′-cTGGACACACAGATAATGCTGCc-3′和5′-aCACACACACAGATAATGCTGCc-3′)和突变型表达载体(插入序列为:5′-cTGGACACACAGATTACGACGc-3′和5′-aCACACACACAGATTTACGACGc -3′),该荧光素酶报告载体的内参报告基因为分泌型碱性磷酸酶(SeAP),载体构建由Genecopoeia公司完成。
随后在HEK 293T工具细胞中验证了miR-107与FGFRL1的靶标关系,将293T细胞种于24孔板,用Lipofectamine2000将上述构建的野生型或突变型荧光素酶报告载体与miR-107 mimics或miR-107 mimics NC进行共转染,48 h后收集细胞上清,用荧光素酶活性试剂盒对Gluc和SeAP的活性进行定量测定,并计算出高斯荧光素酶的相对活性。
1.8统计学分析 采用SPASS19.0软件进行单因素方差分析(ANOVA)和Dunnett-t检验。
2 结 果
2.1胃癌SGC-7901/5-Fu耐药株细胞迁移能力更强 用wound-healing划痕和transwell小室实验测定了5-FU敏感和耐药SGC-7901细胞迁移能力。结果表明,与敏感株SGC-7901相比,SGC-7901/5-Fu耐药株细胞划痕愈合相对迁移距离明显更大,穿过小室的细胞数量明显更多,耐药株细胞的迁移能力显著强于SGC-7901敏感株细胞(P<0.05)。见图1、表1。
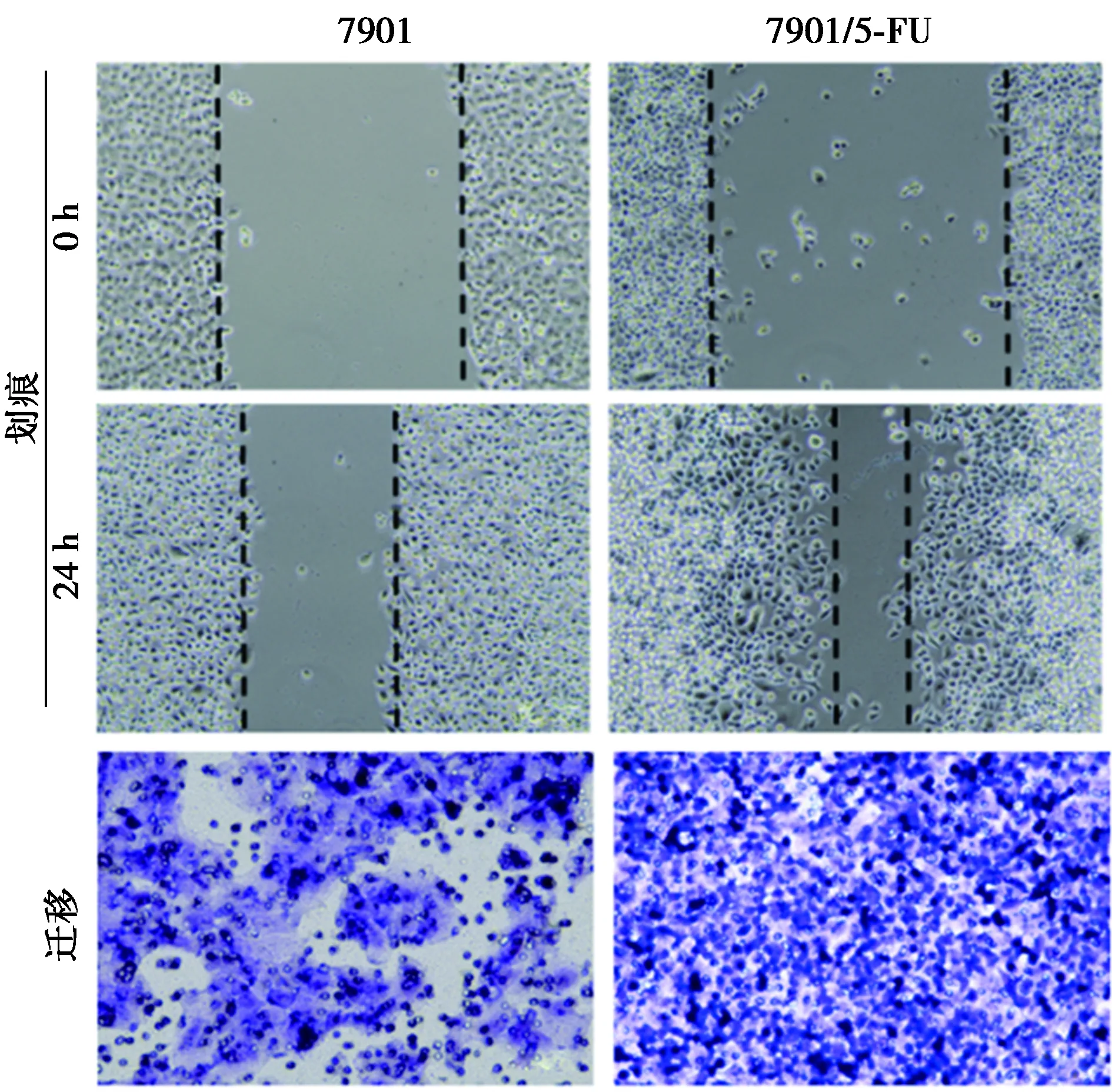
图1 0和24 h划痕及transwell小室实验测定SGC-7901和SGC-7901/5-Fu细胞迁移(结晶紫染色,×200)
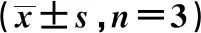
表1 SGC-7901敏感和耐药细胞迁移水平、miR-107、FGFRL1 miRNA和蛋白表达比较
2.2胃癌SGC-7901敏感和耐药株细胞中miR-107和FGFRL1表达水平 与敏感株细胞SGC-7901相比,SGC-7901/5-Fu耐药株细胞中miR-107显著低表达,而FGFRL1 mRNA及蛋白显著高表达(P<0.05)。推测miR-107可能通过调控FGFRL1的表达调节胃癌SGC-7901敏感和耐药株细胞的迁移。见表1、图2。

图2 FGFRL1在SGC-7901和SGC-7901/5-Fu细胞中的表达水平
2.3荧光素酶报告实验鉴定FGFRL1是miR-107的靶标分子 根据Targetscan软件分析结果,FGFRL1的3′-UTR有2处潜在的miR-107结合位点,如图3A所示,并且荧光素酶报告实验验证了FGFRL1与miR-107的靶标关系。结果表明,与共转染pEZX-MT05-WT/miR-107 mimic NC组(1.11±0.04)相比,共转染pEZX-MT05-WT/miR-107 mimic组的荧光素酶的相对活力(0.50±0.04)显著降低(P<0.05),但是在pEZX-MT05-MUT突变表达载体的共转染mimic NC组与miR-107 mimic组之间,荧光素酶的相对活力(1.08±0.04 vs 1.00±0.06)没有明显差别(P>0.05),证明miR-107与FGFRL1之间有靶向结合位点。与mimic NC组和NC组相比,miR-107 mimic组和siFGFRL1组的FGFRL1 mRNA和蛋白表达水平均显著下调约5倍(图3B、表2)。表明在胃癌SGC-7901/5-Fu细胞中miR-107可以调控FGFRL1的表达,FGFRL1是miR-107的下游靶标分子。

A.在FGFRL1的3′-UTR预测的2处miR-107结合位点;B.Western印迹检测7901/5-FU细胞各处理组FGFRL1蛋白表达水平。1~4:mimic NC组、miR-107 mimic组、NC组、siFGFRL1组;图4B同
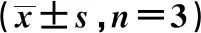
表2 SGC-7901/5-FU细胞各组FGFRL1蛋白及mRNA表达水平
2.4miR-107通过抑制FGFRL1/AKT活性调节迁移相关蛋白的表达 与SGC-7901敏感株细胞相比,SGC-7901/5-Fu耐药株细胞FGFRL1呈明显高表达,耐药株细胞中AKT的活性(p-AKT水平)明显升高,迁移相关蛋白Vimentin和MMP9明显高表达,而E-Cadherin呈明显低表达(P<0.05),见图4A。说明SGC-7901/5-Fu耐药株细胞具有更强的迁移能力。与mimic NC组和NC组相比,在miR-107 mimic组和siFGFRL1组中FGFRL1、AKT活性及Vimentin和MMP9蛋白表达水平显著下调,而E-Cadherin蛋白表达显著上调(P<0.05),见图4B、表3。表明miR-107通过靶向FGFRL1调节AKT的活性,调控下游迁移相关蛋白的表达水平,影响耐药肿瘤细胞的迁移。

A.Western印迹检测胃癌SGC-7901敏感株细胞和SGC-7901/5-FU耐药株细胞中相关蛋白的表达水平;1~2:SGC-7901、SGC-7901/5-FU;B.转染处理后,Western印迹检测SGC-7901/5-FU耐药株细胞中相关蛋白的表达水平
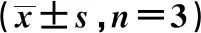
表3 胃癌SGC-7901、SGC-7901/5-FU细胞中相关蛋白表达水平
2.5过表达miR-107和敲减FGFRL1对SGC-7901/5-Fu细胞转移的影响 miR-107 mimic组和siFGFRL1组与其对照的mimic NC组和NC组相比,SGC-7901/5-Fu耐药细胞划痕愈合距离和穿过小室细胞数量均显著减少,迁移水平显著抑制(P<0.05),见表4、图5。表明敲低FGFRL1的表达可以明显抑制耐药株细胞转移,而过表达miR-107则可以下调FGFRL1表达,进而抑制SGC-7901/5-Fu转移。

表4 SGC-7901/5-FU细胞各组细胞迁移

图5 划痕和Transwell实验检测过表达miR-107和敲减FGFRL1抑制SGC-7901/5-FU细胞迁移(结晶紫染色,×200)
3 讨 论
在现阶段胃癌的临床治疗过程中,化疗药物耐药的现象频繁发生,并且耐药的胃癌细胞有更强的迁移能力,肿瘤细胞的强转移能力大大降低了患者的存活时间。虽然已有很多报道研究了各种肿瘤细胞转移机制及调控因素,但对耐药肿瘤细胞转移的研究并不多见,因此,探究调控耐药胃癌细胞迁移的分子机制能对进一步改善胃癌的临床治疗提供参考靶点。已有报道表明miRNA-107在多种疾病的发生中起到调节作用,如关节炎、阿尔茨海默病等〔14,15〕,尤其对肿瘤细胞而言,miRNA-107在其生长、药物敏感性及迁移方面起重要的调节作用〔8~10〕。由于miR-107对多种肿瘤细胞增殖和转移过程有重要的调节作用,可推测miR-107可能在调节耐药胃癌细胞迁移中起调控作用。本研究结果说明,miR-107确实可以调控耐药胃癌细胞的迁移。
由于FGFRL1的胞内结构域与成纤维细胞生长因子受体(FGFRs)家族的其他受体不同,其C端不包含酪氨酸激酶区域,其功能也与经典的成纤维细胞生长因子(FGF)/FGFRs通路不同〔16〕。虽然已有研究表明,FGFRL1会影响细胞的一些生物学功能,但其对肿瘤细胞的调节作用并不十分清楚,有待深入探究〔17〕。有文献表明,miR-107在非小细胞肺癌中可以通过调控FGFRL1的表达调控细胞增殖〔18〕。但在胃癌细胞中,miR-107是否靶向FGFRL1基因,调控FGFRL1的表达及miR-107调控胃癌细胞迁移的作用是否通过FGFRL1介导都鲜有报道。经生物信息学预测,荧光素酶报告实验鉴定及过表达miR-107后,检测FGFRL1 mRNA和蛋白表达水平,结果表明miR-107可以靶向调控FGFRL1的表达,FGFRL1是miR-107的分子靶标,且过表达miR-107和敲低FGFRL1后,耐药细胞的迁移能力极显著的被抑制,验证了miR-107调控耐药胃癌细胞的迁移是通过FGFRL1介导的。就作用机制而言,有文献研究表明,FGFRL1可以通过调控磷脂酰肌醇-3激酶(PI3K)/AKT信号调节小细胞肺癌化疗耐药的现象〔19〕,但FGFRL1是否通过调节AKT活性影响肿瘤细胞的迁移,尤其是对胃癌细胞转移的调节,并没有相关报道。而本研究新发现,改变miR-107或FGFRL1表达后,可以调节AKT的活性进而影响了一些迁移相关蛋白的表达,最终影响了胃癌耐药细胞的迁移。
