HA复合β-TCP在新西兰兔上颌窦提升术中的成骨及成血管效果
2023-02-11张艳波霍峰王雪峰韩尚志张兴乐王鹏
张艳波 霍峰 王雪峰 韩尚志 张兴乐 王鹏
(承德医学院附属医院口腔科,河北 承德 067000)
由社会老龄化、面部创伤、肿瘤切除、先天性畸形及炎症等因素导致的上颌后区骨量不足以致牙槽骨骨缺失是口腔临床医学面临的重大挑战之一。在上颌窦提升术中,有效的修复及重建骨缺损是使患者免于疾病困扰的惯用治疗方案〔1〕。研究显示〔2〕,自体骨移植修复材料能明显促进骨的再生和愈合,是修复缺失骨的“金标准”,但是该方法需要从患者身体其他部位获取,患者要承受新的疼痛或者神经创伤,诱发较为强烈的炎性应激等并发症,并且由于自体骨的增殖能力有限,难以满足临床上较大的骨需求量。大量的临床数据显示〔3〕置入式骨替代材料在硬组织修复中具有潜在的广阔前景。研究显示〔4〕羟基磷灰石(HA)、β-磷酸三钙(β-TCP)等替代骨材料常被骨外科医师用于骨增量手术中。有研究报道〔5〕,HA具有明显的生物相容性优势,可为骨再生提供较为稳定的支架作用,但是其被生物降解的过程缓慢,严重影响初期骨的形成。有研究报道称〔6〕,β-TCP在骨组织修复中显示了更好的生物降解速率,但其作为支架作用的缺点同样较为明显,无法在3~6个月的骨组织重建过程维系骨替代材料降解与成骨过程的平衡。Sakamoto等〔7〕研究表明将HA复合β-TCP应用到骨重建术中,显示了较为满意的成骨效果。但是HA复合β-TCP材料用于上颌骨的修复的报道较少。本研究探讨HA复合β-TCP对新西兰大白兔上颌窦提升术中的成骨和成血管的影响。
1 材料和方法
1.1实验动物、试剂和仪器 动物:雌性,SPF级,3月龄,体重(2.5±0.5)kg,31只,健康新西兰大白兔,采购自河北省望都县彤辉养殖有限公司,动物的许可证号:SCXK(冀)2016-002,实验动物使用许可证号SYXK(冀)2017-001。在承德医学院实验动物中心饲养房中,恒温恒湿条件下,标准颗粒饲料,自由饮水,单笼饲养,至少进行适应性喂养1 w后用于后续实验。本研究的实验操作均符合医学院动物伦理委员会的要求,已获取承德医学院动物伦理委员会的批准。主要试剂:HA复合β-TCP(HA和β-TCP的比例为3∶7)购自国家生物医学材料工程技术中心。β-TCP、麻醉剂、磷酸盐缓冲液(PBS,北京Solarbio公司),兔抗大鼠GAPDH(北京博奥森生物技术公司);苏木素-伊红(HE)试剂盒(美国Amresco公司),免疫组化、Western印迹试剂盒(美国millipore公司),茜素红、油红O染色试剂盒(南京建成生物工程有限公司)。主要仪器:扫描电镜(日本HITACHI 公司),光学显微镜(日本Olympus公司),酶标仪(北京六一仪器厂),FACS Aria Ⅲ流式细胞仪、凝胶电泳仪(美国BD公司)。
1.2电镜观察HA复合β-TCP生物材料的特性 在实验前将无菌真空包装的HA复合β-TCP材料切成直径3 mm,高度为5 mm的形状,电镜下观察复合材料的微观结构。
1.3细胞实验部分
1.3.1新西兰大白兔骨髓间充质干细胞(BMSCs)分离、鉴定与培养 取1只实验动物,静脉注射30 mg/kg的3%戊巴比妥钠麻醉后,剥离大白兔的股骨〔8〕,PBS冲洗3次,将冲洗出来的骨髓离心,弃上清,以浓度为15%胎牛血清(FBS)的DMEM培养液重悬细胞,置于37℃,5%CO2细胞培养箱中培养,每隔1 d更换一次培养,并在显微镜下随时观察细胞的形态及生长变化当细胞的生长密度超过90%时,0.25%胰酶消化,用于后续实验。BMSCs的表面抗原鉴定通过流式细胞仪进行,胰酶消化细胞后,1 500 r/min离心3 min,PBS洗涤,以100 μl的PBS重悬细胞,加入一抗(CD29、CD34、CD44、CD45),室温下孵育30 min,PBS冲洗3次,加入二抗,避光孵育2 h,FACS Aria Ⅲ流式细胞仪检测〔9〕。
1.3.2细胞实验分组及HA复合β-TCP材料对BMSCs的生长活性的影响 胰酶消化细胞后,调整细胞浓度为1×104个/孔接种于96孔培养板中,将细胞分为空白组(不进行任何处理)、对照组(细胞的培养基中添加1%的β-TCP后培养)〔10〕、实验组(细胞的培养基中添加1%的HA复合β-TCP材料),每组设18个复孔,置于37℃,5%CO2细胞培养箱中培养24 h,接着每孔加入100 μl的CCK-8工作液,室温孵育1 h,使用酶标仪〔11〕在12、24、36、48、60、72 h时各取3个孔测量D450。
1.3.3HA复合β-TCP材料对BMSCs的成骨分化的影响 胰酶消化细胞后,更换为成骨诱导培养基同时调整细胞浓度为1×104个/孔接种于96孔培养板中,分组同1.3.2,置于37℃,5%CO2细胞培养箱中培养,每隔1 d更换培养基,培养14 d后,按茜素红、碱性磷酸酶染色试剂盒〔12〕,染色,封片,显微镜下观察BMSCs的成骨和成血管状况。
1.4动物实验部分
1.4.1新西兰大白兔的上颌窦提升术 将实验动物按随机数字表法分为空白组、对照组、实验组,每组10只;实验动物禁食禁水12 h后,耳静脉注射戊巴比妥钠将动物麻醉后〔13〕,严格按手术要求在鼻部术区备皮,消毒,与动物鼻后1.5 cm处行纵行切口,在无菌显微剪的帮助下,分开两侧皮肤,暴露大白兔的鼻翼区,使用环形去骨钻在上颌窦顶壁制备以直径为0.5 cm的骨窗,取下骨片,分开上颌窦黏膜,复制出5 cm×5 cm×5 cm的空间:空白组在该处填充医用生理盐水和明胶海绵;对照组在该处填充1%β-TCP、医用生理盐水和明胶海绵;实验组在该处填充1%的HA复合β-TCP材料、医用生理盐水和明胶海绵,盖上自体骨,缝合骨膜,肌注20万U的青霉素防止感染。
1.4.2HE染色检侧实验动物上颌窦组织的形态改变 所有大白兔在术后单笼,标准饲料喂养28 d后,处死动物,无菌分离实验动物的上颌窦组织。以多聚甲醛固定, 置于脱钙液中3个月,每3 d更换脱钙液,待医用大头针能轻易穿刺标本后〔14〕,脱水,切片,HE染色,显微镜下观察标本中的成骨和成血管情况。
1.4.3免疫组化检侧各组标本中的微血管密度(MVD) 待各组标本脱钙后,常规脱水,切片,采用柠檬酸盐缓冲液高温修复抗原,5%山羊血清封闭,加入一抗CD31(1∶500)〔15〕,4℃孵育过夜,加入二抗,PBS润洗3次,苏木精复染, 二甲苯脱水,封片,上镜检测。
1.4.4Western印迹检测各组标本中成骨相关蛋白成骨基因特异性转录因子(Runx)2、骨桥蛋白(OPN)及血管内皮生长因子(VEGF)的表达水平 待各组标本脱钙后,经常规裂解、匀浆、离心后,测定蛋白浓度,电泳分离,转模、封闭〔12〕,滴加一抗(均为1∶500),4℃孵育过夜,次日清洗后加入二抗(均为1∶1 000),显色,凝胶成像仪下读取各条带灰度值〔16〕,参照GAPDH的表达计算目的蛋白相对表达水平。
1.5统计学分析 采用SPSS16.0软件进行方差分析,t检验,作图工具采用Graphpad5.01。
2 结 果
2.1电镜下观察复合材料的微观结构 扫描电镜观察显示,HA复合β-TCP材料内部的微孔(直径300~500 μm)和超微孔(直径1 μm)数量丰富,孔径率在85%左右,视野中的微孔均在内部链接紧密,为新血管以及骨骼的形成提供足够的空间和营养,见图1。
2.2BMSCs的培养与鉴定 光学显微镜下,BMSCs多为长梭形、椭圆形或多边形,贴壁生长呈现旋涡状、鱼群状排列;BMSCs表面阳性标记物CD29(62.78±2.94)%,CD44(93.73±9.18)%,呈现高表达的状态,而CD34,CD45均为阴性表达,这些结果说明所提取的细胞为BMSCs,见图2。
2.3HA复合β-TCP材料对BMSCs的生长活性的影响 3组细胞的OD值无明显差异(P>0.05),说明3组细胞的生长的增殖活性趋于一致,进而显示HA复合β-TCP材料对BMSCs无毒性,见表1。

图1 电镜扫描生物材料的微观结构

图2 BMSCs的培养与鉴定

表1 各组细胞的OD值
2.4HA复合β-TCP材料对BMSCs的成骨分化的影响 空白组细胞中未见明显的矿化结节,对照组细胞中可见少量的矿化结节,实验组细胞中可见较多的矿化结节,3组细胞的矿化结节数量的差异具有统计意义(均P<0.05),见图3,表2。

图3 各组BMSCs茜素红染色(×400)
2.5HA复合β-TCP材料对BMSCs的成骨中血管生成的影响 空白组细胞中未见明显的咖啡色颗粒,对照组细胞中可见少量的咖啡色颗粒,实验组细胞中可见较多的咖啡色颗粒,与空白组相比,对照组、实验组细胞中碱性磷酸酶的阳性比例明显升高,与对照组相比,实验组细胞中碱性磷酸酶的阳性比例明显升高(均P<0.05),见表2,图4。

表2 各组细胞矿化结节数量、碱性磷酸酶的阳性比例比较

图4 各组BMSCs碱性磷酸酶染色(×400)
2.6HE染色检侧各组上颌窦组织的形态改变 空白组动物的标本中结缔组织大量生成,视野中出现较多的炎性细胞浸润,虽有少量骨质新生,但未见明显的骨小梁;对照组动物的上颌窦组织标本中新生骨质量明显增多,新生骨质见可见少量的血管生成和骨小梁;实验组中新生骨质量较对照组明显增多,新生血管数量明显增多,炎性浸润的细胞明显减少,视野中的骨小梁的数量明显增多,见图5。
2.7免疫组化检侧各组标本中的MVD 与空白组相比,对照组、实验组上颌窦组织中的MVD明显增多;与对照组相比,实验组上颌窦组织中的MVD明显增多(均P<0.05),见图6,表3。
2.8Western印迹检测各组标本中Runx2、OPN、VEGF蛋白表达 与空白组相比,对照组、实验组上颌窦组织中Runx2、OPN、VEGF表达明显升高;与对照组相比,实验组上颌窦组织中Runx2、OPN、VEGF表达明显升高(均P<0.05),见表3,图7。

图5 各组上颌窦组织形态(HE染色,×200)

图6 各组上颌窦组织MVD(HE染色,×200)
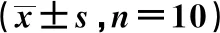
表3 各组上颌窦组织中MVD、Runx2、OPN、VEGF相对表达比较

图7 Western印迹检测各组相关蛋白表达
3 讨 论
临床上常采用骨移植、牵张成骨刺激、牵拉成骨促进骨再生等手段中的一种或者多种方法联合应用以治疗各种原因造成的骨缺损,由于当今医疗技术的限制及患者所能承担的经济负担限制,这些干预手段但现在尚未达到令人欣慰的效果。但是在一些涉及因癌症切除、外科创伤、先天性畸形而造成的颌面骨缺失的患者中,骨组织的修复及重建是提高患者身心健康及生命质量的重要途径。研究显示〔17〕,自体骨移植、同种异体骨移植及填充骨替代材料是治疗颌面骨缺损的主要手段,但是由于自体骨移植、同种异体骨移植固有局限性和技术要求的严格性,临床医师对这些手段的实用性和疗效保留较大的争议。得益于当代生物材料、检测技术及有限元建模等技术的突破性进展,填充骨替代材料成为解决临床医师困扰的最具前景的手段。
目前骨移植替代材料领域的发展迅速,如胶原、陶瓷、磷酸钙水泥、β-TCP等。研究显示〔18〕β-TCP因与骨骼具有相比的成分,在临床的骨组织修复中具有广阔的应用前景。Goodarzi等〔19〕通过X射线对β-TCP纳米级复合材料进行表征,结果显示β-TCP纳米材料的微孔及孔径均极大提高了大鼠BMSCs的体外相容性,增强细胞中碱性磷酸酶的活性。Hojo等〔20〕研究报道将β-TCP/胶原蛋白复合材料用于犬无骨膜压槽骨缺损模型中,在实验周期内β-TCP能明显增加成骨的面积,显示了强劲的促进骨再生和牙槽吸收的效用。Costa等〔21〕研究显示作为生物活性材料,替代骨材料β-TCP在诱导成骨细胞的生成过程中,一方面能明显降低机体的免疫原性和排斥反应,另一方面其特有的超微孔结构能明显促进骨细胞的增殖,募集和分化。但是Go等〔22〕研究指出由于单一材料理化性质难以匹及复杂的机体生理变化,需要将β-TCP与其他生物活性相复合,以弥补其作为支架功能不足的掠食,以发挥其最大的成骨效用。许多材料如骨传导性能较好的聚乳酸-乙醇酸共聚物(PLGA)、壳聚糖、聚己内酯、α-半水硫酸钙(CSH)、纳米HA等复合材料均已应用到这一领域〔23〕。而HA因其具有与人类骨骼组织矿物质相类似的成分,优良的骨传导性能,降低疾病传播的风险及方便易于结合性能等优势而被众多学者广泛研究。Nascimento等〔24〕通过对Wistar大鼠颅骨缺损的研究指出HA复合β-TCP材料的应用能明显增强填充物的生物相容性和骨传导性,并且保留了原始的移植形状,促进颅骨缺损的修复。但是有关HA复合β-TCP材料在颌面骨缺损修复的报道较少。本研究结果说明生物复合材料的应用能明显增强BMSCs体外成骨的分化及成血管效用。HA复合β-TCP材料的应用能明显缓解实验动作缺损灶点的病理损伤,增加血管生成的数量,增强成骨和成血管相关蛋白Runx2、OPN、VEGF的表达。
