急性胰腺炎大鼠肠黏膜屏障损伤、MLCK/p-MLC2信号通路活性变化及其与抗菌肽的关系
2023-02-11马凤雨曾家月文琳陈霞
马凤雨,曾家月,文琳,陈霞,2
1 西南医科大学附属医院消化内科,四川泸州 646000;2 成都医学院第一附属医院消化内科
急性胰腺炎(AP)是消化科常见急腹症。重症急性胰腺炎(SAP)患者表现为胰腺坏死出血,伴有脏器功能障碍及代谢功能紊乱等,可导致多器官功能障碍综合征,严重威胁患者生命健康。小肠是SAP 最易累及的器官之一,肠黏膜屏障损伤不仅参与了SAP 的全身炎症反应及多器官损伤,其导致的肠道细菌移位也是胰腺炎后期并发感染最主要机制。肠黏膜屏障包括机械屏障、生物屏障、免疫屏障、化学屏障。机械屏障是由紧密连接蛋白与肌动蛋白细胞骨架将相邻细胞连接起来构成。紧密连接蛋白主要由咬合蛋白(Occludin)、闭合蛋白(Claudin)及闭合小环蛋白(ZO)组成[1]。肌球蛋白轻链激酶(MLCK)是肌球蛋白轻链(MLC2)的特异性底物酶,在细胞骨架重构中起重要作用[2]。研究显示,肠黏膜屏障损伤与紧密连接蛋白分子的降解、紧密连接蛋白分子结构的解聚和重排有关,其中磷酸化肌球蛋白轻链(p-MLC2)在此过程中发挥重要作用[3-4]。免疫屏障中最具有代表性的是抗菌肽。回肠的潘氏细胞是肠道中抗菌肽的主要来源,在肠道病原菌的刺激下,潘氏细胞脱颗粒释放一系列抗菌因子,包括防御素、溶菌酶和再生胰岛衍生蛋白3 家族(Reg3)蛋白等,保护隐窝细胞免受微生物感染,阻止外源微生物入侵,发挥杀菌作用,同时参与调节肠道菌群组成和肠道免疫反应[5-6]。2021 年6 月—2022 年1 月,我们通过建立AP大鼠模型,观察大鼠肠黏膜屏障损伤情况,以及肠黏膜组织MLCK/p-MLC2 信号通路活性变化,并分析该信号通路激活与小肠抗菌肽的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级雄性SD 大鼠24 只,6周龄,体质量180~220 g。实验动物及专用饲料均由西南医科大学实验动物中心提供,饲养于西南医科大学动物房。饲养条件:室温(22 ± 2)℃,每天定时换气,保持12 h/12 h 光暗照明,饮食不限。本实验经本院动物伦理委员会审核批准。
1.1.2 主要药品与试剂 牛磺胆酸钠(美国Sigma公司),脂肪酶、淀粉酶ELISA试剂盒(南京建成生物技术有限公司),总RNA 纯化提取试剂盒、反转录试剂盒、Real-time qPCR 试剂盒(中国ELK Biotechnology公司),BCA蛋白浓度测定试剂盒(中国ASPEN公司)。
1.2 动物分组与造模 将大鼠按随机数字表法分为对照组6 只、AP 组18 只。AP 组采取胰胆管逆行注射5%牛磺胆酸钠溶液进行造模。造模前12 h 禁食不禁水,给予3%戊巴比妥钠1 mL/kg腹腔注射麻醉,仰卧位固定。沿腹中线打开腹腔,找到胰胆管,在十二指肠乳头旁用26 G 留置针穿破肠壁,进入胰管,微血管钳夹闭肝门处胰管,以0.1 mL/min 的速度泵入5%牛磺胆酸钠0.1 mL/100 g,2 min 后取下微血管钳。以胰胆管周围肿胀,局部胰腺颜色慢慢变黑、水肿伴充血判断为造模成功。缝合伤口,关腹,术后继续禁食不禁水。对照组仅开腹,适当翻动胰腺后关腹。
1.3 血清脂肪酶、淀粉酶含量检测 对照组于造模后6 h,AP组于造模后6、12、24 h各取6只大鼠,经心脏穿刺采血2 mL,4 ℃静置2 h,3 000 r/min 离心15 min,离心半径为12.5 cm,分离血清。采用ELISA法检测脂肪酶、淀粉酶含量。
1.4 回肠黏膜组织病理学检查 采用HE 染色法。大鼠采血后立即处死,取回肠黏膜组织标本,加入4%多聚甲醛固定,浓度梯度乙醇脱水,二甲苯透明,石蜡包埋,切成4 μm厚切片。浓度梯度乙醇脱蜡至水,苏木素染色,1%盐酸乙醇分化,1%氨水显蓝。加乙醇伊红复染60 s,二甲苯透明,中性树脂封片,显微镜下观察。采用Chiu 评分评价回肠黏膜组织病理学改变,评分标准为:0分,正常黏膜绒毛;1分,绒毛顶端上皮下出现间隙,炎症细胞局部增多;2 分,上皮下间隙扩大,固有层局部水肿出血;3 分,固有层明显水肿,弥漫出血,炎症细胞皮下聚集;4分,剥脱的绒毛有固有层和扩张的毛细血管暴露;5分,固有层消化崩解、出血、溃疡。
1.5 回肠黏膜组织Reg3γ、α-防御素5、溶菌酶mRNA表达检测 采用RT-qPCR法。取回肠末端肠段,-80 ℃保存。称取0.1 g 回肠黏膜组织,冰上研磨,加入TRIzol 裂解液提取总RNA,以其为模板逆转录生成cDNA。以cDNA 作为模板,进行PCR 扩增。扩增引物由武汉恒意赛生物公司设计合成,见表1。反应条件:95 ℃预变性3 min;95 ℃ 5 s、56 ℃ 30 s、72 ℃ 30 s,共40个循环。以GAPDH 为内参,采用2-ΔΔCt法计算目的基因的相对表达量。

表1 PCR扩增引物序列
1.6 回肠黏膜组织MLCK、p-MLC2、ZO-1、Claudin-1蛋白表达检测 采用Western blotting 法。取0.1 g冷冻的末端回肠组织,研磨后离心取沉淀,加入裂解液提取组织蛋白,BCA 蛋白定量试剂盒测定蛋白浓度。配置15%的分离胶和5%的浓缩胶进行SDS-PAGE 电泳,上样后80 V 电泳2 h,60 V 转膜2 h,5%脱脂奶粉封闭2 h。除去封闭液,加入稀释后的一抗(MLCK、ZO-1、Claudin-1 一抗稀 释比例1∶1 000;p-MLC2 一抗稀释比例1∶500)4 ℃过夜;TBST 洗涤3次,加入稀释后的二抗(稀释比例1∶1 000)室温孵育30 min。TBST 清洗,滴加电化学发光液,凝胶成像系统显影。采用AlphaEaseFC 软件分析目标条带的灰度值,以GAPDH 为内参计算蛋白的相对表达量。
1.7 统计学方法 采用SPSS26.0 统计软件。计量资料经过正态性检验,符合正态分布的数据以±s表示,多组间比较采用单因素方差分析,组间进一步比较采用LSD-t检验。相关性分析采用Pearson相关。P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清淀粉酶、脂肪酶水平比较 AP 组造模后6、12、24 h血清淀粉酶、脂肪酶水平均高于对照组(P均<0.05)。AP 组造模后12、24 h 血清淀粉酶、脂肪酶水平高于造模后6 h,且造模后24 h高于12 h(P均<0.05)。见表2。
表2 各组血清脂肪酶、淀粉酶水平比较( ± s)
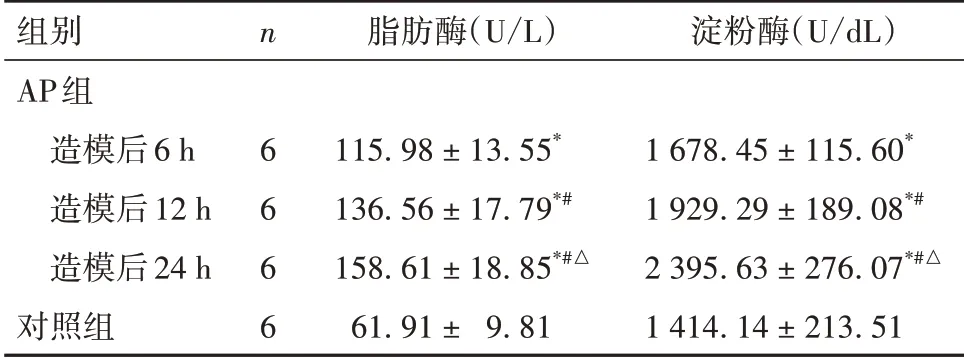
表2 各组血清脂肪酶、淀粉酶水平比较( ± s)
注:与对照组比较,*P<0.05;与造模后6 h 比较,#P<0.05;与造模后12 h比较,△P<0.05。
组别AP组 造模后6 h 造模后12 h 造模后24 h对照组n 6 6 6 6脂肪酶(U/L)115.98 ± 13.55*136.56 ± 17.79*#158.61 ± 18.85*#△61.91 ± 9.81淀粉酶(U/dL)1 678.45 ± 115.60*1 929.29 ± 189.08*#2 395.63 ± 276.07*#△1 414.14 ± 213.51
2.2 各组回肠黏膜组织病理结果比较 对照组回肠黏膜完整,绒毛结构规整正常;AP 组回肠黏膜组织出现不同程度的损伤,包括绒毛充血、水肿、变宽变短及炎症细胞浸润,部分绒毛顶端破裂。AP组造模后6、12、24 h 回肠黏膜组织病理学评分分别为(1.50 ± 0.55)、(3.50 ± 0.55)、(4.83 ± 0.41)分,对照组为(0.33 ± 0.52)分,AP 组高于对照组,且造模后24 h 高于造模后6 h 及12 h,12 h 高于造模后6 h(P均<0.05)。
2.3 各组回肠黏膜组织REG3γ、α-防御素5、溶菌酶mRNA表达比较 与对照组比较,AP组造模后6、12、24 h回肠黏膜组织REG3γ、α-防御素5、溶菌酶mRNA表达水平均降低,且造模后24 h 低于造模后6 h 及12 h, 12 h低于造模后6 h(P均<0.05)。见表3。
表3 各组回肠黏膜组织抗菌肽基因表达水平比较(± s)
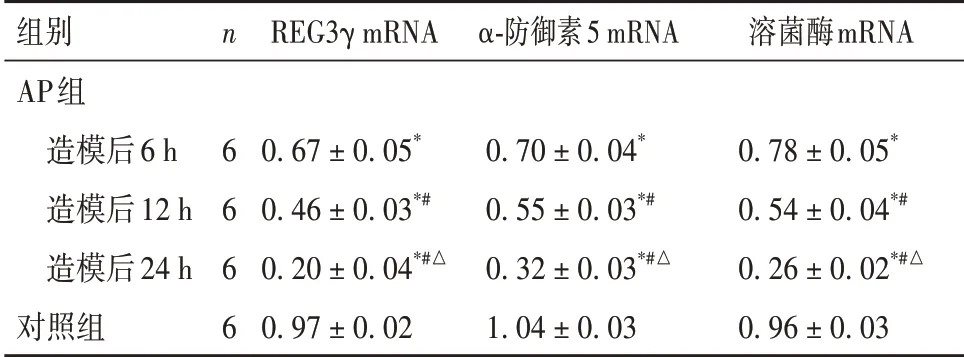
表3 各组回肠黏膜组织抗菌肽基因表达水平比较(± s)
注:与对照组比较,*P<0.05;与造模后6 h 比较,#P<0.05;与造模后12 h比较,△P<0.05。
组别AP组 造模后6 h 造模后12 h 造模后24 h对照组n 6 6 6 6 REG3γ mRNA 0.67 ± 0.05*0.46 ± 0.03*#0.20 ± 0.04*#△0.97 ± 0.02 α-防御素5 mRNA 0.70 ± 0.04*0.55 ± 0.03*#0.32 ± 0.03*#△1.04 ± 0.03溶菌酶mRNA 0.78 ± 0.05*0.54 ± 0.04*#0.26 ± 0.02*#△0.96 ± 0.03
2.4 各组回肠黏膜组织ZO-1、Claudin-1、MLCK、p-MLC2 蛋白水平比较 AP 组造模后6、12、24 h回肠黏膜组织ZO-1、Claudin-1 水平均低于对照组,AP 组造模后12、24 h 低于造模后6 h,且造模后12 h 低于造模后24 h(P均<0.05)。AP 组造模后6、12、24 h 回肠黏膜组织MLCK、p-MLC2 蛋白水平均高于对照组,AP 组造模后12、24 h 回肠黏膜组织MLCK、p-MLC2 蛋白水平均高于造模后6 h,且 造 模 后24 h 亦 高 于 造 模 后12 h(P均<0.05)。见表4。
表4 各组回肠黏膜组织ZO-1、Claudin-1、MLCK、p-MLC2蛋白表达水平比较(± s)

表4 各组回肠黏膜组织ZO-1、Claudin-1、MLCK、p-MLC2蛋白表达水平比较(± s)
注:与对照组比较,*P<0.05;与造模后6 h比较,#P<0.05;与造模后12 h比较,△P<0.05。
组别AP组 造模后6 h 造模后12 h 造模后24 h对照组n 6 6 6 6 ZO-1 0.78 ± 0.09*0.31 ± 0.05*#0.22 ± 0.05*#△1.01 ± 0.08 Claudin-1 0.41 ± 0.05*0.16 ± 0.03*#0.08 ± 0.02*#△0.73 ± 0.02 MLCK 0.65 ± 0.06*0.84 ± 0.05*#1.08 ± 0.07*#△0.50 ± 0.05 p-MLC2 0.42 ± 0.05*0.86 ± 0.06*#1.07 ± 0.06*#△0.13 ± 0.02
2.5 AP 大鼠回肠黏膜组织MLCK、p-MLC2 蛋白表达与抗菌肽的相关性 AP 大鼠回肠黏膜组织MLCK 蛋白表达水平与REG3γ、α-防御素5、溶菌酶mRNA水平呈负相关(r分别为-0.96、-0.95、-0.93,P均<0.05),p-MLC2 蛋白表达水平与REG3γ、α-防御素5、溶菌酶mRNA 水平亦呈负相关(r分别为-0.96、-0.94、-0.96,P均<0.05)。
3 讨论
小肠是AP最易累及的远端器官之一,同时肠黏膜屏障损伤参与了AP 的发生发展[7]。有研究认为,肠黏膜屏障损伤是诱发和加重AP的症结所在,在促发全身炎症反应综合征和多器官功能障碍综合征中发挥重要作用,这也是SAP 病死率高的主要原因[8]。本研究结果显示,与对照组比较,AP 组造模后各时间点血清淀粉酶和脂肪酶含量均显著升高,表明AP大鼠模型造模成功。组织病理学检查显示,与对照组相比,AP组回肠黏膜组织表现为黏膜不同程度断裂缺失、间质水肿、炎性细胞浸润,肠道组织病理损伤评分显著升高,且随着造模时间延长,升高更为明显,表明AP大鼠肠道的病理损伤呈现时间依赖性加重趋势,有肠上皮细胞的明显破坏。
肠黏膜机械屏障由完整的上皮细胞和细胞旁紧密连接组成,该屏障可防止细菌、脂多糖和肠杆菌群等其他有害物质从肠腔进入血液。Claudin-1、Occludin 和ZO-1 蛋白作为主要的紧密连接蛋白,能够加强肠道屏障,降低细胞旁通透性[9]。Claudin-1、Occludin 与邻近细胞中的其他连接蛋白相互作用形成顶端连接复合体,ZO-1 主要位于邻近上皮细胞的边界,将Occludin 和Claudin-1 锚定在细胞骨架上,共同控制肠黏膜屏障通透性[10]。Claudin-1、ZO-1 水平降低提示肠黏膜屏障损伤,肠黏膜通透性增加[11]。本研究结果显示,与对照组比较,AP 大鼠回肠黏膜组织中Claudin-1、ZO-1 蛋白表达减少,提示AP大鼠存在明显的肠黏膜屏障损伤。
肠黏膜屏障损伤不仅涉及肠机械屏障损伤,肠道通透性的改变导致细菌易位,还涉及肠壁内免疫活性细胞和邻近淋巴结—肠道相关淋巴组织的激活。抗菌肽是肠道免疫屏障的重要组成部分。回肠的潘氏细胞是小肠上皮中高度分化的分泌细胞,可分泌调节肠道菌群的抗菌肽,维持肠道稳态和肠黏膜屏障功能。潘氏细胞分泌抗菌肽的功能受损可能是AP 发生肠黏膜屏障损伤的原因之一。动物实验显示,ZIP4 基因敲除鼠存在潘氏细胞功能障碍,干细胞分化微环境受到破坏,导致上皮细胞完整性缺失,肠黏膜屏障受损[12]。研究发现,潘氏细胞功能障碍与多种疾病的发生有关,如克罗恩病、酒精性脂肪肝、移植物抗宿主病和肠易激综合征等。本研究结果显示,与对照组相比,AP 组回肠黏膜组织中的抗菌肽REG3γ、α-防御素5、溶菌酶表达随病程延长逐渐下降,造模后24 h 低于造模后6、12 h。这提示抗菌肽表达异常可能参与了AP 过程中肠黏膜屏障损伤的病理过程。
MLCK 是一种钙调素依赖酶,能够催化肌球蛋白20 kD 轻链的磷酸化,使肌动球蛋白得以激活肌球蛋白ATP 酶,从而引起平滑肌的收缩活动。研究认为,MLCK 是肠黏膜屏障功能障碍的关键效应因子和潜在的治疗靶点[13],MLCK 剪接变体可纠正炎症性肠病动物的肠黏膜屏障功能障碍。短肌或平滑肌MLCK 在肠上皮中不表达,而长肌MLCK 在肠上皮细胞中高度表达,并通过诱导MLC2 磷酸化来调节肠道通透性[14]。肠上皮通透性主要由两种不同的机制调节,即细胞旁途径和经上皮途径,由紧密连接控制的细胞旁途径允许水、溶质和离子的通过。调节细胞旁途径涉及四种不同的机制:紧密连接基因的转录调节[15]、MLCK 介导的肌肉收缩[16]、紧密连接蛋白的内吞[17]和上皮细胞凋亡[18]。此外,既往研究报道,肠黏膜屏障破坏引起的细菌渗透促进了病原体相关分子模式与模式识别受体如TLR4、TLR5 和NLRP3的结合;激活免疫细胞产生免疫反应;分泌细胞因子如IL-13和IFN-γ。WU等[19]研究显示,过量分泌IFN-γ可增加细胞旁通透性,其中MLCK通路激活参与了这一过程。但MLCK/p-MLC2信号通路在AP肠黏膜屏障功能障碍中的作用尚不清楚。本研究结果显示,与对照组相比,AP 组回肠黏膜组织中MLCK、p-MLC2蛋白表达水平显著增高,造模后24 h较6 h 和12 h 增高更为明显,表明AP 时肠道黏膜组织中MLCK激活,MLC2磷酸化,MLCK/p-MLC2信号通路可能参与了AP时的肠黏膜屏障功能障碍。
有学者在肠上皮细胞持续表达MLCK 的转基因小鼠中评估了肠黏膜屏障功能和紧密连接功能,紧密连接蛋白的选择性变化伴随着Na+渗透的增加,这可能直接影响MLCK 依赖的MLC2 磷酸化,提示MLCK/p-MLC2 信号通路与肠黏膜屏障功能密切相关[20]。在免疫介导的炎症性肠病模型中,肿瘤坏死因子受体2 信号通路刺激增加上皮长MLCK 的表达,导致紧密连接失调、屏障丧失,从而增加免疫介导的结肠炎的严重程度[24]。本研究通过Pearson 相关分析发现,抗菌肽的降低与MLCK/p-MLC2 信号通路呈负相关,因此推测,MLCK/p-MLC2 的表达与AP肠黏膜免疫屏障的减弱存在相关性,并由此参与了AP肠黏膜屏障损伤。
综上所述,AP 大鼠存在肠黏膜屏障损伤,回肠黏膜组织中MLCK/p-MLC2 信号通路激活,可能导致紧密连接的破坏,其与免疫屏障如抗菌肽的分泌减少共同作用,导致肠黏膜屏障损伤。对MLCK/p-MLC2信号通路的进一步研究可为临床治疗AP肠黏膜功能障碍提供新思路。
