人肝癌耐药细胞中差异表达微小RNA的筛选及生物学功能分析
2023-02-11耿海静王海生张建宇李薇邓秀玲
耿海静,王海生,张建宇,李薇,邓秀玲
内蒙古医科大学基础医学院,呼和浩特 010000
原发性肝癌是消化系统常见的恶性肿瘤之一,其发病率和病死率居高不下。目前对于肝癌的治疗仍以综合治疗为主,其中化疗占主要地位。常用的化疗药物有阿霉素(ADR)、5-氟尿嘧啶(5-FU)、铂类抗癌药物等。然而随着治疗周期的延长,化疗药物敏感性逐渐降低,出现多药耐药,严重制约了化疗的疗效,导致肿瘤复发和转移,是化疗失败的主要原因。肿瘤耐药性产生的机制十分复杂,涉及多因素、多环节、多通路,是目前研究的热点和难点。微小RNA(miRNA)是一类非编码小分子RNA,通过与靶mRNA的3'端非翻译区(3'-UTR)互补结合,促使靶mRNA的降解或抑制其翻译,从转录后水平调控基因表达,参与调控机体的多种生物学过程[1]。研究显示,miRNA不仅参与调控肿瘤的发生发展,而且在肿瘤多药耐药的发生发展过程中也发挥重要作用。2018年—2022年,我们通过miRNA 芯片技术,寻找人肝癌耐药细胞株Bel-7402/5-FU、Bel-7402/ADR 与亲本细胞株Bel-7402 之间差异表达的miRNA,探讨miRNA 在肝癌多药耐药中的作用,预测其调控的靶基因,为miRNA参与肝癌耐药性机制研究提供更多的靶点。
1 材料与方法
1.1 材料 人肝癌耐药细胞株Bel-7402/5-FU、Bel-7402/ADR 和亲本细胞株Bel-7402 均购自上海美轩生物技术公司。Gene Chip miRNA 4.0(Affymetrix 公司);TRIzol 试剂(上海普飞公司);反转录试剂为Promega M-MLV 试剂盒;反转录引物、miRNA PCR 引物和SYBR Premix Ex Taq 荧光试剂(广州市锐博生物科技有限公司);胎牛血清(FBS)、0.25%胰酶、RPIM1640 培养基(Sigma 公司);RIPA、BCA 蛋白检测试剂盒、小鼠抗人PGP 抗体及抗山羊二抗(索莱宝公司)。
1.2 细胞培养 将Bel-7402细胞培养于RPMI1640完全培养基(含10%胎牛血清、100 μg/mL青霉素和100 μg/mL 链霉素)中,Bel-7402/5-FU 细胞培养于含10 μg/mL 5-FU 的RPMI1640培养基(含10%胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素)中,Bel-7402/ADR 细胞培养于含5 000 ng/mL ADR 的RPMI1640 培养基(含10%胎牛血清、100 μg/mL 青霉素和100 μg/mL 链霉素)中。置于37 ℃、5% CO2、饱和湿度的CO2培养箱内。
1.3 肝癌细胞miRNA 表达谱分析 将对数生长期细胞,按照1×105/孔接种于6 孔板中,培养48 h,每组设3 个复孔。待细胞生长达到80%融合度时,加入TRIzol 试剂提取总RNA,使用NanoDrop2000 和安捷伦生物分析仪2100 分析RNA 纯度,质检合格的RNA 进行miRNA 芯片检测。使用FlashTag™ Biotin HSR RNA Labeling Kit 对样本miRNA 进行标记,标记后的miRNA 与上胶缓冲液混合,PCR 仪孵育99 ℃ 5 min,45 ℃ 5 min。孵育完成后,取130 μL 注入芯片,杂交16~18 h后,用清洗液清洗芯片。将芯片放入Gene Chip Scanner 3000 扫描仪中进行扫描,读取芯片扫描图像提取探针的信号值。图像和数据以TIFF 的文件格式保存。Bel-7402、Bel-7402/5-FU、Bel-7402/ADR 细胞RNA 分别杂交1 张芯片,每个探针重复3 次。采用t 检验计算样品间miRNA 表达量变化的统计学差异,以P≤0.05 且|差异倍数(FC)|>2 为显著性差异表达的miRNA。对不同样品组之间差异表达的miRNA 进行图形化展示,即火山图分析,筛选标准为P≤0.05且|FC|>2。
1.4 肝癌耐药细胞差异表达miRNA 靶基因的预测和 功 能分 析 在Targetscan、microRNA. ORG 和miRDB 三个数据库中对FC 最大的miRNA 进行靶基因预测。通过Fisher 精确检验评价某个GO term 基因富集度的显著性水平和各个通路基因富集度的显著性水平。根据靶基因预测结果,获得3 个数据库中共有的靶基因,通过Gene Ontology 进行GO 注释及富集分析,同时在KEGG 数据库进行信号通路分析,确定受到显著影响的代谢和信号转导途径。
1.5 肝癌耐药细胞差异表达miRNA 的验证 采用实时荧光定量PCR(qPCR)法。收集6孔板达80%融合度的Bel-7402、Bel-7402/5-FU和Bel-7402/ADR细胞,加入TRIzol试剂提取总RNA。按照M-MLV 试剂盒(Promega)进行miRNA逆转录获取cDNA。向逆转录产物中加入无RNA 酶的去离子水补足体积,取1 μL稀释液进行后续的PCR反应。反应体系:SYBR premix ex taq 6.0 μL,引物mix(5 μmol/L)0.3 μL,模板(反转录产物)0.6 μL,RNase-Free H2O 5.1 μL。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40 个循环。所有样本重复运行3次,绘制解离曲线证实扩增的特异性。以2-ΔΔCt法计算靶基因的相对表达量。
1.6 统计学方法 采用SPSS25.0 统计软件。符合正态分布的计量资料以±s表示。Bel-7402 与Bel-7402/5-FU、Bel-7402 与Bel-7402/ADR 之 间 差异的比较采用配对t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 肝癌耐药细胞差异表达miRNA 筛选结果 与Bel-7402细胞比较,Bel-7402/5-FU 细胞存在58个差异表达的miRNA,其中上调27 个、下调31 个,Bel-7402/ADR 细胞存在87 个差异表达的miRNA,其中上调17个、下调70个。见OSID码图1。在Bel-7402/5-FU和Bel-7402/ADR细胞中分别筛选出10个FC最大的miRNA,见表1、2。两种耐药细胞有9个差异表达miRNA重合,其中Bel-7042/5-FU细胞中miR-205-5p、miR-10a-5p、miR-675-3p、miR-373-5p、miR-371a-3p、miR-372-3p、miR-675-5p、miR-4532 表达下调,miR-31-5p、miR-4446-3p表达上调;Bel-7042/ADR细胞中miR-205-5p、miR-675-3p、miR-373-5p、miR-373-3p、miR-372-3p、miR-371a-3p、miR-675-5p、miR-10a-5p、miR-4532表达下调,miR-31-5p表达上调。
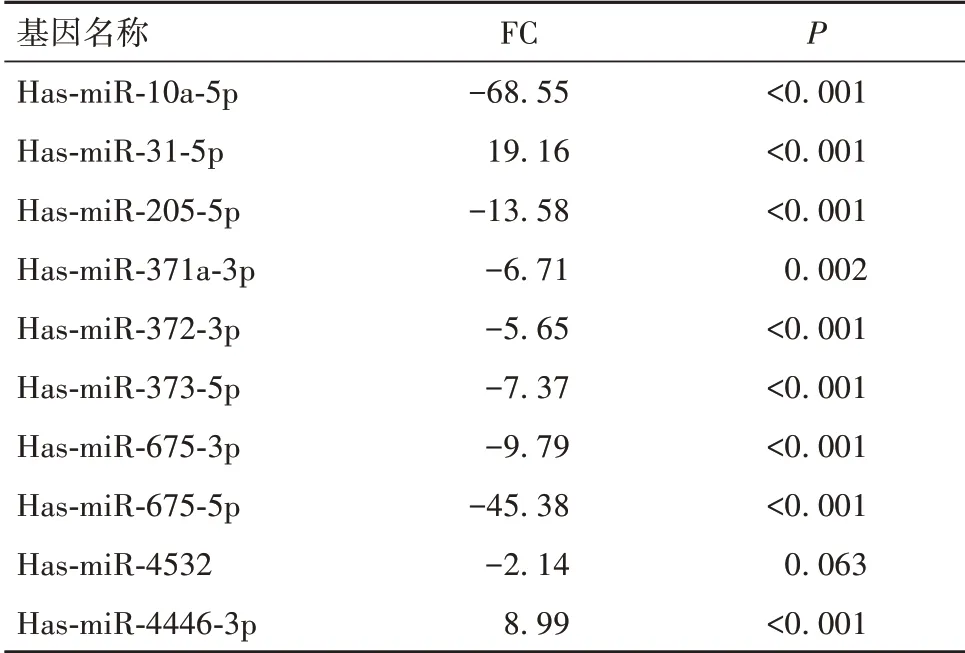
表1 人肝癌耐药细胞Bel-7402/5-FU中的差异表达基因
2.2 肝癌耐药细胞差异表达miRNA 的预测靶基因GO 分析结果 根据10 个FC 最大的miRNA 靶基因的 预 测 结 果,从Targetscan、microRNA. ORG 和miRDB 三个数据库中获取共同靶基因,进行GO 分析。GO 分析涉及生物过程(BP)、分子功能(MF)和细胞组分(CC)三个部分。其中BP主要涉及RNA 聚合酶Ⅱ启动子的转录调控、生物合成过程正向调控和氮化合物代谢过程负向调控等过程;MF主要涉及酶结合、大分子复合物结合和核酸结合转录因子活性等功能;CC 主要涉及高尔基体、催化复合物和转移酶复合物等过程。见OSID码图2。

表2 人肝癌耐药细胞Bel-7402/ADR中差异表达基因分析
2.3 肝癌耐药细胞差异表达miRNA 的预测靶基因KEGG 分析结果 根据靶基因预测结果,获得三个数据库中共有的靶基因,同时进行KEGG 通路分析。靶基因富集通路包括轴突引导、泛素介导的蛋白水解、PAR1通路、神经营养因子信号通路、MAPK 信号通路、TGF-β信号通路。见OSID码图3。
2.4 肝癌耐药细胞差异表达miRNA 的验证结果 与Bel-7402 细 胞比 较,Bel-7402/5-FU 和Bel-7402/ADR 细 胞 中miR-31-5p、miR-4446-3p 表 达 上 调,miR-205-5p、miR-675-3p、miR-373-5p、miR-372-3p、miR-371a-3p、miR-675-5p、miR-10a-5p 和miR-4532表达下调(P均<0.05),验证结果与芯片结果一致。见表3。

表3 人肝癌耐药细胞Bel-7402/5-FU和Bel-7402/ADR中 差异表达miRNA的验证结果
3 讨论
目前研究认为,肿瘤细胞高表达的耐药基因MDR1/P 糖蛋白(P-gp)导致细胞对药物摄取降低、细胞外排功能增加,是肿瘤细胞多药耐药产生的主要机制。P-gp 是ABC 转运蛋白之一,利用ATP 水解产生的能量,将5-FU、ADR、紫杉醇、长春新碱等多数化疗药物及一些分子靶向药物转运出胞外,以降低其在细胞内的浓度,从而导致肿瘤细胞产生多药耐药性[2]。在肝癌、胰腺癌、肾癌等肿瘤耐药细胞中,P-gp表达水平普遍升高[3],提示P-gp表达量与肿瘤耐药性发生有关。5-FU 和ADR 是临床常用的肝癌化疗药物,也是P-gp 转运的底物,因此本研究以人肝癌耐药细胞株Bel-7402/5-FU 和Bel-7402/ADR为研究对象。miRNA 是细胞内的一类非编码小RNA,在转录后水平调控体内多种生理和病理活动过程。miRNA 不仅调控肿瘤的发生、转移,而且还调控肿瘤细胞的耐药性,miRNA 异常可导致肿瘤细胞的表型改变,从而导致耐药发生,提示miRNA 有可能作为预测化疗敏感性和逆转耐药的靶点用于肿瘤治疗。本研究利用miRNA 芯片技术分析人肝癌Bel-7402 细 胞 与Bel-7402/5-FU 和Bel-7402/ADR 细胞的miRNA 表达谱,筛选耐药细胞中的差异表达miRNA,并对FC>10 的差异表达miRNA 进行靶基因预测。结果显示,在Bel-7402/5-FU 和Bel-7402/ADR 细胞中,有9 个miRNA 的表达发生明显变化,其中miR-31-5p 表达上调,miR-205-5p、miR-675-3p、miR-373-5p、miR-372-3p、miR-371a-3p、miR-675-5p、miR-10a-5p 和miR-4532 表达下调,后续PCR 检测结果也验证了这一点。这表明上述miRNA 在肝癌耐5-FU 和ADR 发生发展过程中具有重要作用。此外我们还发现,miR-4446-3p 在Bel-7402/5-FU 细胞中表达上调,而miR-373-3p在Bel-7402/ADR细胞中表达下调,提示miR-4446-3p 参与了Bel-7402/5-FU 耐药性的形成,miR-373-3p参与了Bel-7402/ADR 耐药性的形成。
研究显示,上述miRNA 在不同肿瘤耐药机制中可能发挥不同的作用(目前未见miR-373-3p 的研究报道)。miR-4532 在乳腺耐药和敏感细胞中差异表达,它可通过调节HIC-1 的表达促进乳腺癌细胞对阿霉素的耐药性[4],这可能成为逆转肿瘤耐药性的新的治疗靶点。ZICHITTEllA 等[5]报道,在缺氧微环境中,直肠癌中miR-675-5p 表达升高,通过抑制Caspase-3影响5-FU诱导的肿瘤细胞凋亡,从而增强耐药性。CHEN 等[6]报道,在大肠癌细胞中,miR-31-5p 高表达导致使大肠癌对奥沙利铂产生耐药性,其机制是由于miR-31-5p 抑制了大肿瘤抑制激酶2(LATS2)表达;而抑制miR-31-5p表达可促进肿瘤细胞凋亡并增强肿瘤细胞对化疗药物的敏感性。叶茸茸[7]报道,与小细胞肺癌亲本细胞株H69 相比,miR-4446-3P 在小细胞肺癌多药耐药细胞H69AR 中呈高表达。李清华等[8]报道,结直肠腺瘤复发患者与未复发患者相比,miR-4446-3p 表达上调,其高表达可能参与了结直肠腺瘤的复发机制。miR-372-3p可能作为一种致癌物,在直肠癌[9]、睾丸生殖细胞肿瘤[10]和口腔癌[11]等多种肿瘤的发生中发挥作用。在结直肠癌中,miR-372-3p 高表达与肿瘤大小和分化显著相关[12],miR-372-3p上调通过抑制LATS2、抑制Hippo信号通路参与结直肠癌的进展。在鼻咽癌中,miR-372通过下调PBK、激活p53信号通路抑制肿瘤细胞的侵袭和转移,同时miR-372 过表达也增强了对放疗的敏感性[13]。然而,在胃癌[14]、肝癌[15]和乳腺癌[16]中,miR-372 可促进肿瘤进展和转移;在口腔癌[17]、鼻咽癌[18]、肾细胞癌[19]、前列腺癌[20]中,miR-31-5p可显著抑制肿瘤生长,可能成为肿瘤治疗的关键靶点。
一个miRNA 可以同时调控多个靶基因,而一个靶基因可以被多个miRNA 调控,这使得它们在不同的肿瘤中发挥不同的作用。本研究对筛选出的10个差异表达的miRNA 预测靶基因进行GO 和KEGG分析,以期寻找miRNA 参与调控的生物学功能和相关通路,结果显示,其参与正向调控RNA 聚合酶Ⅱ启动子、酶结合和高尔基体的转录调控等生物过程,富集的通路有泛素依赖的蛋白酶体降解途径、PAR1通路、神经营养因子信号通路、MAPK 信号通路、TGF-β 信号通路。TGF-β 可在上皮细胞中诱导上皮间质转化,与多种纤维化疾病和癌症进展相关[21]。研究显示,miR-372 表达可显著抑制HaCaT 细胞中TGF-β 诱导的上皮间质转化[22]。MAPK 位于许多生长因子的下游,是细胞增殖最重要的途径之一,许多证据表明,MAPK 过度表达和激活在癌症进展中起重要作用。miRNA 可调节MAPK 信号,而MAPK 信号通常在癌症进展的情况下过度表达,表明miRNA与MAPK信号通路之间的串扰在人类癌症的发展中起关键作用。一项对肝细胞癌的研究表明,EGFRp38 MAPK 可下调miR-675-5p 表达,其下调可增强PD-L1 mRNA 的稳定性,从而导致PD-L1 积累[23]。在L-精氨酸诱导的胰腺炎中,毒蕈碱乙酰胆碱受体被激活并通过p38 MAPK 信号通路调节胰腺炎,在体外和体内胰腺炎模型中,miR-31-5p 表达均降低[24],提示miR-31-5p表达与MAPK信号通路之间存在重要关系。基于以上研究,我们推测差异表达的miRNA 可能通过调控MAPK、TGF-β 等信号通路参与肝癌耐药的形成。
本研究通过芯片数据和生物信息学方法筛选在肝细胞癌耐药细胞中差异表达的miRNA,并对这些miRNA的表达情况进行验证。进一步的功能分析表明这些miRNA可能通过调控MAPK和TGF-β等信号通路参与肝癌耐药的发生过程。但本研究也存在一定的局限性:其一,本文鉴定的miRNA有些已被证明与其他肿瘤耐药相关,但部分miRNA 如miR-373-3p目前尚无相关证据,这些miRNA 是否在肝癌耐药过程中发挥作用仍不明确;其二,克服肿瘤多药耐药性是未来肝癌治疗的研究重点,而miRNA 介导的耐药又具有多样性和复杂性的特点,其靶基因的功能较复杂,要在多个miRNA 及其靶基因中找到导致肝癌细胞耐药的关键机制,有待进一步研究探索。
