抑制内质网应激关键信号通路蛋白eIF2α去磷酸化与肝细胞增殖及c-Met表达的关系
2023-02-11陈欢蒋小铃李吉贵方家琴冯素敏何毅怀陈娅
陈欢,蒋小铃,李吉贵,方家琴,冯素敏,何毅怀,陈娅
1 遵义市第五人民医院内科,遵义 563000;2 遵义医科大学附属医院感染科
肝损伤进展为肝衰竭与肝细胞抗损伤能力低下、肝细胞再生能力等因素相关,因此增强肝细胞抗损伤能力、促进肝细胞增殖是治疗肝损伤的基本策略。促肝细胞生长因子(HGF)受体(c-Met)是受体酪氨酸激酶亚家族成员,对细胞生长转化、细胞周期、细胞抗损伤能力及增殖具有重要作用[1]。研究发现,c-Met 在急性肝衰竭中能够促进代偿性肝再生,是肝病治疗的潜在靶点[2]。内质网应激(ERS)是细胞的防御机制之一,对细胞增殖存在广泛影响。我们的前期研究发现,ERS 可下调c-Met 表达,影响肝细胞增殖,与肝病的发生发展密切相关[3]。ERS 作用于蛋白激酶R 内质网激酶(PERK)/真核细胞起始因子2α(eIF2α)、肌醇激酶1(IRE1)/X 盒结合蛋白1(XBP1)、活化转录因子6(ATF6)三条信号通路,通过减少新生蛋白的合成、激活内质网相关降解(ERAD)减轻内质网压力,恢复内质网稳态[4]。ERS 与肝损伤的发生发展密切相关,但ERS 影响肝细胞增殖的具体分子机制尚不明确。2018年1月—2020年1月,我们通过构建ERS肝细胞模型,探讨抑制eIF2α 去磷酸化影响肝细胞增殖及c-Met 表达的潜在机制。
1 材料与方法
1.1 材料 正常人肝细胞株L02购自中国科学院。内质网钙平衡抑制剂毒胡萝卜素(TG)、eIF2α 去磷酸化抑制剂Salubrinal 均为Sigma-Aldrich 公司产品;胎牛血清(Gibco),RPMI1640 培养基(Hyclone),青—链霉素混合物、0.25%胰酶(索莱宝),DMSO 试剂(Amresco),eIF2α、c-Met单克隆抗体(Santa Cruz),peIF2α、XBP1 单 克隆 抗 体(Cell Signaling),HRD1(SAB4200423,Sigma),GAPDH 多 克 隆 抗 体(ET1601-4)。蛋白质电泳仪(Bio-Rad),ECL 化学发光成像仪(ChemiScope 6000,Clinx),全波长酶标仪(Biotek)。
1.2 细胞培养 取L02细胞,加入含10%胎牛血清的RPMI1640 培养基,置于37 ℃、5% CO2培养箱中培养。至细胞生长密度≥85%时进行传代培养。
1.3 肝细胞ERS模型的构建
1.3.1 细胞分组与干预方法 取1 mg TG 溶于1.537 mL DMSO 中,配制成含1 mg/mL TG 母液,使用前加入含10%胎牛血清培养基稀释为1 μmol/L的TG 溶液。取对数生长期细胞,随机分为TG 组和对照组,TG 组加入含1 μmol/L TG 的RPMI1640 培养基,对照组仅加入RPMI1640培养基,培养48 h。
1.3.2 TG 对细胞增殖能力的影响观察 采用CCK-8 法。于培养0、48 h,取两组细胞,加入10 μL CCK-8 试剂孵育60 min,置酶标仪450 nm 处测定吸光度(A)值。
1.3.3 TG 对细胞ESR 相关蛋白p-eIF2α、ERAD 通路相关蛋白HRD1 以及c-Met 蛋白表达的影响 采用Western blotting 法。细胞培养0、48 h 时,使用蛋白提取试剂盒按照说明书步骤提取蛋白,用BCA 法检测蛋白浓度。通过电泳分离肝细胞裂解物,转移到PVDF 膜上。用TBST 封闭膜,分别加入稀释的GAPDH、p-eIF2α、HRD1、c-Met 一抗4 ℃孵育过夜。TBST漂洗,加入辣根过氧化物酶标记的抗小鼠或抗兔IgG 二抗,室温孵育1 h。TBST 漂洗3 次,用ECL试剂盒曝光蛋白条带,获得蛋白条带灰度值。以目标蛋白与GAPDH 蛋白条带灰度值的比值计算目标蛋白的相对表达量。
1.4 Salubrinal 预处理对肝细胞ERS 及细胞增殖的影响观察
1.4.1 细胞分组与干预处理 取5 mg Salubrinal溶于208.4 μL DMSO 中,配制成含50 mmol/L Salubrinal的母液,使用前加入含10%胎牛血清培养基稀释为20 μmol/L。将细胞分为TG 组和Salubrinal+TG组。待细胞生长融合度为70%~80%时,Salubrinal+TG组加入20 μmol/L Salubrinal预处理2 h,然后加入1 μmol/L TG 培养48 h;TG 组加入1 μmol/L TG培养48 h。
1.4.2 细胞增殖能力观察 采用CCK-8 法检测两组细胞增殖能力,步骤参照“1.3.2”。
1.4.3 细胞p-eIF2α、XBP1、HRD1、c-Met 蛋白表达检测 采用Western blotting 法检测两组ESR 相关蛋白p-eIF2α、XBP1,ERAD 通路相关蛋白HRD1,以及c-Met蛋白表达,步骤参照“1.3.3”。
1.5 统计学方法 应用SPSS24.0 统计软件。计量资料采用Kolmogorov-Smironv法进行正态性检验,符合正态分布的资料以± s 表示,两组间比较采用独立样本T检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 肝细胞ERS 模型构建结果 与对照组相比,TG 组p-eIF2α、HRD1表达水平升高,c-Met表达水平降低(P均<0.05)。TG 组ERS 相关蛋白p-eIF2α 表达上调,ERAD 通路激活,表明ERS 细胞模型构建成功。TG 组和对照组细胞增殖A 值分别为2.23 ± 0.18、3.00 ± 0.13,TG 组细胞增殖活力低于对照组(P<0.05)。见表1。
表1 两组细胞p-eIF2α、HRD1、c-Met蛋白表达水平 比较( s)

表1 两组细胞p-eIF2α、HRD1、c-Met蛋白表达水平 比较( s)
注:与对照组比较,*P<0.05;
组别TG组对照组p-eIF2α 15.65 ± 1.41*1.00 ± 0.08 HRD1 13.49 ± 1.26*1.00 ± 0.06 c-Met 0.19 ± 0.01*1.00 ± 0.09
2.2 Salubrinal 预处理对肝细胞ERS 及细胞增殖的影响 与TG 组相比,Salubrinal+TG 组细胞p-eIF2α、c-Met 蛋白表达水平升高,XBP1、HRD1 蛋白水平表达降低(P均<0.05)。见表2。Salubrinal+TG 组和TG 组 细 胞 增 殖A 值 分 别 为2.64 ± 0.19、2.23 ± 0.17,Salubrinal+TG 组细胞增殖活力较TG 组升高(P<0.05)。
表2 两组细胞p-eIF2α、XBP1、HRD1、c-Met蛋白表达 水平比较(± s)
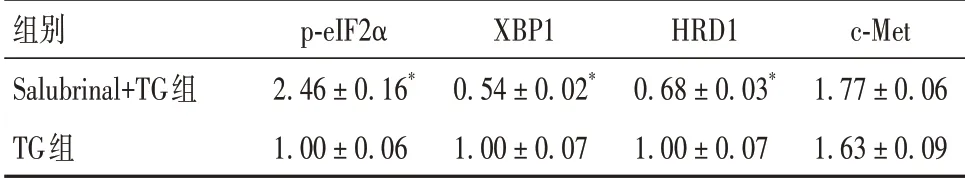
表2 两组细胞p-eIF2α、XBP1、HRD1、c-Met蛋白表达 水平比较(± s)
注:与TG组比较,*P<0.05。
组别Salubrinal+TG组TG组p-eIF2α 2.46 ± 0.16*1.00 ± 0.06 XBP1 0.54 ± 0.02*1.00 ± 0.07 HRD1 0.68 ± 0.03*1.00 ± 0.07 c-Met 1.77 ± 0.06 1.63 ± 0.09
3 讨论
肝脏在受到不同类型的损伤后具有较强的再生能力。肝脏再生的潜力在决定肝脏疾病的结局中至关重要,特别是患有肝功能失代偿、肝再生受损的肝纤维、急性肝衰竭的患者[5]。但是,在一些病理条件下,如慢性乙醇摄入、脂肪肝疾病、肝硬化、肝衰竭、胆道梗阻,肝再生是延迟或受损的,其具体机制尚不明确。有研究发现,在急性和慢性肝损伤中,HGF/c-Met 信号对肝细胞和肝祖细胞再生能力具有显著的促进作用[6]。ERS 是众多肝脏疾病的常见现象,对肝细胞的增殖与分化存在广泛影响。内质网是细胞内合成蛋白质、肽链折叠、修饰及脂类、糖类合成的重要场所,内质网还通过对钙的贮存与释放参与细胞内钙离子浓度的调节。当细胞受到缺氧、钙平稳紊乱等刺激引起内质网稳态失衡,使内质网腔内未折叠蛋白、错误折叠蛋白聚集,钙离子浓度改变时,可诱导ERS 发生。ERS 包括未折叠或错误折叠在内质网蓄积引起的未折叠蛋白反应(UPR)、正确折叠的蛋白在内质网过度蓄积、激活NF-κB 引发的内质网超负荷反应、胆固醇缺乏引发的胆固醇调节级联反应。ERS 诱导剂TG 能够不可逆地阻滞钙ATP 酶,阻止钙从细胞质向内质网重吸收,导致ER中钙浓度降低,抑制钙依赖性分子伴侣,使错误折叠的蛋白质增加,从而诱导ERS[7-8]。本研究采用TG诱导L02 细胞建立ERS 细胞模型,探讨ERS 与肝再生之间的潜在关系。结果表明,1 μmol/L TG 可显著增加肝细胞ERS 相关蛋白p-eIF2α 磷酸化水平,ERAD 通路激活,表明ERS 细胞模型构建成功;肝细胞增殖活力和c-Met 蛋白表达均下降,提示ERS 可下调c-Met蛋白表达,抑制肝细胞的增殖。
目前一般用UPR 来提示ERS 的发生。UPR 有3个应激感受蛋白,即PERK、ATF6、IRE1α,通过这些蛋白发挥作用,增强内质网对蛋白的折叠能力、促进内质网腔的错误折叠蛋白降解、减少蛋白质合成,从而恢复内质网的稳态。eIF2α 是调节ERS 的关键信号通路蛋白之一。细胞ERS 可激活未折叠蛋白反应,激活PERK 转化为具有活性的p-PERK,进而磷酸化eIF2α 生成p-eIF2α,p-eIF2α 可抑制eIF2B 催化eIF2·GDP 到eIF2·GTP 交换的功能,使得eIF2 不能被重复利用,降低AUG 启动密码子识别率,从而抑制大多数蛋白质合成的启动过程,抑制细胞整体的蛋白翻译水平,从而减轻内质网负担,维持内质网平衡的稳态[9]。p-eIF2α 也可经蛋白磷酸酶1(PP1)作用恢复至eIF2α 非活性状态。Salubrinal 作为eIF2α去磷酸化抑制剂,通过抑制PP1 活性来抑制p-eIF2α去磷酸化(即保持其磷酸化状态),减少蛋白合成,从而起到缓解细胞ERS 的作用[10-12]。为了观察eIF2α对肝细胞中c-Met 表达的影响及机制,本研究用Salubrinal 预处理抑制TG 诱导的ERS 细胞模型eIF2α去磷酸化,结果显示经过Salubrinal 预处理后,eIF2α磷酸化水平较TG 组显著增加,ERS 标志蛋白XBP1显著下降,提示Salubrinal 可以缓解细胞ERS。这与TIAN 等[13]的研究结果相符,即Salubrinal 抑制eIF2α去磷酸化可以减轻细胞ERS。为明确Salubrinal 减轻ERS 后对细胞增殖的影响,随后检测了c-Met 蛋白表达和细胞增殖活力,结果显示经过Salubrinal预处理后,与TG 组相比,c-Met 的下调趋势可部分逆转,肝细胞增殖活力部分回升。CHEN 等[11]也得出了类似结果,L02 细胞经Salubrinal 减轻ERS 后,反映再生的标志蛋白Cyclin D1 也得到了部分回升。以上研究表明,Salubrinal 具有抑制蛋白的翻译作用,但促进再生的指标c-Met 却部分恢复,提示eIF2α 磷酸化对蛋白质翻译的抑制作用并不直接调控c-Met蛋白的表达。
ERAD 是ERS 的反应形式之一,其降解机制是IRE1/XBP1/EDEM 信号通路对蛋白质发挥质量控制的关键机制,它可以直接作用于错误折叠或组装不完全的前体蛋白,使其逆向转运进入细胞质并被蛋白酶体降解[14]。HRD1 通过其生物活性域E3 泛素连接酶参与ERAD,促进蛋白质逆转易位[15]。本研究结果显示,ERS 能够上调HRD1,激活ERAD 信号通路;给予Salubrinal 预处理后,XBP1、HRD1 蛋白表达水平较TG 组降低,提示ERAD 及ERS 减弱。c-Met在给予Salubrinal预处理后表达的部分恢复是否与激活内质网相关降解的减弱有关,目前尚不明确,有待进一步研究。
综上所述,在肝细胞ERS 模型中,抑制eIF2α 去磷酸化可部分恢复肝细胞c-Met 表达,促进细胞存活,其机制可能与反馈减轻ERS 有关。抑制eIF2α去磷酸化有望成为恢复损伤肝细胞增殖的靶点。
