二氢丹参酮Ⅰ灌胃对急性缺血性脑卒中大鼠神经功能改善作用及其机制
2023-02-11刘陈吴文洁李淑婷蔡冰洁杨家霖张琪曼沈建英李韶菁
刘陈,吴文洁,李淑婷,蔡冰洁,杨家霖,张琪曼,沈建英,李韶菁
1 中国中医科学院中药研究所,北京 100700;2 安徽中医药大学药学院
缺血性脑卒中是世界第二大易致伤残疾病,其致病因素复杂,发病率高,严重影响患者生存质量[1-2]。开发治疗缺血性脑卒中的新药迫在眉睫。中药因其整体调控特点在缺血性脑卒中的治疗中具有独特优势,二氢丹参酮Ⅰ(DT)是来源于传统中药丹参根中的一种亲脂性二萜类化合物,具有抗肿瘤、心脑血管保护、抗炎、抗过敏、保肝等作用[3]。DT 纳米颗粒还可以显著改善大鼠脑缺血再灌注损伤,其机制与保护神经细胞免受氧化应激和炎症的影响有关[4]。无论抗氧化或抗炎作用研究,均从神经保护角度对DT 的抗缺血性脑卒中作用机制进行研究,而血管保护仍是目前中风治疗最主要的手段,缺血性脑卒中患者的预后与缺血后血管新生、血管网络重建息息相关。2022 年3 月—9 月,我们通过观察DT 对MCAO 大鼠神经功能、脑梗死体积及缺血侧脑血流灌注量、脑组织病理状态的影响,从血管保护角度探讨DT 改善缺血性脑卒中的作用机制,为进一步明确DT 抗缺血性中风作用机制提供实验证据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SD大鼠50只,体质量240~260 g,北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2021-0006。本实验经中国中医科学院中药研究所动物福利伦理委员会审核批准。
1.1.2 药物、试剂与仪器 DT(Med Chem Express)。胎牛血清(PAN);DMEM 培养基(Gibco),SDS-PAGE 凝胶配制试剂盒(碧云天),BCA 蛋白浓度测定试剂盒(碧云天),苏木素伊红(HE)染色试剂盒(索莱宝),水合氯醛(国药),CD31 单克隆抗体(Invitrogen),血管内皮生成因子(VEGF)单克隆抗体(Invitrogen),缺氧诱导因子1α(HIF-1α)多克隆抗体(Abcam),辣根过氧化物酶标记山羊抗兔IgG(H+L)(碧云天),TTC(索莱宝)。台式高速冷冻离心机(H-1850R),酶标仪(SUNRISE),激光散斑血流仪(Perimed),荧光显微镜(Olympus)。
1.2 动物分组与模型制备 将50 只大鼠随机分为假手术组、模型对照组及DT 高、中、低剂量组各10只。模型对照组和DT 高、中、低剂量组采用线栓法[5]制备MCAO 模型,剪开大鼠颈部皮肤,分离肌肉暴露颈总动脉和分叉,结扎颈总动脉下端,用动脉夹夹闭颈总动脉上部,用眼科剪将颈总动脉剪开一小口,插入线栓,打开动脉夹,将线栓插入颈内动脉至离分叉1.8 cm 的距离,固定线栓,缝合伤口。假手术组不插栓,仅暴露颈总动脉及埋线处理。
1.3 药物干预方法 将DT 溶解于含2% DMSO 的生理盐水中。造模后24 h,DT 高、中、低剂量组分别给予15、5、1.67 mg/kg DT 灌胃,假手术组和模型对照组给予含2% DMSO 的生理盐水灌胃,每天1 次,连续7 d。
1.4 神经功能评估 于造模前和给药7 d 后,采用Zea-Longa 五分制评分法[5]对所有大鼠进行神经行为学评分。0分:正常,无神经功能损伤。1分:左侧前爪不能完全伸展,轻度神经功能损伤。2 分:行走时,大鼠向左侧转圈,中度神经功能损伤。3 分:行走时,大鼠身体向左侧倾倒,重度神经功能损伤。4 分:不能自主行走,有意识丧失。
1.5 大鼠脑梗死面积测算 采用TTC 染色法。每组选取3 只大鼠,麻醉后取脑,去除小脑及嗅球,液氮速冻后切2 mm 厚切片。加入2% TTC 溶液,37 ℃孵育15 min。由于活细胞线粒体内的脱氢酶可以将TTC还原为红色甲臢化合物,故白色即为梗死部分。使用PS软件计算脑梗死体积,并将模型对照组脑梗死体积标准化为100%,假手术组标准化为0。梗死体积=梗死面积×2 mm。
1.6 大鼠缺血侧局部脑血流灌注量检测 每组选取3 只大鼠,于麻醉后进行MCAO 手术前15 min,将大鼠两耳连线中点至颅定皮肤剪开,棉签蘸取生理盐水搓掉颅骨上筋膜,直至露出颅骨。在两顶骨靠近矢状缝位置取2 mm×2 mm 区域用磨杵磨薄。将大鼠转移至激光下,调整颅骨位置距扫描头13 cm左右,记录数据,待血流基本稳定后可停止记录,取血流稳定的一段监测值作为平均血流灌注量(TOI),对大鼠进行造模。造模完成后,监测记录造模后局部脑血流灌注量,缝合头皮伤口。给药7 d后,打开伤口,监测脑缺血侧局部脑血流灌注量,根据公式计算局部脑血流灌注量变化率。局部脑血流灌注量变化率=[(给药后TOI-造模后)/(造模前TOI-造模后TOI)]×100%。
1.7 大鼠缺血侧海马区病理形态观察 采用HE染色法。每组选取3只大鼠,心脏灌注后取脑组织,放入4%多聚甲醛中固定24 h。将组织包埋于石蜡中,切0.5 μm 厚切片,脱蜡水化处理。按照说明书进行HE染色,光镜下观察。
1.8 脑组织HIF-1α、VEGF、CD31 蛋白表达检测 采用Western blotting 法。每组选取4 只大鼠,取缺血侧脑组织,提取总蛋白,BCA 法测定蛋白浓度。制备SDS 凝胶板,每孔上样50 μg 蛋白,以电压80 V电泳30 min后转120 V电泳1 h;以电流200 mA将凝胶上的蛋白转至PVDF 膜上;5%脱脂奶粉封闭1 h。TBST 清洗,加入HIF-1α、VEGF、CD31 一抗(稀释比例均为1∶1 000),4 ℃过夜孵育。TBST清洗,加入二抗(稀释比例为1∶1 000)常温孵育1.5 h,TBST 清洗。滴加ECL 发光显影液显影拍照,用Image J 软件分析条带灰度值。
1.9 统计学方法 采用SPSS22.0 统计软件。采用Shapiro-Wilks 法对数据进行正态分布检验,符合正态分布的计量资料以±s表示,多组间比较用单因素方差分析,组间两两比较用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组神经行为学评分比较 给药前,模型组及DT 各剂量组神经行为学评分均较假手术组升高(P均<0.01);给药7 d后,与模型组比较,DT高、中剂量组神经行为学评分均降低(P<0.01),低剂量组无明显变化,其中高剂量组神经行为学评分低于低剂量组(P<0.01)。见表1。
表1 各组神经行为学评分比较(分 ± s)

表1 各组神经行为学评分比较(分 ± s)
注:与假手术组比较,#P<0.01;与模型对照组比较,*P<0.01;与低剂量组比较,△P<0.01。
组别假手术组模型对照组DT高剂量组DT中剂量组DT低剂量组n 10 10 10 10 10神经行为学评分给药前0.00 ± 0.00 2.60 ± 0.52#2.70 ± 0.48#2.70 ± 0.48#2.70 ± 0.48#给药7 d后0.00 ± 0.00 2.67 ± 0.52#1.33 ± 0.52*△1.83 ± 0.41*2.33 ± 0.52
2.2 各组缺血侧脑梗死体积比较 假手术组、模型对照组以及DT 高、中、低剂量组缺血侧脑梗死体积分别为0% ± 0%、100% ± 5%、41% ± 13%、67% ± 6%、84% ± 5%。与假手术组比较,模型组梗死体积增加;与模型组比较,DT 中、高剂量组梗死体积减小,低剂量组无明显变化,高剂量组缺血侧梗死体积小于低剂量组(P均<0.01)。
2.3 各组脑缺血侧局部脑血流灌注量变化率比较 假手术组、模型对照组以及DT高、中、低剂量组缺血侧局部脑血流灌注量变化率分别为0% ± 0%、15.30% ± 4.34%、47.22% ± 21.32%、40.42% ± 8.21%、24.05% ± 5.40%。与假手术组比较,模型组脑血流灌注量变化率降低(P<0.01);与模型组比较,DT 中、高剂量组脑血流灌注量变化率均增加(P<0.05 或P<0.01),低剂量组无明显变化;高剂量组脑血流灌注量变化率高于低剂量组(P<0.05)。
2.4 各组脑缺血侧海马区细胞形态比较 假手术组海马区细胞排列整齐,细胞核位于中央,细胞膜完整;模型对照组细胞排列紊乱,细胞肿胀破裂,细胞核萎缩;DT 不同剂量组海马区细胞形态均有不同程度的改善,其中DT 高剂量组改善最为明显。见图1。

图1 各组脑缺血侧海马区细胞形态比较(HE染色,200×)
2.5 各组缺血侧脑组织VEGF、CD31、HIF-1α 蛋白表达水平比较 与假手术组比较,模型对照组脑组织VEGF、HIF-1α 蛋白表达水平升高(P均<0.01),CD31 表达水平下降(P<0.05);与模型组比较,DT中、高剂量组VEGF、CD31、HIF-1α 表达水平均升高(P均<0.01),其中DT高剂量组高于DT低剂量组(P均<0.01)。见表2。
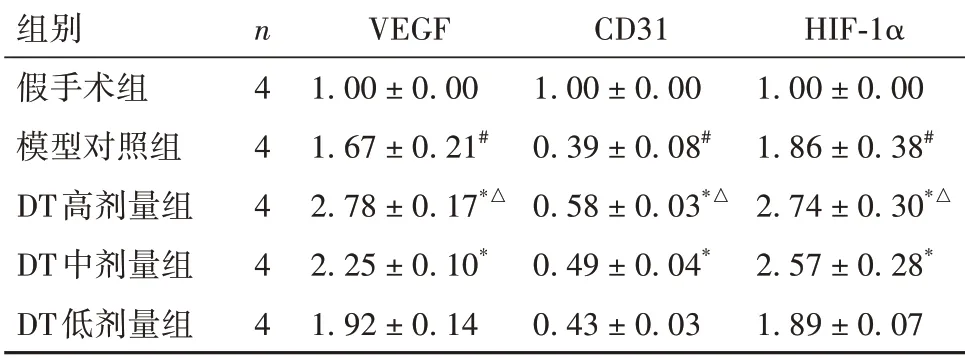
表2 各组缺血侧脑组织VEGF、CD31、HIF-1α蛋白表达 水平比较(-x ± s)
3 讨论
缺血性脑卒中会引起线粒体功能障碍、酸中毒、炎症等一系列有害反应,常导致患者出现身体残疾、认知障碍等神经功能缺陷。目前临床治疗仍以静脉溶栓为主,但受其治疗时间窗的限制,全球仅有5%的缺血性脑卒中患者能在4.5 h 内接受静脉溶栓治疗并得到有效救治[6]。缺血性脑卒中后恢复与大脑重建神经血管网络结构和功能的能力息息相关,药物治疗可以增强重建过程并恢复受损的大脑功能[7]。目前常见药物有钙通道拮抗剂、自由基清除剂、谷氨酸拮抗剂和细胞膜稳定剂等,但大多数仅在动物实验中效果较好,尚未有相关药物在临床治疗中显示出较好的疗效[8]。DT 分离自丹参根,据文献报道,DT 可以通过诱导细胞周期阻滞和细胞凋亡、改善药物耐药性、抑制病理性血管生成等途径发挥抗癌作用,通过降血脂、抗血小板聚集等途径发挥心脑血管保护作用,其心脑血管保护作用可能比国内临床常用的丹参酮ⅡA 效果更好[3]。本研究结果显示,与假手术组比较,模型对照组神经行为学评分升高;与模型对照组比较,DT中、高剂量组给药7 d 后神经行为学评分显著降低,表明DT 能够改善大鼠神经功能。与假手术组比较,模型组缺血侧脑组织梗死体积增加,局部脑血流灌注量变化率降低;与模型组比较,DT 中、高剂量组给药7 d 后缺血侧脑组织梗死体积缩小,局部脑血流灌注量变化率显著增加,表明DT 可以改善缺血侧脑血流,减小MCAO 大鼠脑梗死面积,从而改善大鼠神经功能。
缺血性脑卒中会导致大脑皮层及海马区域出现病变,如细胞形态改变及细胞间连接确实等,而海马区变形会导致患者长期认知障碍[9-10]。本研究结果显示,模型对照组细胞排列紊乱,细胞肿胀破裂,细胞核萎缩;DT不同剂量组海马区细胞形态均有不同程度的改善,其中DT高剂量组改善最为明显。这表明DT可以改善缺血性脑卒中后脑组织病理状态,发挥脑神经保护作用。
血管保护是缺血性脑卒中研究的重要内容,内皮细胞增殖、迁移和形成管腔是血管生成的重要中间过程,血管生成可以增加脑血流,将代谢营养物质输送至受梗死影响的大脑区域,从而改善缺血性脑卒中。VEGF 是具有促血管生成活性的代表性生长因子,对内皮细胞具有促有丝分裂和抗凋亡作用[11]。VEGF与其同源受体2结合后,通过激活丝裂原活化蛋白激酶、磷酸肌醇3激酶、AKT 等信号通路促进内皮细胞增殖、尖端细胞丝状足延伸及细胞外基质降解,从而促进血管出芽并启动血管生成开关[12];VEGF 信号还可以促进非肌肉肌球蛋白Ⅱ向表面的募集,通过肌动球蛋白的收缩性促进茎细胞形成管腔[13]。内皮细胞标志物CD31 是一种跨膜糖蛋白,表达于早期和成熟的血管内皮细胞,可响应剪切应力促进血管生成[14]。本研究结果显示,与假手术组比较,模型对照组CD31 蛋白表达水平下降,VEGF 蛋白表达水平增加,表明缺血性脑卒中后整体脑血管数量下降,存在血管再生趋势;与模型组比较,中、高剂量DT给药7 d后,VEGF、CD31蛋白表达水平均显著增加,表明DT具有促进血管再生作用。
HIF-1α 是细胞核中的异源转录因子,对氧浓度高度敏感。缺氧刺激会促进HIF-1α 进入细胞核,与HIF-1β 形成二聚体,从而调节各种促血管生成因子的转录与表达[15]。VEGF 基因的5′末端存在缺氧反应元件,是VEGF 与HIF-1α 的结合位点,因此,在缺氧情况下,HIF-1α 在由VEGF 调节的血管生成中起重要作用[16]。银杏内酯k 以及临床常用抗缺血性脑卒中药物丁基苯酞均可以通过HIF-1α/VEGF 通路促进中风后血管再生挽救脑组织[17-18]。
本研究结果显示,与假手术组比较,模型对照组HIF-1α 表达增加;与模型对照组比较中、高剂量DT给药7 d后,HIF-1α表达显著增加,表明DT可能通过促进HIF1α表达发挥促血管再生作用。
综上所述,DT 能够促进大鼠MCAO 后脑血管生成,进而改善缺血侧脑组织病理状态,减少梗死体积,改善大鼠的神经功能。DT促血管生成作用可能与HIF-1α/VEGF 通路有关,这可能是其发挥神经保护作用的重要机制,为DT作为缺血性脑卒中治疗新药提供了实验依据。
