口腔种植成骨材料的研究现状及进展
2023-02-10牛丽娜沈敏娟
牛丽娜,沈敏娟,方 明
炎症、肿瘤、外伤等原因造成天然牙缺失后,牙槽骨由于失去功能性刺激,会发生进行性和不可逆性的骨吸收[1]。临床研究发现,约2/3的病例在牙拔除后的前3个月,牙槽骨体积就已发生改变。当牙槽窝愈合后,牙槽骨整体宽度减少2.6~4.5 mm,高度下降0.4~3.9 mm,在牙拔除后1年内,磨牙及前磨牙区的牙槽嵴宽度可减少50%[2]。口腔种植体周围的骨量及骨质是影响种植修复效果的关键因素[3]。在临床上,缺失牙患者口内种植区的牙槽骨水平或垂直骨量不足将直接影响美学修复效果、种植体应力分布,甚至可导致种植修复的失败[4]。如今,得益于骨替代材料的快速发展,通过在种植术区植入成骨材料,重建缺失的骨组织并获得理想的骨量已逐渐成为临床常用的牙槽骨增量方法之一。最近的研究证实,种植手术使用植骨材料进行骨增量的比例约占50%[5];另有研究预测,在2025年,全球口腔植骨材料市场值将高达9.31亿美元,年综合增长率达9.5%[6]。因此,研发新型口腔植骨材料将成为生物材料领域近几年的研究热点。本文将重点介绍口腔植骨材料在骨缺损种植手术中的临床运用及研究现状,并展望口腔植骨材料未来的发展方向。
1 口腔植骨材料性能
理想的口腔植骨材料应具备诱导骨组织再生的能力,并最终达到骨替代效果。其中,骨诱导、骨传导和骨生成这三项基本生物学性能,对于植骨材料功能发挥十分重要[7]。骨传导指植骨材料可作为结构支架提供宿主细胞生长黏附以促进新骨形成;骨诱导指材料可募集、刺激宿主体内的干细胞分化为成骨细胞并最终形成新骨;骨生成指材料具备能够主动成骨的细胞并启动骨组织再生过程[6]。
此外,植骨材料的以下性能也可影响骨形成过程:①材料应具有适宜的结构孔径大小,以允许骨细胞通过及营养物质交换,其最小孔径不应低于100 μm,而孔径>300 μm则利于血管及新骨形成;②材料应具有适宜的表面形貌,利于细胞黏附、迁移增殖及血管形成;③材料应具有适宜的机械强度及弹性,利于缺损区周围软硬组织的力传导;④材料应具有生物可降解性,以维持新骨形成和材料降解的平衡;⑤材料还应具有良好的生物相容性、生物活性以及低免疫原性等。以上几类性能决定了植入材料的使用基础及临床运用,当植入材料在宿主体内发挥出相应功能时,新骨形成和组织修复才得以实现[8](图1)。目前,市场上口腔植骨材料种类繁多,性能不一。根据植骨材料的不同来源、物理化学性能及生物学性能等进行分类,有助于植骨材料的临床选择及运用。
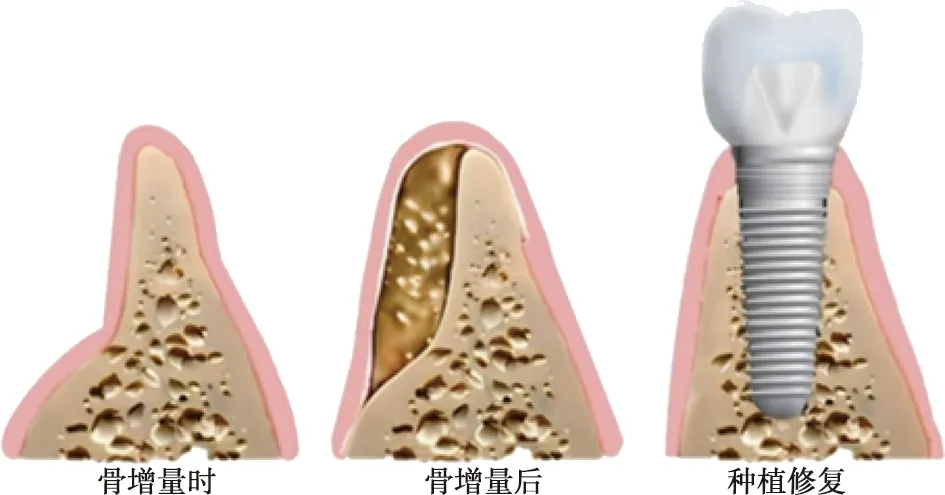
图1 种植术前骨增量
2 口腔植骨材料分类及临床运用
目前用于口腔种植骨增量的植骨材料根据其成分及来源主要分为以下三种(图2)。
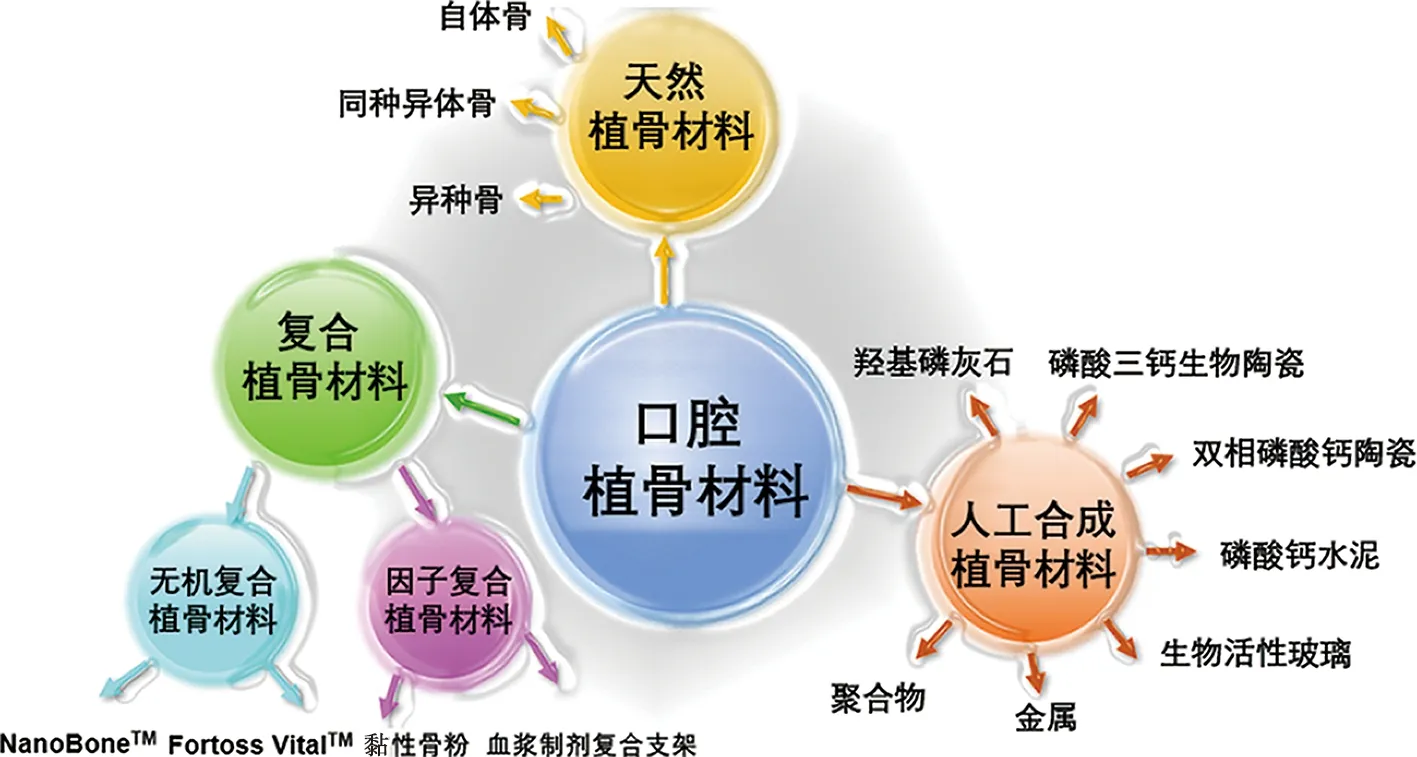
图2 口腔植骨材料分类
2.1 天然植骨材料
天然植骨材料包括自体骨、同种异体骨(如脱矿骨基质(demineralized bone matrices,DBM))及异种骨。全世界约90%的口腔植骨手术使用上述植骨材料来修复骨缺损。
2.1.1 自体骨
自体骨具有较好的生物安全性、无免疫原性,且兼具骨传导、骨诱导及骨生成等生物性能,被认为是植骨材料的金标准[9]。自体骨通常包含皮质骨和松质骨,其作为口腔植骨材料可源于同一个体的口内或口外部位,如下颌骨颏部、下颌升支、外斜嵴、髂骨、胫骨等。松质骨是最常用的自体骨,不仅含有成骨细胞或成骨前体细胞,且其骨小梁表面积、孔径较大,可在植入区促进血管生成,形成适宜的骨诱导环境。皮质骨虽缺乏成骨细胞,但其可恢复缺损区结构的完整性,并通过骨传导促进骨缺损愈合。因此,松质骨和皮质骨结合使用可最大限度地发挥自体骨的骨重塑性能和愈合潜力[10]。在口腔临床应用中,自体骨可用于局限性的牙槽骨缺损、上颌窦提升、下颌后无牙区重建及牙槽嵴增高术。与骨替代材料相比,自体骨移植的成骨潜能较好,能产生大量的新骨,利于骨功能的恢复[6]。
但是,自体骨也存在临床局限,如需要二次手术,供体部位损伤、手术成本更高、风险更大。临床研究发现,在243例自体骨移植手术中,约8.6%的患者出现术后并发症如感染、炎症和疼痛等不良反应。因此,对于相对较小的骨缺损或较大的颅面部缺损,自体骨移植并非最佳的治疗方式[11]。
2.1.2 同种异体骨
同种异体骨是指同一种群中其他个体的健康骨组织。使用同种异体骨是自体骨移植的主要替代方法。同种异体骨的骨源较为丰富,最新的研究表明,2021年同种异体骨占全球骨植入材料市场总额的55%[12]。
同种异体骨已在口腔临床中被用于填补牙周、上颌和下颌骨的缺损。其中块状同种异体骨已被常规用于种植手术前牙槽嵴高度缺陷或牙槽嵴严重萎缩患者的牙槽骨增量[13]。国外品牌Dynagraft、DBM PuttyTM、OpteformTM,国内品牌鑫康辰、拜欧金、联结骨粉等均属于同种异体骨。DBM属于冷冻干燥骨,具有原始骨小梁结构,其内部仍保留有活性的骨形成蛋白(bone morphogenetic protein,BMP)和生长因子,可以发挥刺激间充质干细胞成骨向分化的作用,具有较好的骨诱导能力[14]。临床研究表明,DBM可用于保存拔牙后的牙槽骨高度和水平宽度,移植后6个月即可形成矿化和成熟的骨组织。但DBM的骨诱导能力高度依赖于组织制备技术,化学处理环节可对其骨诱导活性产生不利影响[15]。近年来,由于同种异体骨的供应量不足及异体骨使用的监管限制更为严格,其临床应用出现一定程度的下降[16]。
2.1.3 异种骨
异种骨是指与宿主基因不同,且来源于不同物种的骨组织。口腔领域中最常用的异种骨是小牛骨。当牛骨经过逐步退火及化学处理后,牛骨中的无机成分即多孔羟基磷灰石(hydroxyapatite,HA)得以保留,其多孔结构与人体骨组织结构高度相似,植入后能够提供良好支撑,并通过骨传导作用促进骨愈合。此外,这种多孔结构具有较高的表面积,可促进血管生成及新骨形成,最终达到较好的骨修复效果[17]。
目前,在异种骨的临床应用中,最具代表性的是BioOssTM,它具有优越的成骨性能和低免疫原性,已广泛用于上颌窦提升和口腔种植手术[18]。有临床研究发现,上颌窦缺损部位用BioOssTM移植6个月后新骨形成率为39%,与自体骨移植6个月后国外品牌的新骨形成率(40%)相当[19]。另外,国外品牌OsteoGrafTM、CeraboneTM,国产品牌髂瑞骨粉、海奥骨粉、天津中津骨粉等也属于异种骨商品。上述产品的成分均来源于牛骨,免疫原性低,具有与人体骨组织相似的结构和理化特性,具有较好的临床应用前景[20]。
2.2 人工合成植骨材料
由于天然植骨材料(如上述异种骨及同种异体骨)存在免疫原性及疾病传播的风险,因此人工合成植骨材料得到快速发展。人工合成植骨材料的合成目标在于其理化特性及生物学性能应尽可能模拟天然骨组织。目前,人工合成植骨材料种类众多,如磷酸钙陶瓷、生物玻璃、金属及聚合物等。
2.2.1 HA
HA的化学成分与骨组织的无机成分相似,植入后可在生物体内释放钙磷离子,是一种良好的支架材料。其中,商业产品OstimTM和EndobonTM属于HA植骨材料。然而,人工合成的HA由于具有较高的钙磷比和结晶度,因此降解速率低。此外,HA的机械强度不足,无法在高承重部位发挥功能。有研究发现,在上颌窦提升和牙周骨缺损增量的种植病例中,单独使用HA植骨后所形成的新骨质量和数量不足以维持牙槽嵴高度[21]。因此,HA在口腔的临床应用通常局限于种植体涂层及骨针表层等低负荷应力部位。最新研究发现,与传统形式的HA相比,纳米级HA由于具有较大的表面积,可有效促进细胞黏附、增殖和分化。同时,纳米级HA具有更好的力学性能、可降解性及可调控性,能够促进生物活性分子的传递和控释,因此其生物学性能及促骨再生能力较为优越[22]。
2.2.2 磷酸三钙生物陶瓷(β-tricalciumphosphate,β-TCP)
β-TCP具有较低的钙磷比,良好的生物降解特性,同时其孔隙较大,能够促进血管长入及成骨细胞黏附,因此在临床上应用广泛。国外品牌CerasorbTM、OSferionTM及国产品牌贝奥路骨粉等均属于商业化β-TCP植骨材料。Nakajima等发现,β-TCP的骨再生潜力与冻干同种异体骨和自体骨材料相当[23]。但其多孔结构使其机械强度降低,限制了应用推广。这类植骨材料适用于牙周骨缺损、根尖周骨缺损、种植体周围或牙槽骨部位等缺损修复[24]。
2.2.3 双相磷酸钙陶瓷
在过去的几十年里,研究人员开发了一种兼具β-TCP的可吸收特性和HA的骨传导特性的植骨材料——双相磷酸钙陶瓷[25]。国外品牌MasterGraftTM及国产品牌固邦骨粉等均属于双相磷酸钙陶瓷植骨材料。有研究证实,在根尖周手术中,双相磷酸钙陶瓷作为骨替代物,在两年内显示出较好的临床效果,牙槽骨得到修复[26]。因此,双相磷酸钙陶瓷可用于骨组织局限性缺损修复、牙槽嵴增高、上颌窦提升等手术。
2.2.4 磷酸钙水泥(calciumphosphate cements,CPCs)
CPCs通常包括两种体系,即水剂和粉剂,其中粉剂包含磷酸钙材料,如α-TCP和HA。当上述体系相混后可形成操作性较强的糊剂,其在室温下能够发生原位固化并形成HA纳米晶体。市售的NorianTM、injectTM、HydrosetTM、BoneSourceTM及国产瑞邦骨泰即属于CPCs。CPCs的主要优点包括自固化能力、在骨缺损区易塑形以及较好的生物相容性和骨传导性等[27]。因此,在口腔临床应用中,CPCs可用于骨缺损修复及骨折重建。然而,CPCs的主要缺陷在于成分反应不完全,可导致炎症反应,同时该材料缺乏孔隙结构,一定程度上限制了骨组织再生的速率。最近有研究对CPCs粉体的粒径、分布、形状和颗粒间相互作用进行优化;或者在CPCs中掺杂硅、锶等多种离子,生物活性玻璃(bioactive glasses,BAG)等以提高其生物活性[28]。
2.2.5 BAG
BAG的成分包括二氧化硅、钠氧化物、氧化钙和五氧化二磷。最近有研究通过添加氧化钾、氧化镁和硼酸盐等物质使BAG的性质更为稳定[7]。此外,锌掺杂或银掺杂的BAG具有抗菌性,可抑制牙周病相关微生物的生物膜形成[29]。当BAG暴露在体液中时,由于硅离子的持续释放,可在材料表面形成HA层,利于成骨细胞的黏附。因此,BAG具有良好的生物相容性、骨诱导性、抗菌活性和促进血管形成的作用[30]。PerioGlas®和UniGraft®是目前市场上在售的BAG产品。有研究发现,在使用UniGraft®治疗骨下袋缺损的13例患者中,术后骨袋深度显著减少,临床附着得到恢复[31]。此外,BAG已成功用于单侧牙槽骨裂的修复及正畸患者拔牙术后牙槽骨位点的保存[32]。但是,BAG的机械强度低,抗断裂性能较差。因此,它们在口腔中的应用也仅限于低应力环境或与其他植骨材料结合使用。
2.2.6 金属
最近有研究发现,金属离子,如镁、锶、锌元素在维持骨骼生理功能和刺激骨形成过程中发挥了重要作用。在口腔领域,由于镍钛材料具有良好的机械强度、生物相容性、耐腐蚀和弹性模量等优势,在骨缺损修复中得到较多应用[33],其中OSS BuilderTM属于镍钛类商业化产品。但是,使用镍钛材料的缺点则在于需进行二次手术取出,存在软组织开裂或骨组织暴露等不良反应。近年来,Liu等[34]利用纯镁和镁-锶合金开发了一种镁基植骨材料,与传统的商业骨移植材料(如HA和TCP材料)相比,该新型镁基材料显示出更高的抗拉和抗压强度、更好的生物相容性和抗菌性能,其在骨承重区域作为骨植入材料具有较好运用前景。
2.2.7 聚合物
聚合物包括聚乳酸、聚乙醇酸、聚己内酯及其共聚物或衍生物,其可用作骨组织再生材料,主要优势在于可植入形式多样、免疫原性低、降解可控及多孔性等。但聚合物基植入材料在降解过程中易产生酸性产物,造成局部pH值变化、影响细胞黏附能力,限制了其临床应用[35]。因此,目前有诸多研究关注聚合物支架的改性或将其与HA、TCP、生长因子等物质结合使用,以提高材料的骨再生能力。HTR Synthetic BoneTM是一种商用聚合物基植骨材料,主要由PMMA、聚羟乙基甲基丙烯酸酯和氢氧化钙组成,目前该产品已成功用于牙周骨袋和根分叉区骨缺损的修复[36]。
2.3 复合植骨材料
复合植骨材料旨在通过结合不同材料(如磷酸钙陶瓷、生物玻璃、聚合物支架及生长因子等)的特性,以改善骨传导或骨诱导作用,提高生物学效应。
2.3.1 无机复合植骨材料
NanoBoneTM是一种新型复合植骨材料,它由76% HA和24% 二氧化硅组成。NanoBoneTM不仅具有高孔隙率,同时保持高韧性和机械强度,在植入后能快速与骨组织发生整合。动物模型证实,NanoBoneTM植入后8个月骨小梁形成,植入材料发生吸收,骨缺损得到修复。进一步研究发现,NanoBoneTM可以维持拔牙后牙槽骨高度,当其与富含血小板的纤维蛋白联合使用时,可加速骨再生,提高新骨的质量和数量[37]。
在口腔领域,另一种常用的可吸收复合植骨产品是FortossVitalTM,由β-TCP及硫酸钙基质组成。该材料作为一种骨传导结构支架,带有负电荷,能够吸引带正电荷的BMP和组织液,进而募集成骨细胞,最终促进骨再生。目前,FortossVitalTM已成功应用于牙槽骨增高、种植修复和牙槽骨保存等手术[38]。
此外,矿化胶原由无机磷灰石晶体及有机胶原纤维所构成,其微观结构及物质组成与人体真实骨组织相似,因此也受到广泛研究。国产品牌髂金及齿贝等产品属于矿化胶原人工骨修复材料,上述材料在骨缺损修复及拔牙后的位点保存中具有较好疗效。有研究表明,胶原纤维内硅化胶原、铈化胶原、钙硅杂化胶原及经核酸诱导胶原纤维内钙化胶原等新型矿化胶原基材料对于动物骨缺损具有较好修复效果,有较好的临床运用前景[39-41]。
2.3.2 生长因子复合植骨材料
BMP、血小板衍生生长因子(platelet-derived growth factors,PDGF)和胰岛素样生长因子(insulin-like growth factors,IGF)等生长因子具有骨诱导特性,可促进间充质干细胞的成骨向分化,并促进骨组织的再生[42]。在临床应用中,通过离心自体全血制成的具有良好生物相容性的血浆制剂,如富含纤维蛋白的血浆(plasma rich in fibrin,PRF)、浓缩生长因子(concentrated growth factor,CGF)及PDGF,可与胶原海绵、钛网或β-TCP/HA等支架或载体相结合,用于上颌窦提升、牙槽骨增量、牙周炎所致骨缺损及下颌骨缺损重建等手术,有效提高了临床治疗效果。但是,生长因子在靶向骨再生修复中的有效性及在临床应用中的生物活性及作用机制等仍不明确,还需要进一步研究[43]。
黏性骨粉(sticky bone)是由骨粉、生长因子及自体纤维蛋白所组成,可操作性强,结构稳定。同时,该材料内部的自体纤维蛋白网可阻止软组织细胞迁移、促进成骨细胞募集、减少术区的骨丢失并加速骨组织愈合。有研究表明,在萎缩的牙槽嵴内植入黏性骨粉4个月后,即可获得良好的牙槽嵴骨增量效果[44]。
综上所述,用于骨增量的口腔植骨材料类型多样,其相应的临床适用条件不尽相同。目前,植骨材料配合屏障膜的使用是实现可预期牙槽骨增量的有效临床方法之一,即引导骨组织再生技术(guided bone regeneration,GBR)。
3 GBR技术
GBR技术是临床用于口腔种植骨增量的常见方法,其原理在于利用生物免疫屏障膜(GBR膜)隔绝缺损区邻近软组织长入,为成骨细胞在骨缺损区生长创造有利条件,进而引导骨组织的修复(图3)。近期有研究证实,GBR技术可使得牙槽骨组织在水平及垂直方向增量超过5 mm,在牙槽骨重度萎缩及重度缺损患者中,利用GBR技术甚至可使牙槽嵴增高超过8.5 mm[45-46]。
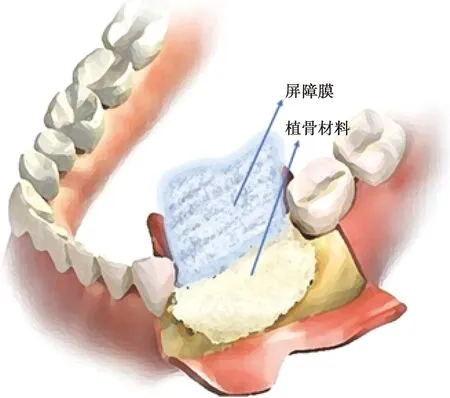
图3 GBR技术用于骨增量
常用于GBR技术的屏障膜是可吸收性胶原膜,如BioGideTM、海奥生物膜等。胶原膜因其来源丰富、生物相容性好及抗原性低等优势,在临床上得到广泛应用[47]。但是,单纯胶原膜易降解、机械性能差,因此诸多研究关注提高GBR膜的机械强度。有研究证实,PCL/PLGA/β-TCP复合膜作为GBR膜时,骨再生水平高于单纯使用胶原膜,并能在潮湿环境中保持稳定的机械性能[48]。有研究利用丝素蛋白(silk fibroin,SF)合成的GBR膜,具有良好的生物相容性、降解性、优异的拉伸强度、良好的成骨潜力和力学性能。SF来源的GBR膜可运用于拔牙、囊肿/肿瘤切除和牙槽骨缺失后的骨组织修复[49]。此外,有研究表明,仿生自矿化胶原膜也可作为GBR膜,具有良好的抗拉强度、屏障功能、机械性能及成骨诱导效果,可为后期新型GBR膜的临床转化提供参考[50]。
4 总结与展望
理想植骨材料的标准早在几十年前就已提出,但直到今天,自体骨移植仍然是金标准。然而,自体骨来源有限等不足限制了其临床应用,因此新型人工合成植骨材料得到快速发展。但目前市售的人工合成植骨材料在生物力学性能及骨诱导能力等方面仍然存在缺陷。因此,人工植骨材料的进一步研发应聚焦于提高其机械强度、多孔结构、可降解性、成血管能力及骨诱导效果。随着组织工程领域研究的不断深入,通过将骨诱导生长因子、间充质干细胞与材料支架相结合,不仅可提高植骨材料的骨再生能力,还可抑制不良炎症反应,为骨缺损修复及种植术前牙槽骨增量提供新方案。但是,新型植骨材料研发应考虑到安全性和有效性,只有结合理想的生物学参数,研发易于获得且具有成本效益、符合临床标准的商业化产品,才能为新型植骨材料的广泛临床应用提供可能性。
