藏沙蒿种质材料苗期抗旱性综合评价
2023-02-10王绮玉仁增旺堆王敬龙罗建民
王绮玉,刘 欢*,仁增旺堆,王敬龙,罗建民,黄 颖,董 凯
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.西藏自治区农牧科学院草业科学研究所,西藏 拉萨 850000)
藏沙蒿(Artemisiawellbyi)为菊科(Compositae)蒿属(Artemisia)半灌木状草本,是西藏特有植物种,在群落中为建群种或优势种,具抗寒、抗旱和防风固沙等重要生态功能[1],其生境多为河滩、草坡和流石滩,主要分布在西藏藏北和藏西北地区。西藏高原是青藏高原的主体,该区气候独特,全区草地类型丰富,其生态环境却极其脆弱[2]。近年来,由于全球变暖及人为因素等干扰,高寒荒漠草原类和高寒荒漠类草地均出现了不同程度的退化现象。草牧矛盾一直是中国高寒区畜牧业发展中最突出的问题之一,尤其是冬春季草场超载严重,草场放牧强度急剧增大,导致草场风蚀和风积过程加剧,进一步加速了草场荒漠化[3-5]。在西藏高寒干旱生境下,藏沙蒿形成了其独有特征和适应机制,对干旱具有极强的抗性,可作为该类退化草地修复的优良补播草种。因此,开展藏沙蒿种质材料抗旱性筛选、鉴定是该类草地修复的基础。
植物抗旱性受多种因素影响,以单一指标评价具有一定的片面性,需用多个指标进行综合评价[6-7]。通常多采用抗旱系数和抗旱指数指标来评价植物的抗旱性。这些指标在长穗偃麦草(Elytrigiaelongate)[8]、披碱草属(Elymus)[9]、沙棘属(Hippophae)[10]等植物抗旱性研究中已成功应用。目前,有关藏沙蒿的研究主要集中于资源调查[1]、营养成分分析[11]和与其它植物的竞争效应[12]等方面,对藏沙蒿苗期抗旱性综合评价还未见报道。苗期作为植物对水分变化最敏感的时期,对于鉴定植物的抗旱能力具有时间短、结果准确、可重复性强等优点,在植物抗旱性评价中应用广泛[8]。基于此,本研究以采自西藏地区不同生境的藏沙蒿种质材料为研究对象,采用盆栽控水法,对13份材料的11个抗旱指标进行综合评价,筛选抗旱型和干旱敏感型种质材料,以期为藏沙蒿种质资源作为生态草在青藏高原的合理开发利用提供有效策略。
1 材料与方法
1.1 试验材料
供试藏沙蒿种质材料共13份(表1),由西藏自治区农牧科学院研究所协助采集藏沙蒿成熟种子,室温保存在甘肃农业大学草业学院实验室。
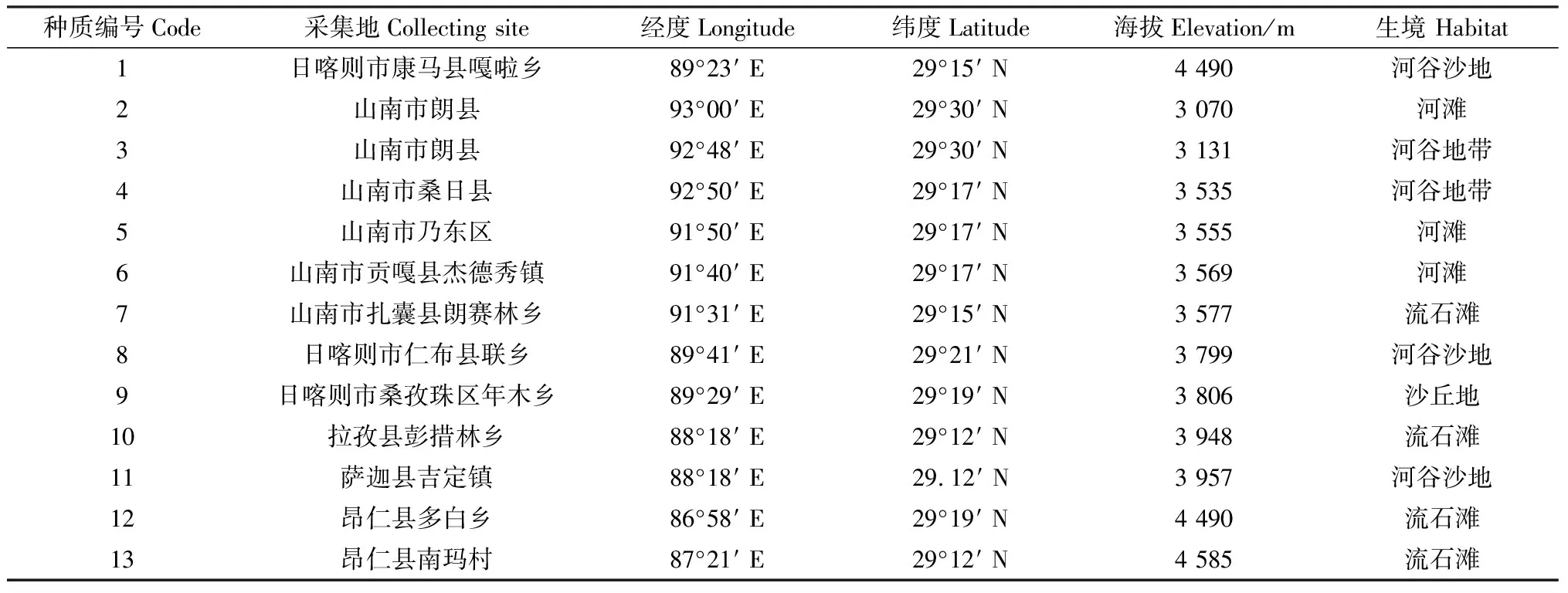
表1 藏沙蒿种质资源表
1.2 试验设计
试验在甘肃农业大学草业学院生长室内进行,采用盆栽控水法。
将13份籽粒饱满均匀无缺损的藏沙蒿种子均匀撒播于装有等量经高温灭菌的蛭石、沙子和营养土(1∶1∶2混合)的塑料花盆(底径11.4 cm、口径21 cm、深12 cm)中,用环刀法测得土壤田间持水量为29.6%,每盆装基质1.6 kg,置于人工智能温室中发芽。待藏沙蒿幼苗真叶长出2片后间苗,每盆根据实验设计留长势基本一致的幼苗,每盆20株。温室温度为(25±2)℃,光照16 h,黑暗8 h,光强2 000 lx,相对湿度60%。控水梯度参考李素[13]对干旱胁迫生理响应的水分梯度划分方法并根据预实验结果加以改进,设计3个土壤水分胁迫处理(表2),每个处理3个重复。
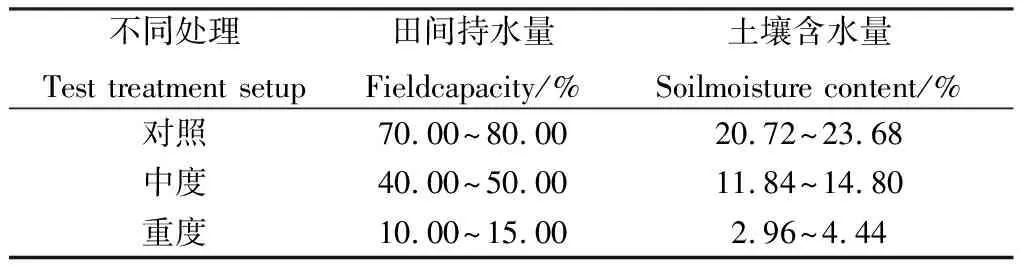
表2 干旱胁迫试验处理
待盆内藏沙蒿幼苗生长90 d后,进行干旱胁迫处理。试验前3 d对所有植株进行连续浇水处理,使每盆土壤处于饱和含水状态,CK每2 d补充定量水分至田间最大持水量的70%~80%,干旱处理自试验开始后不再浇水,待土壤水分自然消耗至设定的土壤含水量时,采用称重补水法进行控水,使各处理含水量维持在设定范围内。各处理在干旱胁迫30 d后将植株地上部分混合取样,每个处理3次生物学重复,测定各指标。
1.3 测定项目与方法
根冠比(Root shoot ratio,Rsr)和生物量(Biomass,Bio)采用烘干称重法测定;离体叶片失水速率(Rate of water loss of detached leaves,RWL)采用称重法测定[14];相对电导率(Relative conductivity,REC)采用电导率仪测定[15];丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸法测定[16];过氧化物酶(Peroxidase,POD)采用愈创木酚法测定[16];超氧化物歧化酶(Superoxide dismutase,SOD)采用氮蓝四唑还原法测定[16];过氧化氢酶(Catalase,CAT)采用高猛酸钾滴定法测定[16];可溶性糖含量(Soluble sugar,SS)采用蒽酮法测定[17];可溶性蛋白含量(Soluble protein,SP)采用考马斯亮蓝G-250测定[17];脯氨酸含量(Proline,Pro)采用茚三酮比色法测定[17]。
1.4 数据处理与分析
采用Microsoft Excel 2 010进行数据整理,SPSS19.0软件进行方差分析。抗旱性指标筛选采用Speorman相关性分析和主成分分析(PCA),Origin 2 021软件作图。
1.4.1抗旱性指标筛选 对测定指标分别进行单项指标抗旱系数值(DC)计算,公式如下:
抗旱系数[18]:
(1)
式中:Tj表示干旱处理j指标测定值的平均值;CKj表示对照处理j指标测定值的平均值;n为测定指标数,n=11
计算后得到的重度干旱胁迫下DC值用于主成分分析,通过主成分计算各综合指标因子权重系数(Wj),公式如下:
各指标权重[19]:
(2)
式中:Wj表示第j个指标在所有指标中的重要程度即权重,Vj表示经主成分分析所得各材料第j个指标的贡献率。
1.4.2抗旱性综合评价 抗旱性综合评价采用赋予权重法[19]。
藏沙蒿材料综合指标隶属函数值:
(3)
式中,X为藏沙蒿种质材料重度干旱胁迫下某一综合指标值,Xmax和Xmin分别为综合指标的最大值及最小值。
抗旱性综合评价值:
(4)
式中:D值为干旱胁迫下各指标评价所得的抗旱性综合评价值。
2 结果与分析
2.1 干旱胁迫对藏沙蒿种质材料生物量和根冠比的影响
干旱胁迫使藏沙蒿种质材料总生物量均呈不同程度的下降趋势(图1a)。CK处理下,13份藏沙蒿材料的平均单株生物量为0.17 g。中度干旱胁迫下,5号材料总生物量与其余各材料差异显著(P<0.05)。与CK相比,8号材料的总生物量降幅比其它材料更大(17.77%),1,2和13号材料降幅度较其它材料小,其中1号材料降幅最小为4.09%。重度干旱胁迫下,各材料总生物量减少49.58%~88.76%。不同材料根冠比随干旱胁迫程度的增加持续增大(图1b)。13份藏沙蒿材料的根冠比范围为0.15~0.38。中度干旱胁迫下,13,4和11号材料较CK分别增加了45.14%,32.47%和29.22%,5号材料增幅最少(2.49%)。重度干旱胁迫下,5号材料增幅最大为160.13%,与其余各材料差异显著(P<0.05),13和1材料次之,较对照分别增加了79.39%和72.85%(P<0.05),8号材料增幅最小,为18.50%。
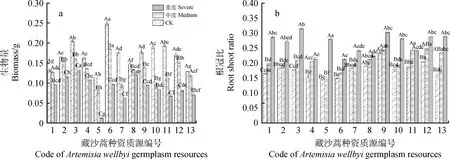
图1 干旱胁迫对藏沙蒿种质材料生物量和根冠比的影响
2.2 干旱胁迫对藏沙蒿种质材料离体叶片失水速率(Rate of water loss of detached leaves,RWL)的影响
13份藏沙蒿材料在不同程度干旱胁迫下的RWL差异性不一致(图2)。CK和中度条件下,8号材料离体叶片失水速率最高,分别为2.41 mg·h-1和1.75 mg·h-1,5号材料最低,分别为1.17 mg·h-1和0.83 mg·h-1;随着干旱胁迫的加剧,离体叶片失水速率逐渐降低,重度干旱胁迫下,失水速率排序为:4>3>8>6>1>9>10>12>11>5>13>7>2。在整个失水过程中,2,5和11号材料离体叶片失水速率较其它材料低,表现出较强的抗脱水能力。
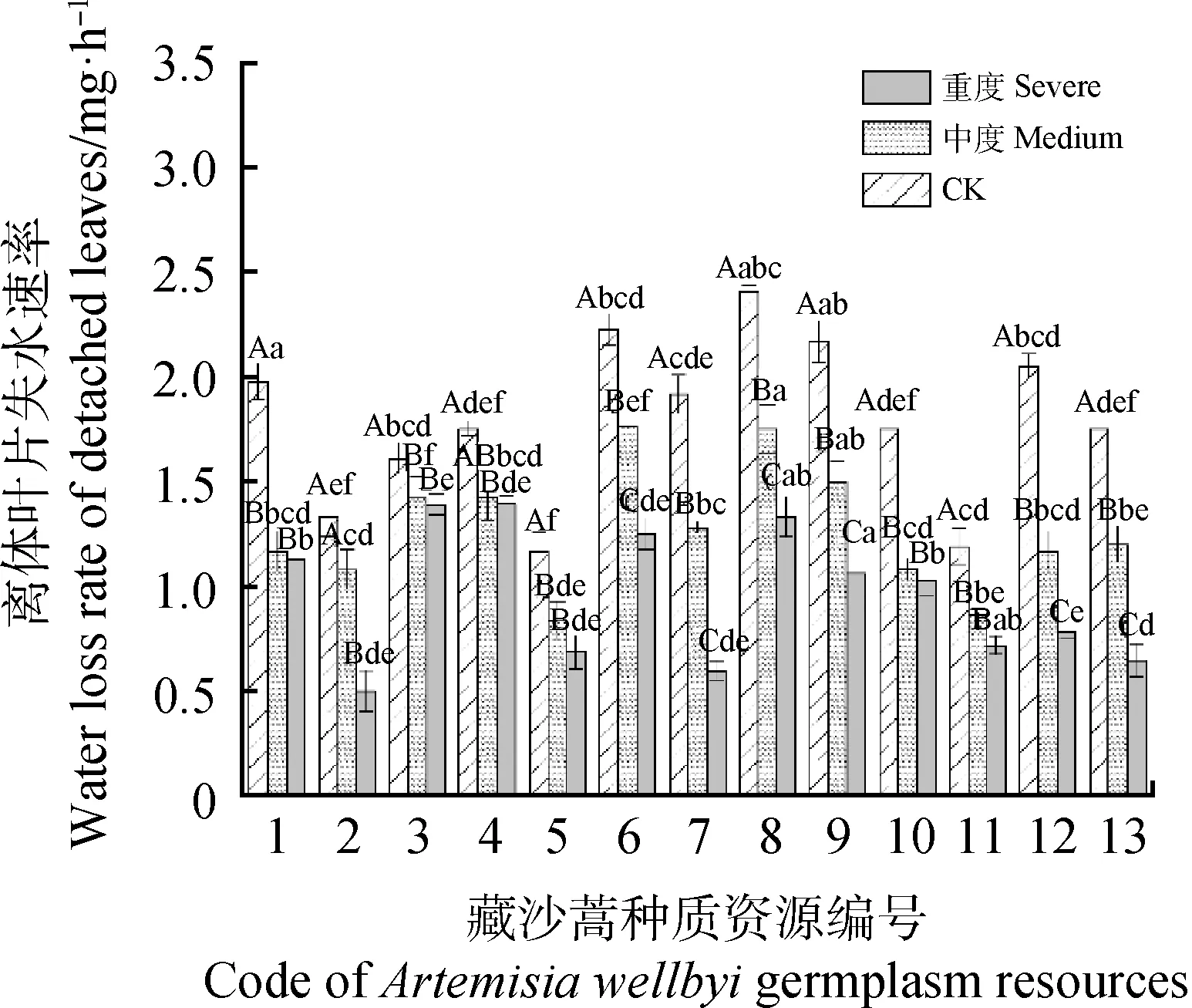
图2 干旱胁迫对藏沙蒿种质材料离体叶片失水速率的影响
2.3 干旱胁迫对藏沙蒿种质材料相对电导率(Relative conductivity,REC)和丙二醛(Malondialdehyde,MDA)含量的影响
干旱胁迫下,13份藏沙蒿材料的REC和MDA含量均较CK有所升高,并随干旱程度的增大呈上升趋势(图3a,3b)。中度干旱胁迫下,REC含量5号和13号材料与4号和6号材料差异不显著,与其余各材料差异显著(P<0.05),11号材料植物细胞内MDA含量与其它各材料差异显著(P<0.05)。其中,11号材料的REC最大,12号材料的MDA含量最高且增幅最大为121.40%;随着干旱程度增大到重度时,材料间的差距进一步增大。所有材料中,13号材料的REC较CK升高294.53%,4号材料较CK升高41.57%,可见胁迫对13号材料细胞膜的伤害最大,对4号材料的伤害不显著,7号材料的MDA含量高于其它材料,但增幅小于11号材料,13号材料最小为46.58%,由此可见,干旱胁迫会导致各藏沙蒿材料不同程度地积累MDA,对13号材料MDA的积累则没有明显促进作用。
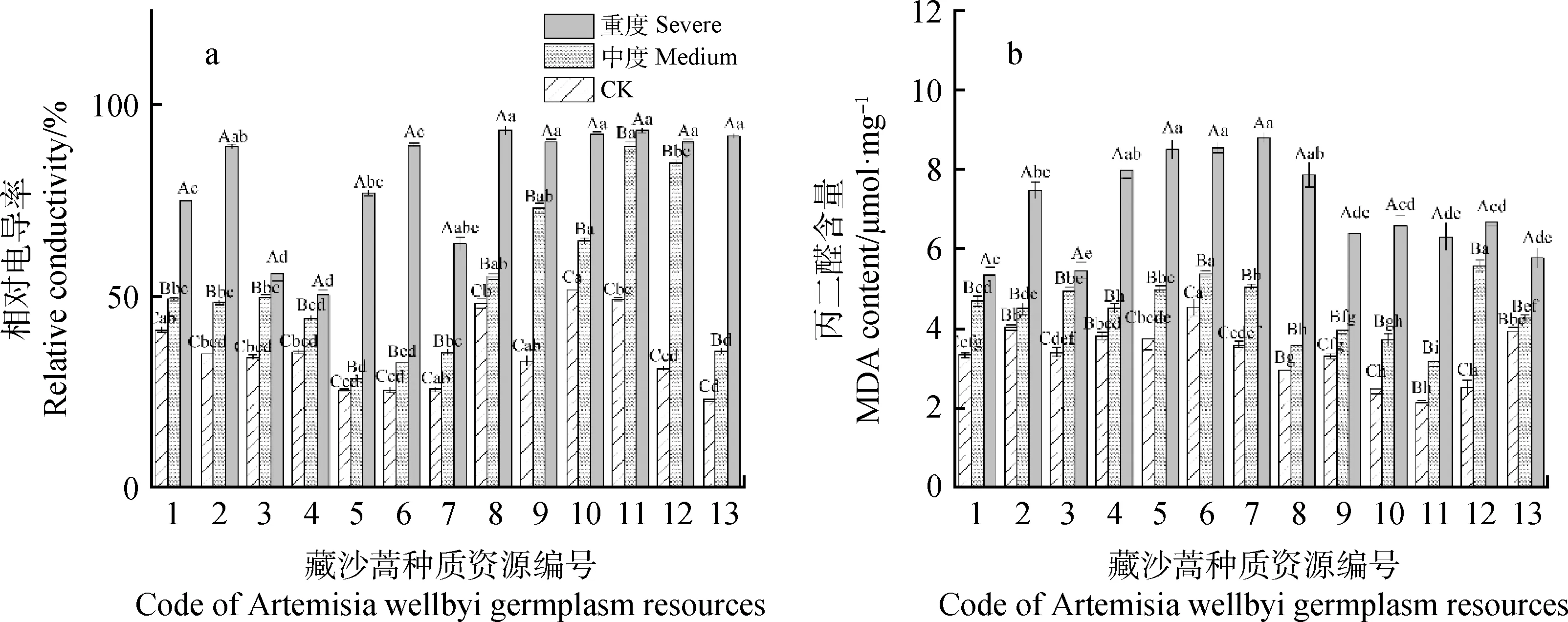
图3 干旱胁迫对藏沙蒿种质材料相对电导率和丙二醛含量的影响
2.4 干旱胁迫对藏沙蒿种质材料抗氧化酶活性和渗透调节物质的影响
干旱胁迫下,13份藏沙蒿材料的抗氧化酶活性和渗透调节物质呈现一定程度的变化。POD,SOD活性和Pro,SS含量均增加(图4a,4b,4d,4e),说明干旱胁迫在一定程度上造成藏沙蒿细胞膜脂过氧化及细胞液渗透压过大。中度干旱胁迫下,9号材料的POD活性最高且增幅最大(113.23%),与其余各材料差异显著(P<0.05),3号材料的SOD活性和SS含量最高,10号材料的Pro含量最高;随着干旱胁迫程度的进一步加剧,与各自的CK相比,13份种质的POD,SOD活性和Pro,SS含量均显著增加。在所有材料中,8号材料POD酶活性增幅最大(344.36%),3,4和11号材料SS含量显著高于其它材料,较CK分别增加16.01,17.75和21.10倍,9号材料增幅最小为2.84倍。11号材料的SOD酶活性和Pro含量增幅最大(379.78%,24.42倍)。CAT和SP含量不同材料之间存在差异性,5号材料在重度干旱胁迫下CAT酶活性较CK有所下降(61.72%),其余材料CAT酶活性均较CK有所升高,其中3号材料增幅最大为322.94%(图4c),SP含量,5,7和8号材料在中度干旱胁迫下先增加,随干旱程度进一步增加,SP含量又下降,12和13号材料则一直呈下降趋势(4f),可见5,7,8,12和13号材料对干旱胁迫的膜系统抗氧化能力和细胞渗透调节能力弱于其它藏沙蒿材料。
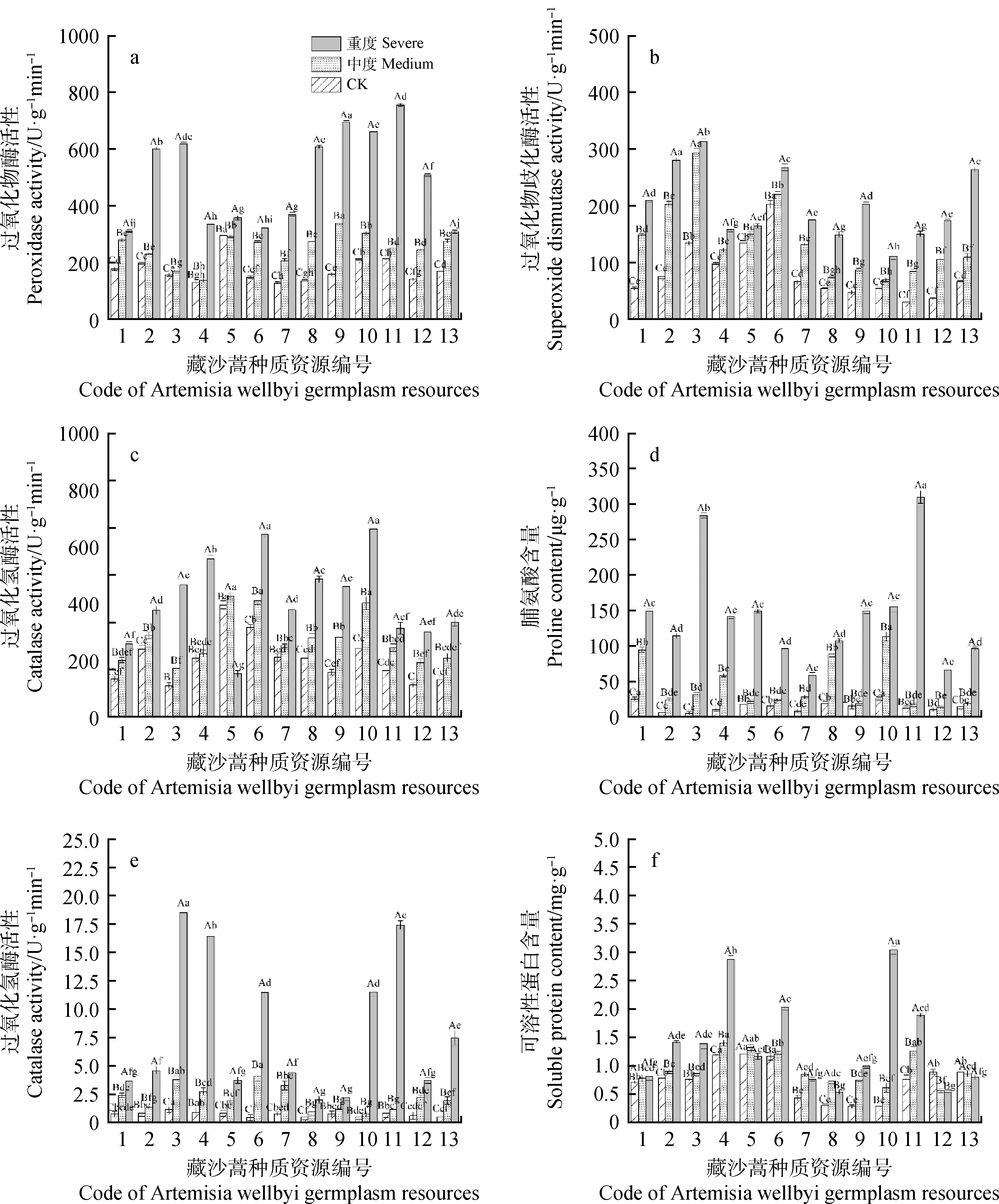
图4 干旱胁迫对藏沙蒿种质材料抗氧化酶活性和渗透调节物质的影响
2.5 藏沙蒿种质材料各指标相关性分析
对13份藏沙蒿种质材料的11项指标在3个不同程度干旱胁迫下的测定值均赋相同权重1,进行Spearman相关性分析(图5)。结果表明,MDA与Pro和POD,CAT与SP和Rsr,SOD与REC和RWL呈显著相关(P<0.05),其中MDA和POD呈正相关且相关系数最大为0.69,MDA与Pro,CAT与Rsr,SOD与REC以及RWL均呈负相关。REC和POD相关系数为0.76,相关性达到极显著水平(P<0.01)。从相关性分析可知,各指标耐旱信息有重叠,需要进一步对11项观测指标进行主成分分析以确保评价结果更加准确可靠。
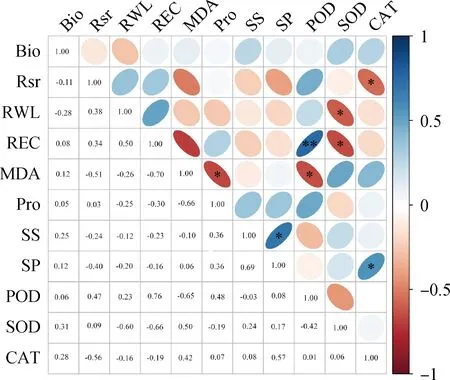
图5 干旱胁迫下13份藏沙蒿材料各指标间相关系数
2.6 藏沙蒿各种质材料单项指标的主成分分析
对13份藏沙蒿种质材料的11项观测指标进行主成分分析(表3),前5个成分的累计贡献率达到86.341%,具有较好的代表性,可作为藏沙蒿苗期抗旱性评价的综合指标。第一个主成分中载荷较大的是POD和CAT,载荷数分别为0.765和0.820,其特征向量反映了干旱胁迫下藏沙蒿幼苗的抗氧化酶活性,其活性越高,藏沙蒿受到的损害就越小。第二个主成分中载荷最大的是Rsr和RWL,载荷数为0.586和0.739,主要反映了藏沙蒿幼苗的生长特性和水分利用状况,因此Rsr和RWL是评价藏沙蒿抗旱性的两个重要指标。第三个主成分对应特征向量中载荷最大的是MDA和SP,载荷数为0.842和0.674,第四个主成分对应特征向量中载荷最大的是REC和SS,载荷数为0.520和0.595。第三和第四主成分的特征向量反映了藏沙蒿幼苗的细胞膜损伤程度、质膜相对透性和渗透调节特性。说明藏沙蒿幼苗的抗旱性与细胞膜损伤程度、质膜相对透性和渗透调节特性密切相关。第五个主成分对应特征向量中载荷最大的是Pro和SOD,载荷数为0.511和0.330,主要反映了干旱胁迫下藏沙蒿幼苗的渗透调节能力和抗氧化酶活性。综合来看,藏沙蒿的生长特性、水分利用状况、质膜相对透性、抗氧化酶活性以及渗透调节物质可作为藏沙蒿苗期抗旱性评价的综合指标。
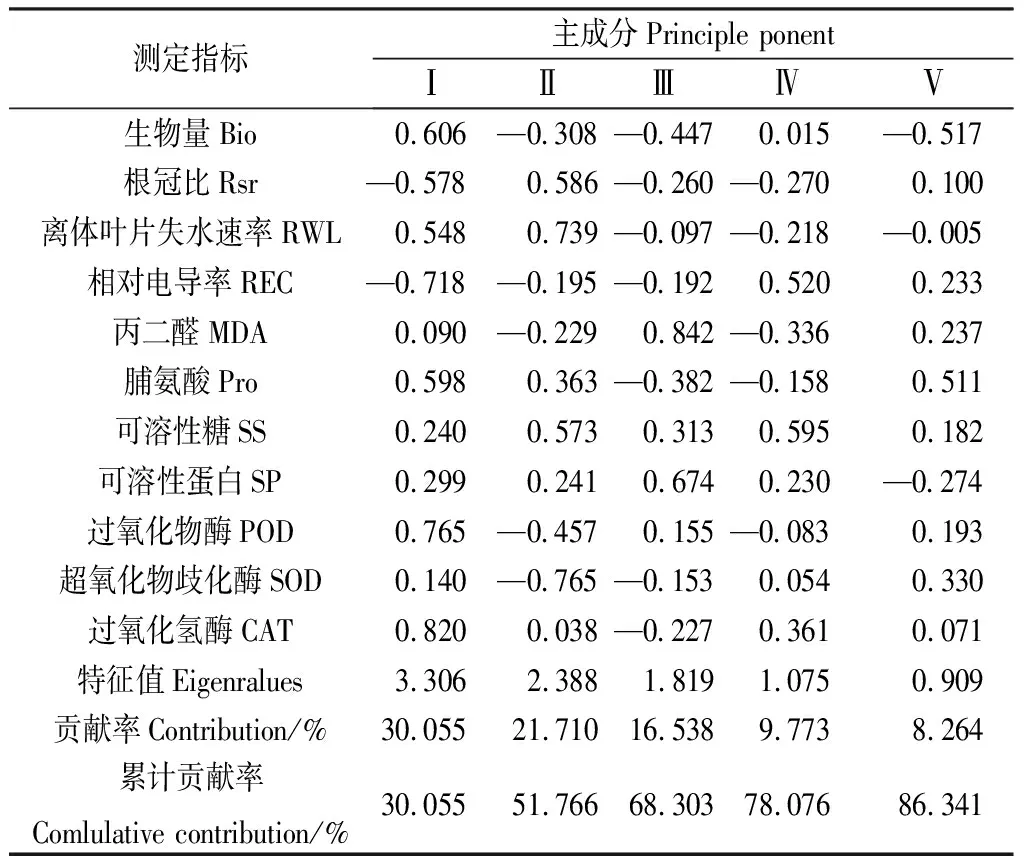
表3 各因子载荷矩阵及贡献率
2.7 藏沙蒿各种质材料抗旱性综合评价
采用主成分分析和隶属函数相结合的方法对藏沙蒿材料抗旱性进行综合评价。首先根据1.4.1中的公式(2)计算出5个综合指标因子的权重系数()分别为0.348,0.251,0.192,0.133和0.096。再依据1.4.2中的公式(3)计算各综合指标的隶属函数值μ(x)(表4),最后依据公式(4)计算抗旱性综合评价值(D),从表5可知,13份藏沙蒿材料抗旱性排序为:11>10>3>4>5>12>9>8>7>13>2>1>6。
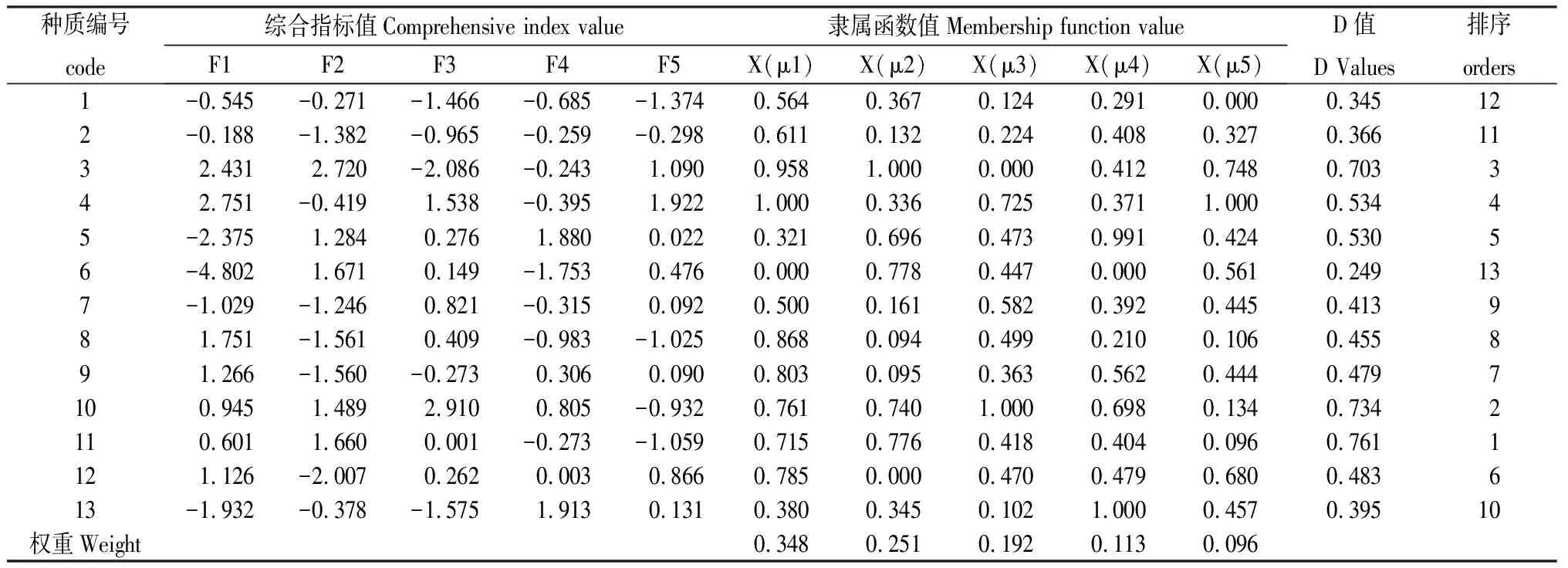
表4 13 份藏沙蒿材料苗期各综合指标值、权重、隶属函数值、D值及综合评价
2.8 藏沙蒿苗期抗旱性聚类分析
对供试藏沙蒿材料的抗旱性综合评价值D进行系统聚类,在欧氏距离为0.25时,可将13份藏沙蒿材料分为4个抗旱类型(图6),第一类为强抗旱型(0.703≤D≤0.761),包括3,10和11号材料,第二类为中度抗旱型(0.455≤D≤0.534),包括4,5,8,9和12号材料,占总数的38.46%。第三类为弱抗旱型材料(0.345≤D≤0.413),包括1,2,7和13号材料,占总数的30.77%。第四类6号材料单为一类,为抗旱敏感型材料,其抗旱性综合评价值D为0.249。
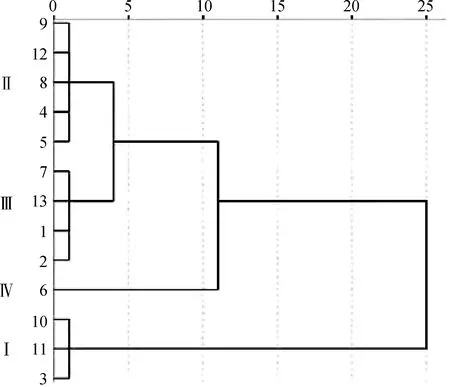
图6 13份藏沙蒿材料苗期抗旱性聚类分析
3 讨论
植物的干旱适应能力与其地上/地下生物量的分配密切相关[21]。本研究发现,随着干旱胁迫程度的增加,各材料总生物量降低,根冠比增加,说明藏沙蒿通过降低地上部分营养分配比重,增加地下部分的营养分配比重来应对干旱。就不同种质而言,在中度干旱胁迫下,5号材料根冠比增幅最少,但随着干旱程度的进一步增强,在重度干旱胁迫下,其根冠比增幅达到最大且与各材料差异显著,说明在干旱环境中,5号材料对干旱的适应性更强。离体叶片失水速率是反映植物叶片原生质抗脱水能力的重要指标[22-23],一般认为,抗旱性强的植物其叶片能够维持较低的离体叶片失水速率[24]。不同藏沙蒿材料离体叶片失水速率不一致,说明其叶片抗脱水能力存在差异。在整个干旱胁迫过程中,11号材料离体叶片失水速率较低,2号和7号材料在中度干旱胁迫下能够维持较低的离体叶片失水速率,但在重度干旱胁迫下其离体叶片失水速率降幅很大,这有可能是土壤水分亏缺超出了植物叶片水分调节能力的限度,与最终抗旱性综合评价的结果一致,说明植物的抗旱性与水分状况密切相关,且主成分分析中离体叶片失水速率载荷数较大并为第二主成分,表明RWL是反应植物抗旱性的重要指标。
本研究中,干旱胁迫使供试藏沙蒿材料的REC及MDA含量均增大。而在4号和5号材料中,干旱对REC的影响较小,对6,9,12和13号材料的REC的影响较大,说明4号和5号材料的细胞膜损伤轻微,6,9,12和13号材料细胞膜的膜脂过氧化程度较重。当植物遭受干旱胁迫时,体内会产生大量的活性氧自由基,引起氧化胁迫,使细胞膜透性增大[25]。植物细胞膜透性以及损害程度可由相对电导率反映[26],而细胞膜透性损害会导致细胞内容物外渗,进一步引起丙二醛含量增加。干旱胁迫显著增加了5,7,8,11和12号材料MDA含量,而对13号材料影响较小,因此,对13号材料来说,苗期干旱胁迫的膜脂过氧化程度较轻。这与樊仙等[27]对甘蔗研究以及王平等[9]对披碱草属牧草的研究结果一致。在长期干旱胁迫条件下,活性氧(ROS)产生过多并造成氧化损伤,为了避免自身受到伤害,体内的抗氧化酶POD、CAT与SOD协同作用使活性氧维持在较低水平[28]。本研究发现SOD和POD酶活性与干旱胁迫程度表现为正相关,这与邹苗等研究结果一致[29];而白旭瑞[30]研究小麦的POD呈现出不同的趋势,可能是小麦各酶活性对干旱的表达时期有所不同。也有研究表明随着胁迫程度的增大,SOD,POD和CAT酶活性呈现先上升后下降的趋势,可能是干旱胁迫程度超过了植物的耐受范围[31]。本研究中,干旱胁迫初期,所有材料的抗氧化酶活性均升高,但与之不同的是,随着干旱胁迫程度的加剧,5号材料CAT酶活性较CK有所下降,表明5号材料对干旱胁迫的膜系统抗氧化能力弱于其它材料。本研究中,干旱胁迫改变了供试藏沙蒿材料的渗透调节物质含量,SS和Pro较CK均上升,SP含量不同材料存在差异性,说明藏沙蒿可以通过增加渗透调节物质来提高应对干旱的能力,这与对燕麦和栓皮栎等研究结果一致[31,32]。SS,SP和Pro为植物体内重要的渗透调节物质[33],植物在干旱胁迫下主动积累细胞溶质,使渗透势降低,从而提高细胞保水力,保持细胞膨压,保证正常生长[34]。干旱胁迫导致藏沙蒿幼苗SS和Pro含量增加,3号和10号材料SS和Pro含量都有较大的增加,另外,5,7和8号材料SP含量在中度干旱胁迫下先增加,随干旱程度进一步增加,SP含量又下降,12和13号材料SP含量随干旱胁迫程度的增加呈下降趋势。这表明3号和10号材料渗透调节能力强于其它材料,5,7,8,12和13号材料的渗透调节能力弱于其它材料。藏沙蒿叶片中SOD,POD以及SS和Pro含量的增加,以去除超氧化物自由基并调控干旱胁迫条件下膜脂质过氧化的水平,这也是藏沙蒿对水分亏缺的一种适应策略。
植物的抗旱性是由多种基因控制的且相互作用而形成的复杂的综合性状。不同植物对干旱的适应方式不同,以单一指标评价植物抗旱性具有一定局限性,不能准确反映其真实抗旱能力,应用多个指标进行综合评价[35]。但是,鉴定植物抗旱性的生理指标较多,且不同指标之间存在一定相关性。隶属函数法采用多个指标进行综合评价,但由于不同指标之间存在相关性,致使耐旱信息有重叠。主成分分析将多个指标整合成几个较少的综合指标且这些综合指标之间不存在相关性,可以从原有的多个与植物抗旱性相关的指标中反映出整体的信息,也有采用多个抗旱生理指标、多种评价方法综合评价植物的抗旱性研究[19,36-37]。本研究在此基础上通过主成分分析法将13份藏沙蒿材料各单项指标的抗旱系数转换成5个相互独立的综合指标,隶属函数法计算各综合指标隶属函数值μ(x),进一步结合权重计算抗旱性综合评价值(D)鉴定其抗旱性,增强了研究结果的准确性。
4 结论
通过主成分分析和隶属函数相结合的方法对干旱胁迫下13份藏沙蒿幼苗种质材料的11个与抗旱相关的生长和生理指标进行综合评价,根据抗旱性综合评价值(D)对13份藏沙蒿材料幼苗的抗旱性由强到弱进行排序,结果为11>10>3>4>5>12>9>8>7>13>2>1>6。运用聚类分析法对13份藏沙蒿材料的D值进行聚类分析,可将供试材料抗旱性划分为 4个类型,包括强抗旱型3份材料,中度抗旱型5份材料,弱抗旱型 4份材料和抗旱敏感型材料1份。建议11,10和3号藏沙蒿材料作为西藏高寒荒漠草地生态恢复和育种研究的首选材料。
