低磷胁迫对红豆草光合、叶绿素荧光及内源激素的影响
2023-02-10南丽丽何海鹏姚宇恒
陈 洁,南丽丽,汪 堃,夏 静,何海鹏,马 彪,姚宇恒
(甘肃农业大学草业学院/草业生态系统教育部重点实验室,甘肃 兰州 730070)
磷是植物生长必需的营养元素,在植物细胞的伸长和分裂,能量代谢、细胞膜的合成等方面起着重要作用[1]。土壤中磷含量大,但磷酸盐离子易与金属离子结合,植物无法直接吸收利用,限制其生长发育[2]。生产中增施磷肥能提高产量,但大量施用磷肥会造成土壤污染、水体富营养化,给生态系统带来危害[3]。
光合作用是植物物质能量来源的关键代谢过程[4],其效率体现植物的各种生理状况,在逆境下,植物抗逆性和生长状况会发生变化,光合效率会随之变化[5]。低磷胁迫限制植物干物质积累的主要原因是叶片光合速率下降[6]。有研究表明,缺磷能降低植物叶片的净光合速率、气孔导度及叶绿素含量,导致光合作用的减弱[7-9],叶绿素参数的变化体现植物叶片光合作用的CO2同化、原初反应和电子传递过程,表现植物对光能的吸收、传递、分配和消耗等特点[10-11]。研究发现,在低磷胁迫下,玉米(Zeamays)叶片叶绿素荧光参数(FV/FM)、PSⅡ的光能转换和利用效率均降低[8,12];在磷铝胁迫下,杉木(Cunninghamialanceolata)幼苗会降低PSⅡ反应中心的光化学活性和电子传递效率,降低植物对光能的利用率,最终抑制植物生长[5]。
植物内源激素是广泛存在于植物体内调控自身生理代谢的活性物质,不仅影响植物生长发育,而且在植物逆境胁迫中起调控作用,主要包括脱落酸(Abscisic acid,ABA),生长素(Auxin,IAA),赤霉素(Gibberellin,GA3),细胞分裂素(Cytokinin,CTK)、乙烯(Ethylene,ET)、独角金内酯等(Strigolactones,SLs)[4,13]。植物在逆境胁迫条件下,一般通过体内激素的变化来适应养分缺乏的环境[14]。研究表明,随着供磷水平的降低,大麦(Hordeumvulgare)根和叶中CTK含量减小,IAA含量增加,在胁迫初期GA3含量增幅比较大,ABA变化不明显[15],陈洁等[16]研究发现不同磷利用效率自交系玉米的内源激素含量在低磷胁迫下表现出规律性变化,如IAA,ABA和GA3含量均增加,而ZT含量下降,因此,内源激素含量变化可作为鉴定玉米自交系磷高效的参考指标。符云鹏等[17]研究表明,在低磷胁迫下,烟草(Nicotianatabacum)根系活力活性降低,CTK含量减少,根和叶中IAA含量增加。陈智裕等[18]研究发现,在低磷条件下,磷低效杉木幼苗叶片内IAA和ZT含量显著高于磷高效的杉木幼苗,与常磷相比较,不供磷条件下根系内ZT含量显著降低,IAA和ABA含量则显著增加,磷高效的杉木幼苗根系ABA含量显著高于磷低效幼苗根系的任意供磷水平。
红豆草(Onobrychisviciaefolia)是多年生豆科草本植物,具有耐寒、抗旱、耐贫瘠、适口性好等优点,含有丰富的蛋白质、粗脂肪、氨基酸、单宁、钙和磷含量[19-20]。目前有关低磷胁迫对红豆草内源激素含量变化的研究少见报道。因此,本研究以磷敏感和耐低磷红豆草为试验材料,对低磷胁迫下红豆草光合作用、叶绿素荧光参数和内源激素含量变化规律进行探讨,揭示红豆草对低磷胁迫逆境响应的调控机制,为选育耐低磷红豆草品种、提高红豆草抗性提供理论依据。
1 材料与方法
1.1 试验材料
以前期筛选出来的耐低磷红豆草5号和磷敏感红豆草1号为试验材料,由农业部全国畜牧兽医总站牧草种质资源搜集保护项目协作组从俄罗斯瓦维洛夫植物基因库引进[21]。
1.2 试验设计
试验于2021年3月24日在甘肃农业大学植物生长室进行,选用消毒后的细沙(121℃,高温灭菌30 min)1 000 g装入花盆中(外口径、内口径、高和底径分别为13.2 cm,12 cm,14 cm和9.2 cm),经HgCl2消毒后的种子均匀撒播于花盆中,并覆沙3~4 cm,出苗后进行间苗,每盆保留生长一致、分布均匀的幼苗15株,每2 d浇灌150 mL Hoagland营养液,待幼苗生长至第60 d进行胁迫处理,用KCl平衡调整K+。采用两因素试验设计,因素A为2份红豆草材料,因素B为磷胁迫处理,即常磷处理(1.00 mmol·L-1KH2PO4,NP)和低磷处理(0.01 mmol·L-1KH2PO4,LP)[22],分别在处理0 d,6 d,12 d,18 d,24 d后测定株高、叶面积、叶绿素含量、光合作用和叶绿素荧光,并在处理0 d,12 d和24 d后分别采样,测定叶片和根系内源激素含量。
1.3 测定指标及方法
1.3.1形态指标测定 株高(Plant height,PH)采用卷尺测量;叶面积(Leaf area,LA)采用LI-3000C叶面积仪测定,取从植株顶端依次向下数的第3个叶片,每个处理重复10次。
1.3.2叶绿素含量测定 称取0.5 g新鲜叶片,放入装有 2 mL无水乙醇和 2 mL 80% 丙酮离心管中,然后在 4℃培养箱避光保存24 h提取叶绿素,参考邹琦[22]的实验方法,测定叶绿素a(Chlorophyll a,Chl a)、叶绿素b(Chlorophyll b,Chl b)、叶绿体色素(Chlorophyll pigment,Cp)含量,每个处理3个重复。
1.3.3光合参数测定 光合参数采用LI-6400便携式光合仪(LI-COR,USA)测定,仪器为开放式气路,空气CO2浓度为400 μmol·mol-1,设定光合有效辐射强度为1200 μmol·m-2·s-1,每株选取中上部3片叶,测定叶片气孔导度(Stomatal conductance,Gs)、胞间CO2浓度(Intercellular carbon dioxide concentration,Ci)、净光合速率(Net photosynthetic rate,Pn)和蒸腾速率(Transpiration rate,Tr)等叶片气体交换参数,瞬时水分利用效率(Water use efficiency,WUE)=Pn/Tr,每个处理3个重复。
1.3.4叶绿素荧光测定 于晴天9∶00—11∶00,采用便携式叶绿素荧光仪PAM-2100 对叶片进行测定。测定时,选择测定光合指标的叶片,黑暗环境适应20 min,参考张翠梅等[23]方法测定并计算PSⅡ最大光合效率(PSⅡ maximum photochemical efficiency,Fv/Fm),PSⅡ潜在光化学效率(PSⅡ potential activity,Fv/Fo),PSⅡ光化学量子产量Yield,表观电子传递效率ETR,光化学淬灭系数(Photochemical quenching,qP)和非光化学淬灭系数(Non-photochemical quenching coefficient,qN),每个处理3个重复。
1.3.5内源激素测定 采样后将样品用液氮速冻,存放于超低温冰箱。测定时参考汪堃等[24]的方法,将冻样研碎,加预冷的80%的色谱甲醇,浸提24 h并离心,吸取上清液,浓缩近干,用50%的甲醇冲洗蒸发瓶瓶壁,最后定容至10 mL,过0.22 μm滤膜,于四元梯度超快速液相色谱仪Waters Arc-2998 PDA Waters(沃特世公司,美国)进样,测定根系和叶片的IAA,GA3,ABA和ZT含量,每个处理重复3次。
1.4 数据统计分析
用Excel 2019处理数据。分别计算1号和5号材料的株高、叶面积、Chl a,Chl b,Cp,Gs,Ci,Pn,Tr,WUE,Fv/Fm,Fv/Fo,Yield,ETR,qP,qN和地上、地下部IAA,GA3,ABA和ZT的耐低磷系数,即耐低磷系数=低磷处理下性状测得值/常磷处理下性状测得值[21],相对值可消除材料间固有的差异,能准确反映不同材料耐低磷性。
2 结果与分析
2.1 低磷胁迫对红豆草形态指标和叶绿素含量的影响
由表1可知,低磷胁迫下,耐低磷5号和磷敏感1号红豆草材料的PH和LA的耐低磷系数呈下降趋势,其变化范围分别为0.889~0.998和0.909~0.994,0.679~1.025和0.729~0.954;5号和1号的Chl a,Chl b和Cp耐低磷系数变化范围分别是0.669~1.095和0.618~1.008,0.767~0.988和0.671~1.269,0.700~1.058和0.635~1.053,随着胁迫天数的延长,耐低磷系数降低,表明在低磷胁迫下,2份供试材料的叶绿素含量均降低。

表1 低磷胁迫对红豆草形态指标和叶绿素含量耐低磷系数的影响
2.2 低磷胁迫对红豆草光合生理指标的影响
由表2可知,5号和1号材料Tr,Gs,Pn的耐低磷系数随着胁迫时间的延长而降低,变化范围为0.540~1.008和0.578~0.986,0.561~1.053和0.601~0.952,0.613~0.948和0.641~1.019,表明两份材料通过闭合叶片部分气孔,抑制CO2的获取,减少水分蒸发和降低Gs来适应逆境胁迫。WUE是植物对胁迫环境的自我保护机制[25],随着低磷胁迫时间的延长,2份供试材料的Ci和WUE耐低磷系数增大,在胁迫24 d时,耐低磷5号材料的WUE较磷敏感1号材料大,表明胁迫时间越长,5号红豆草适应能力更强。

表2 低磷胁迫对红豆草光合生理指标耐低磷系数的影响
2.3 低磷胁迫对红豆草叶绿素荧光参数的影响
由表3可知,5号和1号红豆草的Yield,qP,ETR,Fv/Fo,Fv/Fm的耐低磷系数均随着胁迫天数的延长而降低,其变化范围分别为0.548~1.039和0.513~1.038,0.692~0.965和0.784~0.988,0.518~1.027和0.470~0.972,0.577~1.205和0.519~1.100,0.801~1.067和0.759~1.043,表明两份材料PSⅡ反应中心的开放程度变小,光合电子传递速率变慢,光化学效率降低,植物体内发生了光合作用的光抑制现象[25];qN的耐低磷系数的变化范围是0.970~1.417,除低磷胁迫0 d外,2份供试材料qN耐低磷系数均大于1,表明以热形式耗散掉的能量随着胁迫的加剧而增多,且磷敏感1号材料qN大于耐低磷5号材料,表明1号材料较5号材料耗散的能量多。

表3 低磷胁迫对红豆草叶绿素荧光参数耐低磷系数的影响
2.4 低磷胁迫对红豆草内源激素含量及其比值的影响
由表4可知,耐低磷5号红豆草和磷敏感1号红豆草地上部ZT耐低磷系数的变化范围分别是0.704~1.032和0.536~0.974,地下部变化范围分别是0.989~1.712和0.939~1.536,GA3地上部耐低磷系数的变化范围分别为0.467~0.923和0.564~1.033,地下部变化范围分别是1.033~1.596和1.047~1.392,ZT和GA3地上部耐低磷系数随着磷胁迫时间的延长而降低,而地下部相反;IAA地上部的变化范围分别是0.620~1.014和0.544~1.061,地下部变化范围分别是0.712~1.252和0.644~1.309,IAA耐低磷系数随着磷胁迫的加剧减小,地下部表现为先增加后降低趋势,表明低磷胁迫抑制两份材料IAA的合成;ABA地上部的耐低磷系数分别是1.025~1.291和1.061~1.206,地下部变化范围分别为1.046~1.346和1.075~1.251,低磷胁迫下,地上和地下部ABA表现为升高趋势,ABA具有抑制植物生长的作用,在低磷胁迫下,2份供试材料的生长均受到抑制,胁迫24 d时,5号材料地上和地下部ZT,IAA和ABA耐低磷系数均大于1号材料。
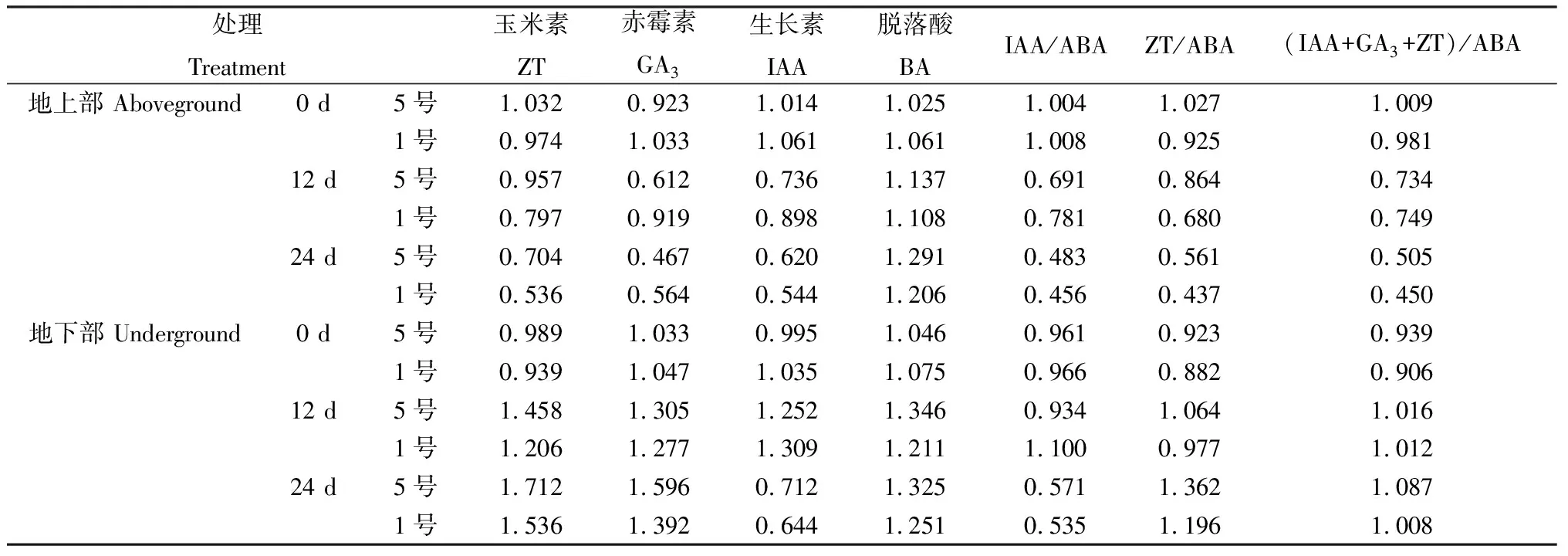
表4 低磷胁迫对红豆草内源激素及其比例耐低磷系数的影响
2份供试材料的IAA/ABA的耐低磷系数随着磷胁迫天数的增加而下降,且5号材料耐低磷系数大,在低磷胁迫下,耐低磷5号材料和磷敏感1号红豆草地上部ZT/ABA的耐低磷系数下降,地下部系数上升,表明在低磷胁迫下,两份材料叶部ABA含量积累速度更快,而地下部ZT含量占优势;(IAA+GA3+ZT)/ABA耐低磷系数的变化范围是0.450~1.009和0.906~1.087,地上部的变化为降低趋势,地下部表现为增加,且5号比1号耐低磷系数大。
2.5 性状的相关性分析
由表5可知,各指标间均存在相关性,但其显著性不同。Chl a,Chl b与光合作用和株高呈显著或极显著相关,除Ci,WUE和qN外,ABA与Pn,Gs,Tr呈负相关,IAA与光合指标和叶绿素荧光呈显著正相关,ZT、GA3与光合和叶绿素荧光呈正相关,光合作用与叶绿素荧光呈显著或极显著相关。

表5 低磷胁迫下各指标的相关性分析
3 讨论
3.1 低磷胁迫对红豆草形态指标、光合作用和叶绿素荧光的影响
磷是植物生长发育不可缺少的营养元素,可参与植物发生一系列生理生化过程[26],本研究中,低磷胁迫下5号和1号红豆草的株高和叶面积均明显受到抑制,表明缺磷会抑制植物的正常生长,这与董秋平等[27]、任立飞等[29]对大豆和玉米的研究结果一致。
叶绿素是参与植物光合作用的色素分子,起到摄取外界光源的作用,参与光合作用中光能的吸收、传递和转化[29]。本研究中,在低磷胁迫下,5号和1号红豆草Chl a,Chl b,Cp含量的耐低磷系数均呈降低趋势,其胁迫时间越长,降幅越大,且磷敏感材料1号的叶绿素含量降幅较大,表明较低的磷供应量导致红豆草叶片叶绿素合成降低,光合作用无法充分进行,体内物质累积减少[12]。低磷胁迫会破坏植物叶肉细胞,关闭部分气孔,抑制与光合反应相关的酶活性,降低植物光合速率[12]。叶绿素含量与植物光合速率在一定范围内成正相关,其含量的高低可直接体现植物叶片的光合能力[30]。本研究发现,低磷胁迫下,2份供试红豆草的Pn,Tr,Gs的耐低磷系数均下降,且随着胁迫程度的加剧,降幅显著增大,因为缺磷环境降低红豆草幼苗体内的磷素积累,导致叶片中光合色素和光合过程中相关酶的分配减少,从而降低植物光合速率,胁迫24 d时,耐低磷5号材料的Pn,Tr,Gs耐低磷系数均小于磷敏感1号材料;WUE反映了植物对水分的利用情况,其值大小能直接体现植物对环境的适应[25],在本试验中,低磷胁迫下,2份红豆草均通过提高WUE来适应低磷胁迫。
本研究中,在低磷胁迫下,耐低磷5号红豆草和磷敏感1号红豆草的Yield,qP,ETR,Fv/Fo和Fv/Fm的耐低磷系数均下降,qP能反映PSⅡ反应中心的开放程度[27],低磷胁迫时间越长,PSⅡ反应中心开放的比例越小,传递的电子数量越少,同时在单位时间内,光合电子传递速率越慢[31],Fv/Fo和Fv/Fm耐低磷系数随着胁迫天数的增加而减小,且5号材料较1号降幅小,说明1号光能吸收转化机构的完整性遭受更严重的破坏,影响光化学效率[5]。在本研究中,qN耐低磷系数随着胁迫天数的增加而增加,耐低磷5号材料qN较磷敏感1号小,因为qN是植物抵御过量光能伤害,保护光合机构而形成的机制,反映了PSⅡ天线色素吸收而没有被用于光化学反应,表明1号红豆草以热的形式耗散掉的能量更多[27,32]。
3.2 低磷胁迫对红豆草内源激素含量的影响
内源激素作为植物体内微量活性物质,含量较低,参与调节植物体内多种生理过程[33],不同内源激素之间协同或拮抗是调控植物适应逆境胁迫时的重要生理过程[34]。吴爱萍等[35]研究表明,在低磷条件下植物激素直接参与植物生长、发育的调控;惠乾龙等[36]研究表明,低磷胁迫下,植物体内GA3与ABA的合成、积累会显著增加,因植物在遭受低磷胁迫时,会诱导转录因子来刺激GA3合成;ABA会影响磷酸信号传导通路,从而影响植物本身的磷吸收[37],在拟南芥[38]、玉米[39]等作物中,低磷处理使植物的CTK含量显著下降。本研究发现,随着低磷胁迫时间延长,耐低磷5号红豆草和磷敏感1号红豆草地上部IAA的耐低磷系数随着磷胁迫的加剧减小,地下部表现为先增加后降低,且磷敏感1号红豆草降幅显著,这可能是因为IAA响应基因表达量在低磷情况下普遍下调[37],而磷敏感红豆草更易感知外界变化,故1号材料变化更显著。GA3能够促进细胞生长以及叶和根的发育,可通过影响根细胞的伸长来促进植物根系生长[40],本研究中,随磷胁迫的加剧,各供试材料地下部GA3耐低磷系数随着磷胁迫时间的延长而增高,可能是GA3作为植物生长的负调控信号,减缓植物生长,以此减缓逆境伤害[24]。地上和地下部ABA耐低磷系数均随着胁迫程度的加剧而增高,且耐低磷5号材料的增幅大,这是因为ABA调控气孔开闭和光合产物运输,诱导抗逆系统的启动和表达,低磷处理促进ABA的合成与积累[41],两份供试红豆草地上和地下部的ZT含量均呈现增加趋势,ZT作为CTK的一种,可能在适应低磷胁迫的过程中对植物发挥正调控作用,因此低磷胁迫下植物根系ZT的含量会显著上升。
各激素间含量的平衡在细胞体积增大、分裂增殖和营养物质充实等过程中发挥着重要的作用[42]。IAA/ABA,ZT/ABA,(ZT+IAA+GA3)/ABA比值能体现植物的生长发育状况[43]。王得运等[44]研究表明栀子(GardeniajasminoidesEllis)在遭受胁迫后IAA/ABA,ZT/ABA比值随着胁迫时间增加而逐渐下降,并且降幅较大。在本研究中,耐低磷5号红豆草和磷敏感1号红豆草地上部IAA/ABA,GA3/ABA,(ZT+IAA+GA3)/ABA比值均随低磷胁迫时间增长呈降低趋势,遭受低磷胁迫后,ABA在器官衰老、叶片脱落的地上部大量合成,导致植物处于缓慢发育或休止状态[43];而地下部(ZT+IAA+GA3)/ABA的比值随着低磷胁迫时间增加而上升,在胁迫24 d时,5号材料地上和地下部ZT含量和IAA/ABA,GA3/ABA,(ZT+IAA+GA3)/ABA比值均大于1号材料,表明在磷胁迫下,5号红豆草积累ZT含量的能力较1号强。
3.3 低磷胁迫下各指标间的相关性
研究表明,ABA含量与气孔开度存在负相关关系[45],这与表3的相关性结果一致。贺凌霄等[46]研究发现ABA含量升高,Gs下降,植物净光合速率下降,导致植物碳同化速率降低,而ZT能够拮抗ABA诱导的气孔收缩,进而维持气孔开度,提高作物光合碳同化速率,因此,叶片气孔的开放程度取决于ABA与ZT的综合作用[46]。在本研究中,地上部ZT/ABA比值下降,说明低磷胁迫抑制叶片气孔开张,植物碳同化速率下降,导致植物光合作用降低,且1号材料的比值低于5号,表明5号材料的光合作用较强。表3中,Pn与Fv/Fo呈极显著正相关,可能是因为在低磷胁迫下,Fv/Fo耐低磷系数下降,光能吸收转化机构的完整性遭受破坏,光能转化效率下降,卡尔文循环中碳固定所需的化学能不足,叶绿体基质无法合成充足有机物,导致Pn下降[47]。
4 结论
低磷胁迫限制红豆草的正常生长。低磷胁迫下,耐低磷5号红豆草和磷敏感1号红豆草的株高和叶面积的生长明显受到抑制,Chl a,Chl b,Cp及Pn,叶绿素荧光参数、地上部GA3含量、地上IAA/ABA比值、地下部ZT/ABA,(IAA+GA3+ZT)/ABA比值均下降,而Ci,WUE,qN,地下部GA3含量、地上和地下部ZT,ABA含量、地上部ZT/ABA和地上(IAA+GA3+ZT)/ABA比值均呈上升,地上和地下部IAA含量和地下部IAA/ABA呈先增加后下降趋势,在低磷胁迫下,两份供试材料均通过降低水分蒸发和改变气孔导度、能量耗散来保护光合机构和调节植物体内激素含量来适应逆境。
