MALDI-TOF技术在重症肺炎痰液样本病原菌检测和鉴定中的应用
2023-02-10刘亚荣罗军李冰瑶
刘亚荣 罗军 李冰瑶
(1. 电子科技大学医学院附属绵阳医院,四川 绵阳 621000;2. 绵阳市中心医院医学检验科,四川 绵阳621000)
重症肺炎作为一种常见的急危重症,具有发病率高、病情进展迅速等特点,易危及患者生命安全[1]。重症肺炎多由毒力极强的革兰阳性或阴性菌感染所致,病情严重,进展迅速,常发生各种严重并发症,如不及时救治,可危及生命。因此,快速检测鉴定重症肺炎患者病原菌类型,以采取针对性抗生素治疗成为临床备受关注的问题[2]。传统的病原菌鉴定通常采用菌落形态、染色、显微镜检查、趋向性试验以及自动化鉴定仪等鉴定方法,但其操作过程繁琐、鉴定时间过长、主观性较强,不能及时提供病原学诊断结果。因此,寻找一种快速、可靠的病原菌鉴定方法对临床病原学诊断具有重要意义。基质辅助激光解吸电离飞行时间(Matrix-assisted laser desorption ionization-time of flight,MALDI-TOF)技术是近年来飞速发展起来的一种新型软电离质谱技术,主要用于微生物鉴定,MALDI-TOF技术主要原理是利用不同菌种核糖体蛋白大小存在差异,通过检测病原菌保守且独特的蛋白峰特征性质图谱,将检测所得图谱与已知菌种数据库参考图谱作对比,以得到病原菌鉴定结果[3,4]。该技术具有方便、快速、高通量、特征性强且实验成本较低等优点,已在微生物领域尤其是细菌鉴定中得到广泛运用[5]。然而目前该技术在肺炎痰液样本病原菌临床检测中应用研究较少,对此,本研究通过将MALDI-TOF技术与VITEK-2 Compact全自动微生物鉴定系统(VITEK 2 Compact automatic microbial analyze,VITEK-2)鉴定技术进行比较,以观察MALDI-TOF技术在重症肺炎痰液样本病原菌检测和鉴定中的实际应用效果,旨在为临床及时进行抗感染治疗提供有利参考,现将其过程整理报道如下。
1 资料与方法
1.1 一般资料
选取我院2021年7月至2021年12月收治的214例重症肺炎患者为研究对象,其中男126例,女88例;平均年龄44.17±11.62 岁;平均病程4.81±0.74 d。
纳入标准:诊断为重症肺炎患者[6];患者均进行痰液样本培养、检测;患者了解并愿参与此次研究。排除标准:恶性肿瘤患者;合并血液系统性疾病者;感染病患者。本研究经医学伦理委员会批准。
1.2 方法
1.2.1 基因测序
提取晨起时患者痰液样本病原菌菌株,使用DNA提取试剂盒(赛默飞世尔科技(中国)有限公司)提取病原菌菌株DNA,将提取的DNA使用核酸溶度测定仪进行测序,操作方法严格按试剂盒以及仪器说明书进行,结果与基因库NCBI GenBank已知序列同源性比较,确定病原菌种类。
1.2.2 全自动微生物鉴定VITEK-2技术鉴定
将痰液样本病原菌菌株接种至琼脂平板上,37℃培养24 h,选取单一菌落进行革兰染色,根据其病原菌生长特征和染色性,由梅里埃VITEK-2 Compact全自动微生物鉴定系统进行检测,检测结果与配套的GN鉴定板进行对比,确定病原菌种类,鉴定方法选择严格按照实验室操作说明书进行。
1.2.3 MALDI-TOF技术鉴定
挑取痰液样本病原菌菌落,不要带有任何琼脂,靶板涂抹,涂一个点位或两个点位后立刻加入 1 μLα-氰 基-4-羟 基 肉 桂 酸(α-Cyano-4-hydroxycinnamic acid,CHCA)基质,同时涂点样校准菌株大肠埃希菌 ATCC 8739,待样本干燥后,使用梅里埃MALDI-TOF生物质谱仪进行检测,操作方法参考仪器说明书。检测结果与MALDI Biotyper 3.0数据库进行比对,样本图谱与数据库中的相应菌株图谱高度相似时确定病原菌种类。其他注意事项:所有操作过程均应遵守实验室生物安全要求以及相应无菌操作;涂菌时注意涂菌量,过多或过少均会影响鉴定结果;每个靶板有48个点位,16个点位为一组,可分3次使用,每组中心的小点位用于涂校准菌株。
1.3 观察指标
①以基因测序法为“金标准”,比较两种检测方法对病原菌的鉴定结果。②对比其他两种检测技术对病原菌的鉴定率。③对比其他两种检测技术对病原菌的鉴定结果的差异性,包括对病原菌的鉴定准确率、漏诊率、误诊率,其中鉴定准确率=已鉴定出的正确菌群数量/菌群总数量×100%,漏诊率=未鉴定出的菌群数量/菌群总数量×100%,误诊率=鉴定错误菌群数量/菌群总数量×100%。
1.4 数据分析
采用SPSS21.0软件进行数据分析,计数资料使用例(n)或百分数(%)表示,采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 三种检测方法对病原菌的鉴定结果
三种检测方法对金黄葡萄球菌、表皮葡萄球菌、头部葡萄球菌、孔氏葡萄球菌、粪肠球菌、铜绿假单胞杆菌、肺炎克雷伯杆菌、不动杆菌、大肠埃希菌、阴沟肠杆菌、嗜麦芽杆菌、其他类型病菌等病原菌的鉴定结果见表1。
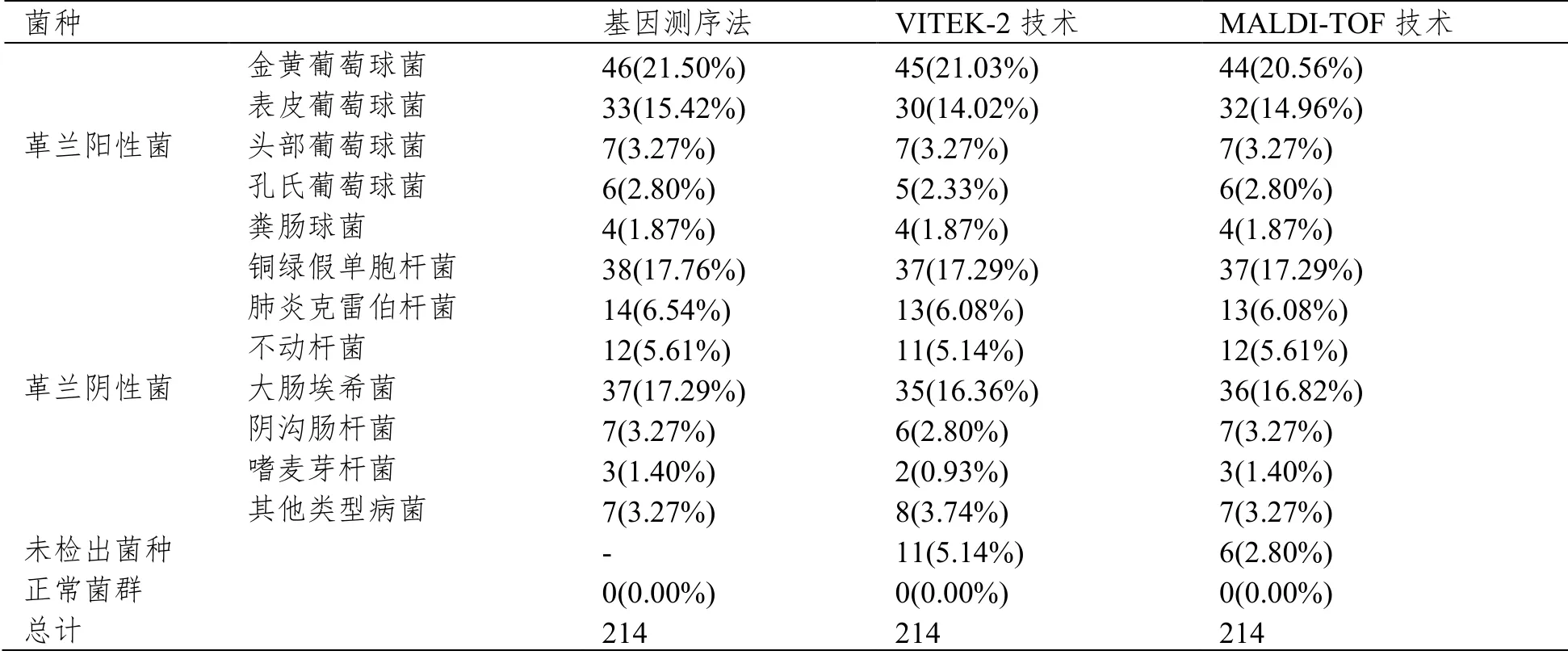
表1 三种检测方法对病原菌的鉴定结果(n(%))
2.2 两种检测技术对病原菌的鉴定率比较
两种检测技术对病原菌各类菌种的鉴定率比较见表2。
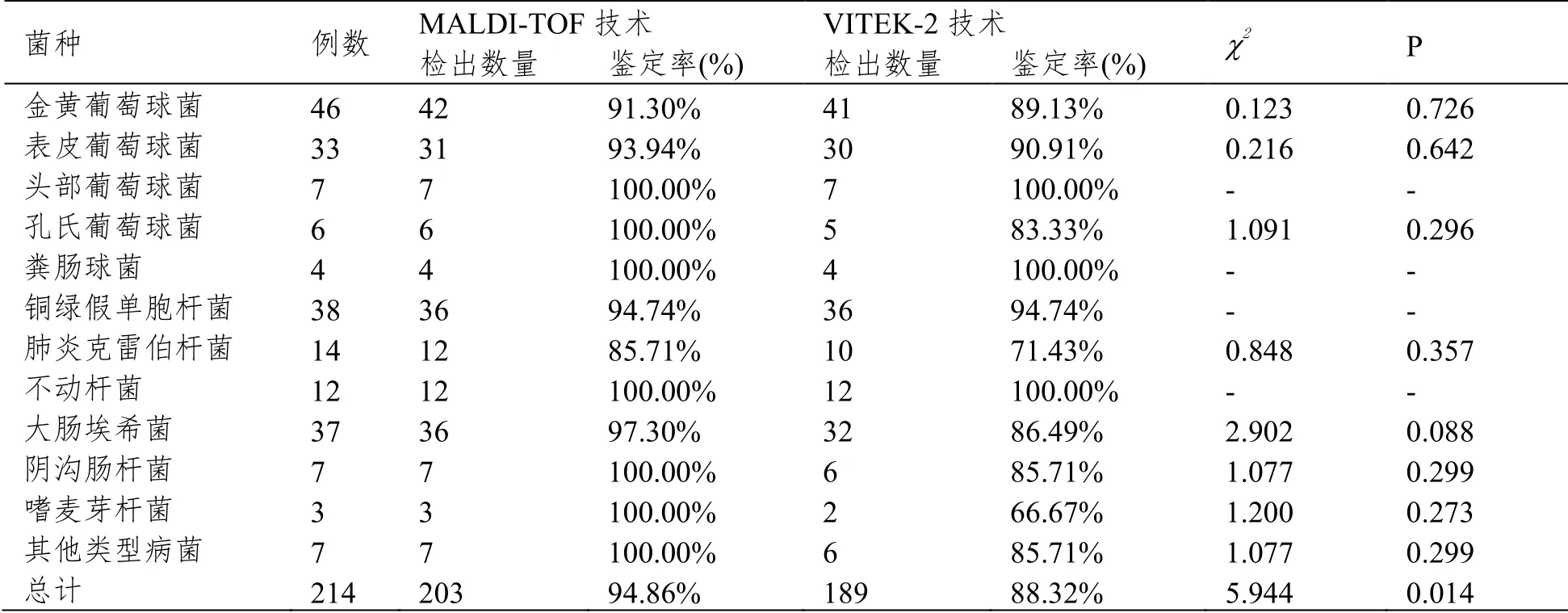
表2 两种检测技术对病原菌的鉴定率比较(n(%))

表3 两种检测技术对病原菌的鉴定结果差异比较(n(%))
2.3 两种检测技术对病原菌的鉴定结果差异比较
MALDI-TOF技术对重症肺炎痰液样本病原菌的总鉴定率明显高于VITEK-2技术,差异有统计学意义(P<0.05),两组检测技术漏诊率比较差异无统计学意义(P>0.05),MALDI-TOF技术对重症肺炎痰液样本病原菌误诊率明显低于VITEK-2技术,差异有统计学意义(P<0.05)。
3 讨论
临床研究指出MALDI-TOF技术能快速、准确地鉴定出病原菌病原学信息,且实验成本较低,在临床检测和鉴定中存在一定优势[7]。在本次研究中,MALDI-TOF技术对重症肺炎患者痰液样本病原菌鉴定准确率明显高于VITEK-2技术,这与孟令缘等[8]研究结论相类似。分析其原因,MALDI-TOF技术通过将痰液病原菌样本和CHCA基质混合,利用激光作为能量来源,辐射病原菌标本与基质共结晶,基质吸收激光能量传递给病原菌蛋白质,使其发生电离;因离子飞行时间与质量呈正比,经过飞行时间检测期,到达检测器后,根据不同离子飞行时间的不同而形成质量图谱,再将其与质谱图数据库的已知特征质谱图作对比,筛选并确定特异性图谱,从而实现对病原菌的区分和鉴定[9,10]。
MALDI-TOF技术以病原菌表面蛋白为检测对象,受培养基、培养时间以及其他培养条件等外部因素影响较小,具有较好的稳定性和可重复性;还能对未经纯化的样本进行检测鉴定,节省了培养时间,使得临床医师可根据鉴定结果,及时为患者提供抗生素治疗[11]。本研究结果显示,两组检测技术漏诊率比较差异无统计学意义,但MALDI-TOF技术对重症肺炎痰液样本病原菌鉴定误诊率明显低于VITEK-2技术,这与李曲文等[12]研究结果相类似。这可能是因为在重症肺炎痰液样本中,病原菌复杂,且存在其他大量干扰物质,使得广谱采集不准确,进而影响MALDI-TOF技术检测敏感度。实际检测可通过样本通过浓缩、微量化等步骤在提高其敏感度,但却会以增加样本处理时间和成本为代价。并且在实际临床检测过程中,VITEK-2技术还可进行相应药敏测试分析,以检测病原菌对相应抗菌药物的耐药情况,而MALDI-TOF技术无法分析病原菌对抗菌药物的敏感情况,无法为临床急性靶向抗感染治疗提供准确的药物使用方案。综上所述,在重症肺炎痰液样本病原菌检测和鉴定中,MALDI-TOF技术能快速为临床提供高度可信的病原菌鉴定结果。然而该检测技术还存在一定不足之处,因无法代替经典的抗菌药物敏感性试验,仅能为临床做出一定的抗感染指导,无法为临床医生急性靶向抗感染治疗提供准确依据。
