基因表达谱分析非酒精性脂肪性肝病中谷胱甘肽转移酶的作用
2023-02-10沈婷婷朱哿瑞陶艳艳刘成海
沈婷婷, 朱哿瑞, 王 帆, 孙 鑫, 黄 恺, 彭 渊, 陶艳艳, 刘成海,
1 上海中医药大学附属曙光医院·肝病研究所, 上海 201203; 2 上海市中医临床重点实验室, 上海 201203
非酒精性脂肪性肝病(NAFLD)是除外酒精和其他明确肝损伤因素所致的,以肝细胞弥漫性脂肪变为特征的临床综合征。其疾病谱包括非酒精性肝脂肪变、非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌[1]。谷胱甘肽是细胞中合成最丰富的低分子量抗氧化剂,在保护细胞免受氧化损伤和外源亲电子试剂的毒性,以及维持氧化还原稳态中发挥着关键作用[2]。谷胱甘肽转移酶(GST)主要存在于肝脏内[3],是一组与肝脏解毒功能有关的酶,参与细胞损伤、缺氧、中毒、衰老等过程[4]。据编码基因的不同将GST分为三个亚家族[5],其中线粒体GST在肥胖症、糖尿病等能量和脂类代谢中起到非常重要的作用[6]。本研究通过高脂饮食建立小鼠NAFLD模型,采用RNA-Seq技术结合生物信息学分析探讨GST在NAFLD中的调控作用。
1 材料与方法
1.1 材料
1.1.1 动物 雄性C57BL/6J小鼠,14只,SPF级,体质量23~25 g,购自北京维通利华实验动物技术有限公司,饲养于上海中医药大学动物实验中心,实验动物使用许可号:SCXK(沪)2020-0009;实验动物生产许可证号:SYXK(沪)2020-009。温度21~25 ℃,湿度55%~65%,12 h明暗光照循环。
1.1.2 试剂 60 kcal%脂肪的高脂饲料(货号:112252),购于戴茨生物科技(无锡)有限公司。ALT试剂盒(批号:20130110)、AST试剂盒(批号:20130411)、TG、苏木素-伊红染液(货号:D006-1-3),均购自南京建成生物工程研究所;TRIzol试剂(批号:F919KB3054)、总RNA提取试剂盒(批号:B518811),购于生工生物工程(上海)股份有限公司;反转录试剂盒(货号:RR047)、扩增试剂盒(货号:RR820),购于日本Takara株式会社。
1.1.3 仪器 荧光倒置显微镜,日本Olympus株式会社(型号:Olympus IX70);实时荧光定量PCR仪,美国Life Technonogy公司(型号:ABI Vii A7);超微量分光光度计,美国Thermo Scientific公司(型号:NanoDrop 2000);生物分析仪,美国Agilent Technologies公司(型号:Agilent 2100 Bioanalyzer);高通量测序仪,美国Illumina公司(型号:Illumina HiSeq X Ten)。
1.2 分组与造模 小鼠适应性喂养1周后,随机抽样分为对照组(n=6)和模型组(n=8)。小鼠自由饮水,对照组小鼠喂养普通饲料、模型组喂养高脂饲料(热量比:碳水化合物20%,脂肪60%,蛋白质20%),连续7周。造模结束后,小鼠禁食16 h,3 %戊巴比妥钠麻醉、固定,打开腹腔,下腔静脉取血,4 ℃、3000 r/min离心15 min,血清置于-80 ℃冰箱保存,用于测定ALT、AST、TG。肝右叶切割1.0 cm×1.0 cm×0.5 cm大小置于4%甲醛固定液中,用于HE染色。另取肝组织各100 mg存于TRIzol中,用于提取RNA。
1.3 检测指标与方法
1.3.1 血清ALT、AST、TG测定 按试剂盒说明书测定小鼠血清中ALT、AST活性及TG水平。
1.3.2 肝脏病理情况 苏木精-伊红(HE)染色观察小鼠肝组织病理。小鼠肝组织经4%中性甲醛缓冲液固定,自动脱水机脱水、石蜡包埋、4 μm切片、HE染色、光学显微镜观察并拍照。脂肪肝分级依据肝细胞脂肪变性占据所获肝组织标本量范围,分为F0~4:F0<5%肝细胞脂肪变;F1:5%~30%肝细胞脂肪变;F2:31%~50%肝细胞脂肪变;F3:51%~75%肝细胞脂肪变;F4:75%以上肝细胞脂肪变[1,7]。油红染色方法:肝脏冰冻切片(8 μm厚度)用于脂质染色。切片用甲醛-钙固定10 min,蒸馏水洗涤;油红O染液染色15 min,60%异丙醇分色3~5 s,去多余染液,蒸馏水洗;Mayer苏木精复染;自来水洗(蓝化)1~3 min;蒸馏水洗;甘油明胶封片。
1.3.3 肝组织RNA提取 TRIzol提取肝组织总RNA,采用NanoDrop 2000分光光度计评估RNA的纯度和含量,使用Agilent 2100 Bioanalyzer质检合格后,使用Illumina HiSeq X Ten 测序仪进行测序,产生150 bp的双端数据。建库测序及数据分析部分由上海欧易生物医学科技有限公司完成。
1.3.4 参考基因组比对 利用hisat2(2.2.1.0)软件将Clean Reads与指定的参考基因组进行序列比对,获取在参考基因组或基因上的位置信息,以及测序样品特有的序列特征信息。
1.3.5 蛋白编码基因表达水平分析 用已知的参考基因序列以及注释文件作为数据库,采取序列相似性比对的方法鉴定出各蛋白编码基因在各样本中的表达丰度。使用htseq-count(0.9.1)软件获取每个样本中比对到蛋白编码基因上的reads数,根据公式计算蛋白编码基因的表达量FPKM(Fragment Per Kilo Bases per Million reads)值。
1.3.6 差异表达基因筛选 基于基因表达水平分析获得的reads数进行差异表达基因筛选,利用DESeq(v1.18.0)软件对各个样本基因的reads数进行标准化处理(采用basemean值来估算表达量),计算差异倍数,并采用负二项分布检验的方式对reads数进行差异显著性检验,最终根据差异倍数及差异显著性检验结果来筛选差异蛋白编码基因,筛选差异的条件为P<0.05且差异倍数(fold change, FC)≥2[8]。
1.3.7 差异表达基因的GO和KEGG富集分析 得到差异基因后,对差异表达基因进行GO和KEGG富集分析。方法:将全部蛋白编码基因作为背景列表,差异蛋白编码基因列表作为从背景列表中筛选出来的候选列表,利用超几何分布检验,计算P值,Benjamini & Hochberg多重检验纠正后,对于correctedP-value<0.05的GO条目定义为差异表达基因中显著富集的GO条目。将差异表达基因应用KEGG数据库预测其参与的信号通路。以correctedP-value<0.05为标准,筛选在差异表达基因中显著富集的信号通路。
1.3.8 差异表达基因的qRT-PCR验证 切取全部小鼠肝组织50 mg,加入500 μL TRIzol试剂及100 μL氯仿抽提总RNA,应用Prime ScriptTMRT试剂盒进行逆转录制备cDNA。以GAPDH为内参进行荧光定量PCR扩增以检测各组肝组织中mRNA的表达水平。扩增引物由AZENTA(https://www.azenta.com)公司合成,引物序列见表1。反应条件:95 ℃、30 s预变性;95 ℃变性5 s,60 ℃退火30 s,40个循环。各组均设3个复孔。采用2-△△CT法表示各目的基因的相对表达量。

表1 RT-PCR引物序列表
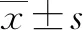
2 结果
2.1 高脂饮食建立NAFLD的小鼠模型 高脂饲料喂养前,对照组和模型组小鼠体质量无明显差异[(21.73±0.45)g vs (21.93±0.67)g,t=-0.598,P=0.561)];高脂饮食喂养7周后,与对照组相比,模型小鼠体质量增加,两组差异无统计学意义[(26.63±2.52)g vs (31.10±3.57)g,t=-2.601,P=0.230]。对照组和模型组ALT、AST差异均无统计学意义[(32.17±4.31)U/L vs (50.25±30.08)U/L,t=-1.447,P=0.173;(85.50±38.52)U/L vs (146.13±88.52)U/L,t=-1.558,P=0.145)]。与对照组相比,模型组血清TG明显高于对照[(2.02±0.50)mmol/L vs (1.00±0.29)mmol/L,t=-4.45,P=0.001]。HE染色结果提示:对照组小鼠肝细胞形态正常、结构完整、无脂肪变性;模型组可见肝细胞弥漫性脂肪变性和气球样变。油红染色显示:对照组肝细胞未见明显脂滴;模型组肝细胞胞浆内橘红色脂滴数量增多,大小不一(图1);模型组肝细胞脂肪变分级明显高于对照组(1.88±0.64 vs 1.00±0.00,t=-3.86,P=0.006)(图2)。
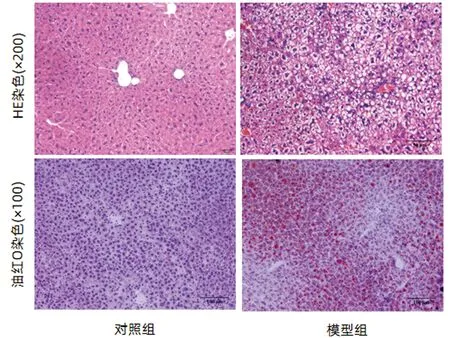
图1 两组小鼠组织病理学结果
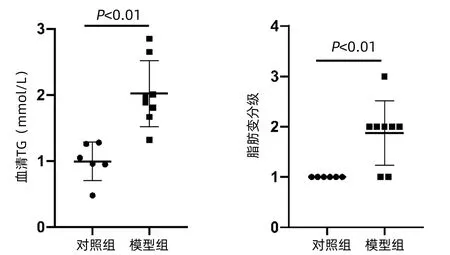
图2 两组血清TG水平及肝组织脂肪变分级比较
2.2 组织表达差异基因分析 将P<0.05且基因表达量差异倍数≥2.0的基因定义为差异表达基因。与对照组相比,模型组转录组测序差异表达基因共1367个,其中上调和下调基因数分别为608个和759个。GO分析显示:脂质分解代谢、脂肪酸代谢、胆固醇代谢过程、糖异生等呈显著富集,与NAFLD发生密切相关。差异表达基因GO富集分析前60(筛选3种分类中对应差异基因数目大于2的GO条目,按每个条目对应的qvalue 由大到小排序的各20条)条形图展示见图3。KEGG分析显示:PPAR信号通路、胆固醇代谢、脂肪酸代谢等呈显著富集,与NAFLD的发生密切相关。差异表达基因KEGG富集前30气泡图见图4。
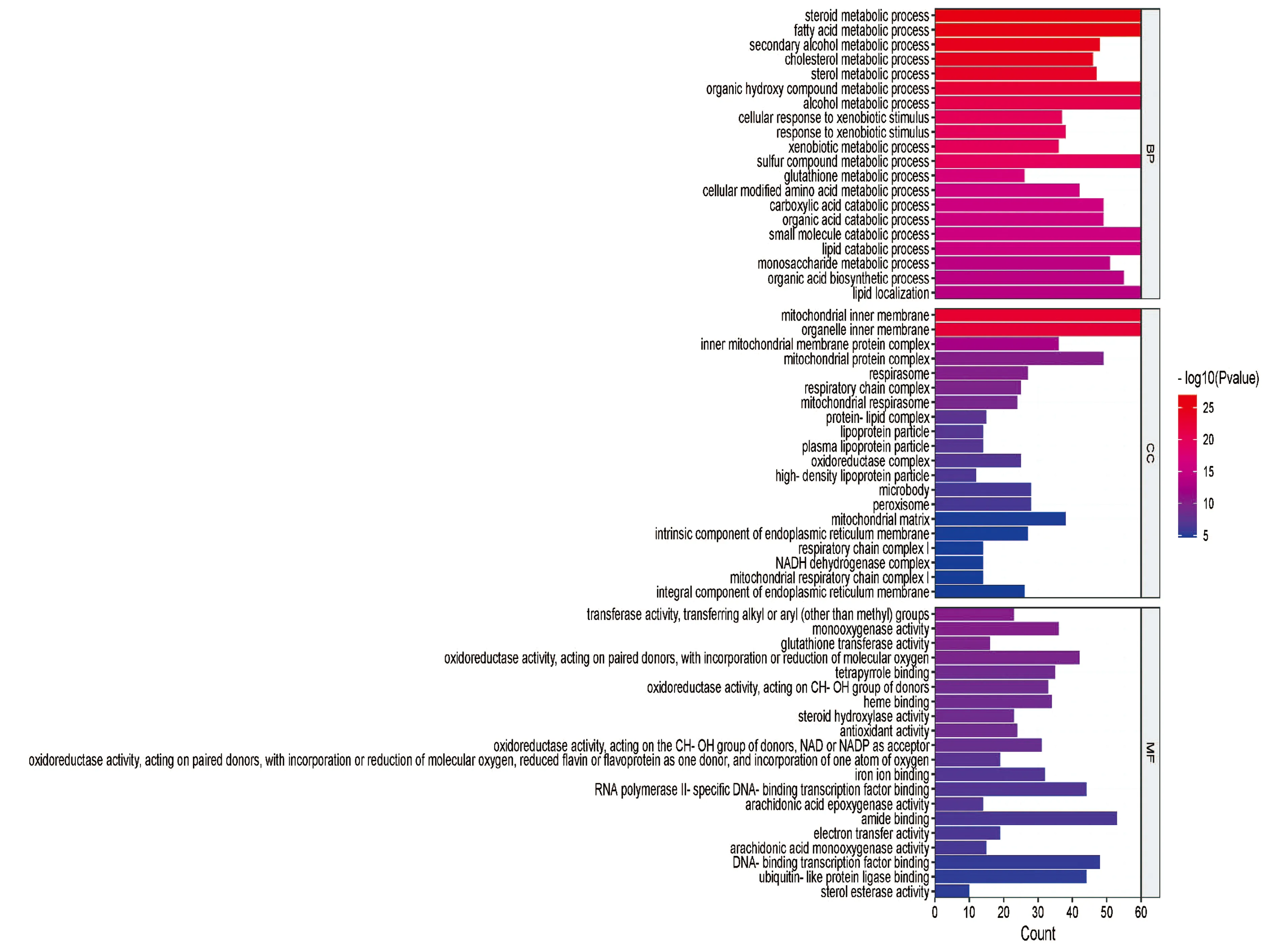
图3 差异表达基因GO富集分析
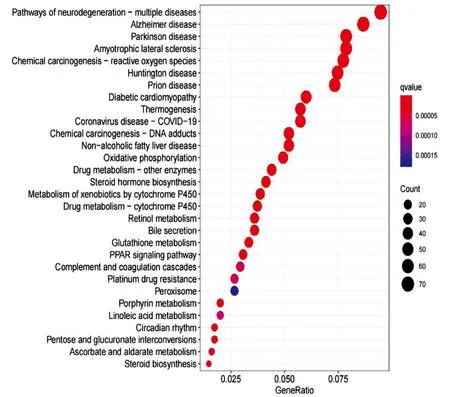
图4 差异表达基因KEGG富集分析
2.3 GST基因功能分析 高脂饮食诱导17个GST基因的差异表达:GSTa2、GSTa4、GSTp1、GSTp-ps、GSTo1、GSTa1、GSTt3、GSTk1、GSTm1、GSTm4、GSTp2、GSTa3、GSTz1、GSTt1、GSTt2、GSTm2、GSTm3。GO富集分析显示:GST基因同时参与类固醇代谢过程、脂肪酸代谢过程、胆固醇代谢过程等多个生物学过程,与线粒体内膜、细胞器内膜、呼吸体等细胞分组相关,分子功能涉及转移酶活性、单加氧酶活性、氧化还原酶活性等。KEGG富集分析显示:GST基因参与药物代谢、细胞色素P450对异生素的代谢、谷胱甘肽代谢等。GO富集分析显示:谷胱甘肽代谢过程呈显著富集,KEGG通路分析显示谷胱甘肽代谢通路显著富集,差异基因见表2。上述结果提示GST可能在高脂饮食诱导的脂肪肝模型中发挥重要作用。
2.4 差异表达基因的qRT-PCR验证 从17个GST差异基因中选择差异最明显的前10个GST基因(表2)。以GAPDH作为内参,采用荧光定量PCR验证RNA-seq结果的可靠性,差异表达基因验证结果见图5,与转录组测序差异基因变化趋势一致,其中GSTa2、GSTa3、GSTa4、GSTm1、GSTm2、GSTm3、GSTm4、GSTp1、GSTo1表达较对照组下调,GSTk1表达上调,从而进一步证实转录组测序结果的可靠性。
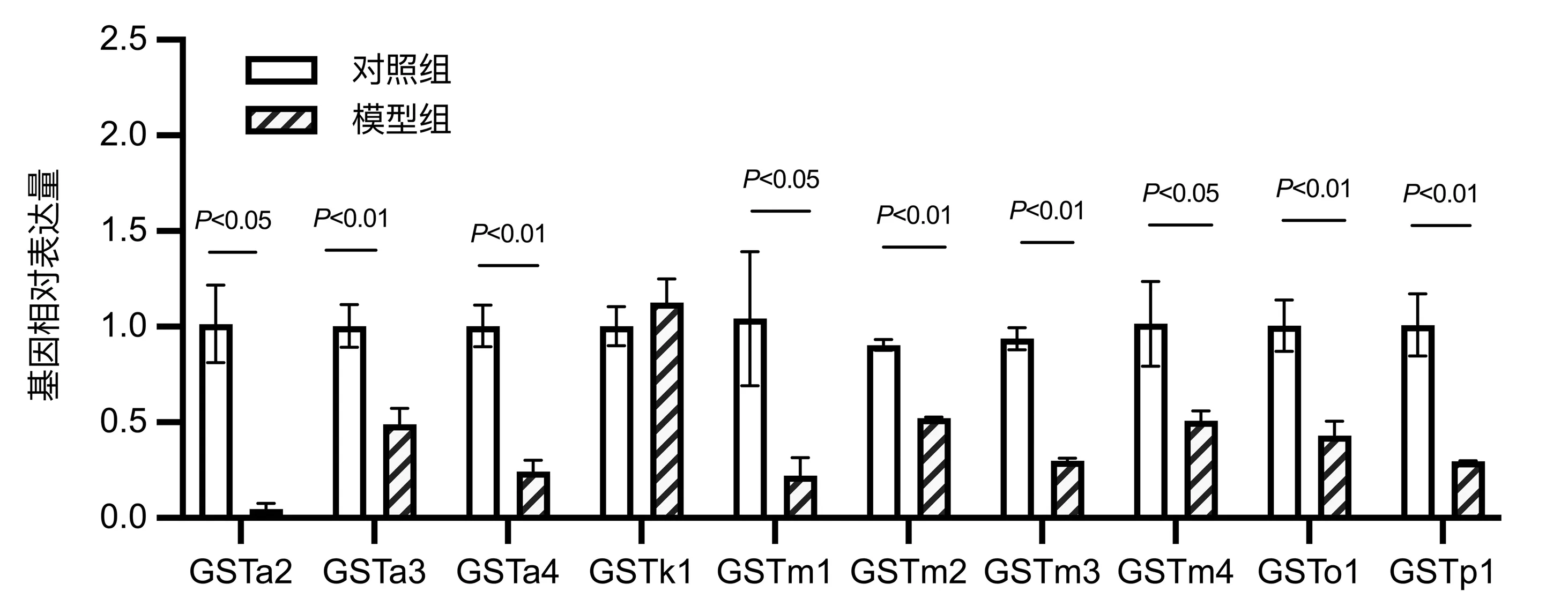
图5 RT-PCR验证小鼠肝组织中差异表达基因mRNA的表达
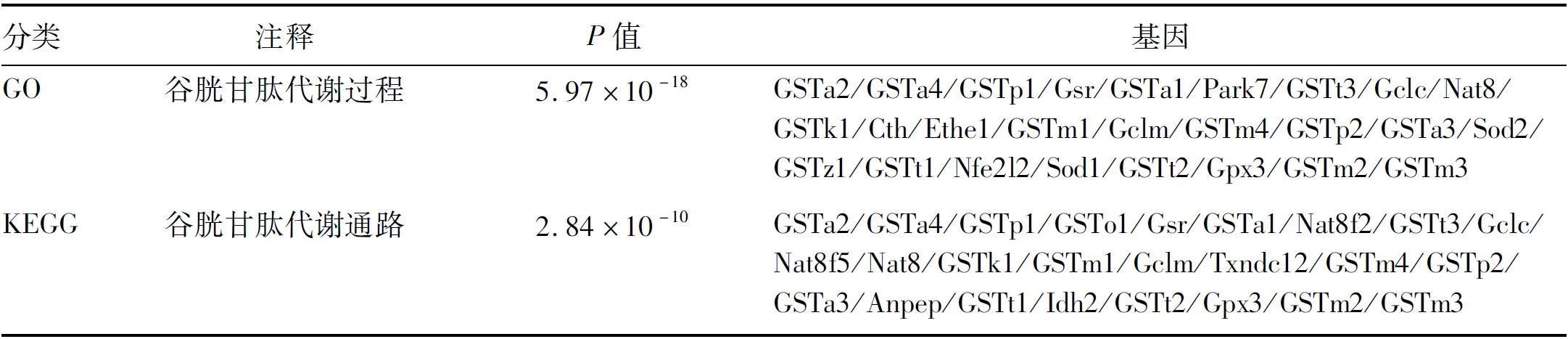
表2 GST差异表达基因GO和KEGG富集分析
3 讨论
GST曾被称为谷胱甘肽S-转移酶,是一组Ⅱ期解毒酶,能催化还原型谷胱甘肽与多种内源性/外源性亲电子化合物结合。GST基因的遗传多态性可参与NAFLD、不同病因的肝炎、肝硬化和肝细胞癌的发生发展[9-10]。因此,研究GST基因在NAFLD中的表达及其作用具有一定意义。
非酒精性肝脂肪变是NAFLD疾病谱之一[1]。本研究采用高脂饲料喂养7周,诱导NAFLD模型。结果发现,与对照组相比,模型组小鼠体质量与肝功能无明显变化,HE染色和油红染色可见肝细胞呈现小泡性脂肪变,脂肪变积分为1.88±0.64,提示NAFLD模型建立。
本研究采用RNA-seq转录组测序筛选高脂饮食诱导的NAFLD模型与正常小鼠差异基因,共筛选出1367个特异性差异表达基因,其中上调基因数608个、下调基因数759个。生物信息学通路分析显示这些差异基因参与类固醇代谢过程、脂肪酸代谢过程、胆固醇代谢过程等多个生物学过程,与线粒体内膜、细胞器内膜、呼吸体等细胞分组相关,分子功能涉及转移酶活性、单加氧酶活性、氧化还原酶活性等,与既往的研究一致。GO富集分析显示谷胱甘肽代谢过程富集,KEGG通路分析显示谷胱甘肽代谢通路富集。
已知的人类GST基因家族由六个亚家族组成:α(GSTA-alpha)、μ(GSTM-miu)、ω(GSTO-omega)、π(GSTP-pi)、θ(GSTT-theta)和ξ(GSTZ-zeta)[11]。人GST基因约有29个亚型(https://www.genecards.org)。本研究采用高脂饮食诱导的NAFLD模型发现17个GST家族基因差异表达,占人GST家族基因的58.62%,提示GST相关基因可能参与NAFLD的进展。选择差异倍数最明显的前10个GST相关基因,采用qRT-PCR验证小鼠肝组织中GST相关基因表达,最终结果提示其表达水平与转录组测序差异分析的变化趋势一致,进一步证实转录组测序结果的可靠性。
GST在细胞解毒以及保护细胞免受内源性与外源性氧化应激损伤中起着至关重要的作用[9]。GSTp1 A313G基因多态性研究表明NAFLD患者G等位的携带频率更高[12],G等位基因是NAFLD 的危险因素[13],提示GSTp1基因多态性与NAFLD发生相关。与健康成年人相比,NAFLD患者的脂肪因子失衡,瘦素浓度升高,脂联素水平降低[14]。Prysyazhnyuk等[15]的研究发现,与基因型正常的NAFLD 患者相比,GSTm1无效基因型患者的瘦素血浆水平显著升高。Lan等[2]发现NASH诱导肝细胞GSTm2下调,肝细胞GSTm2通过阻断ASK1 N端二聚化和磷酸化阻止NASH进展。GSTa4的缺失可加剧NAFLD的发生[16],表现为肝脏脂肪变性、氧化应激,血清丙氨酸氨基转移酶、TNFα、IL-6升高等。Nrf2是氧化应激中的关键转录因子,促进GSTa2基因的激活,提高抗氧化应激能力,与NAFLD发生密切相关[17]。然而,朱雅莉等[18]应用iTRAQ技术定量分析NASH患者肝组织中的差异蛋白发现,GSTm4在NASH患者肝组织中上调,与本研究结果相反,故GSTm4与NASH的关系,需进一步研究。此外,本研究发现高脂饮食导致GSTa3、GSTm3、GSTo1、GSTk1在NAFLD模型组中差异表达,尽管这些基因在NAFLD相关报道很少,但是GO和KEGG分析显示这些GST基因参与抗氧化活性、氧化还原酶活性等多个与NALFD发生相关的过程,是进一步研究的方向。
本研究采用高脂饮食建立模型,其肝脏脂肪变较轻,且炎症改变不明显,但仍发现GST基因表达差异,提示在NAFLD发生的早期已有GST基因改变。GST通过参与类固醇代谢过程、脂肪酸代谢过程、胆固醇代谢过程等多个生物学过程影响脂质代谢,与NAFLD发病密切相关,后期将深入讨论GST相关基因参与NAFLD的病理机制,以期为NAFLD治疗提供依据。
伦理学声明:本研究方案于2021年7月2日经由上海中医药大学实验动物伦理委员会审批,批号:PZSHUTCM210702004,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:沈婷婷负责生化检测、数据分析与撰写论文;朱哿瑞、王帆负责动物造模;孙鑫、黄恺负责动物病理;彭渊负责生信分析;陶艳艳、刘成海负责课题设计,拟定写作思路,指导撰写文章并最后定稿。
