清肺通络方调控Caspase-1对肺炎支原体诱导人正常肺上皮细胞BEAS-2B焦亡的干预作用
2023-02-10姜永红陈一柳樊秋月刘旭华
姜永红, 陈一柳, 樊秋月, 刘旭华
(上海中医药大学附属龙华医院,上海 200032)
肺炎支原体(mycoplasma pneumoniae,MP)是儿童非典型肺炎最常见的病原体,感染率随年龄增长而增加。6岁以上儿童MP检出率高达62%[1]。由于MP结构的特殊性,其对β-内酰胺类抗生素天然耐药,对大环内酯类、四环素类和喹诺酮类抗生素敏感[2]。但近些年,随着MP耐药率逐年上升,难治性肺炎支原体肺炎(mycoplasmapneumoniae pneumonia,MPP)发病率逐年上升,尤其在亚洲国家最为明显[3]。难治性MPP的临床症状严重甚至发生死亡,对患儿的生命健康造成了极大的威胁。中医药因具有副作用小、多靶点发挥作用的优势,成为治疗MPP,特别是耐大环内酯类抗生素或对大环内酯类抗生素不敏感MPP的一种可靠选择。
研究发现,MP感染疾病的严重程度与炎症反应相关[4],且细胞焦亡与肺部炎症之间有着密切的关系[2]。细胞焦亡是由炎症小体参与的依赖炎性半胱氨酸天冬氨酸蛋白酶(Caspase)的一种新的细胞程序性死亡方式,主要表现为细胞核皱缩、细胞膜成孔,导致细胞肿胀破裂,细胞内容物释放,进而激活强烈的炎症反应,因此,细胞焦亡又称为细胞的炎性坏死[5]。Caspase-1在细胞凋亡和焦亡过程中均发挥重要的作用。课题组通过前期实验证明,清肺通络方能够下调由凋亡相关斑点样蛋白(ASC)、Caspase-1、Nod样受体蛋白3(NLRP3)构成的炎症小体活性,减轻炎症反应,抑制细胞凋亡[6]。故本研究进一步以Caspase-1为切入点,通过建立人正常肺上皮细胞BEAS-2B细胞感染及过表达质粒模型探讨清肺通络方对MP感染的治疗作用及机制,现将研究结果报道如下。
1 材料与方法
1.1 细胞 人正常肺上皮细胞BEAS-2B,购自上海中乔新舟生物科技有限公司(批号:ZQ0381)。
1.2 菌株与试剂 肺炎支原体国际标准菌株(MPFH,购自美国ATCC)。Caspase-1抑制剂(ZYVAD-FMK,美国MedChemExpress公司生产,批号:HY-P1009);细胞计数试剂盒8(CCK-8,美国SAB公司);Caspase-1 FLICA分析试剂盒(德国Eterlife公司);碘化丙啶(PI)染液(美国Invitrogen公司);乳酸脱氢酶(LDH)检测试剂盒(南京建成生物工程研究所);Na+-K+-ATP酶活性检测试剂盒(北京索莱宝科技有限公司);白细胞介素(IL)-1β检测试剂盒、IL-18检测试剂盒(上海纪宁实业有限公司);Caspase-1、pro-Caspase-1、消皮素D(GSDMD)、消皮素D-N端片段(GSDMD-N)等兔单克隆抗体(英国Abcam公司);羊抗兔HRP标记的IgG二抗(碧云天生物技术有限公司);SYBRGreen PCR试剂盒(美国Thermo公司);逆转录试剂盒(加拿大Fermentas公司)。
1.3 仪器 LGJ-10D冷冻干燥机(北京四环科学仪器厂);CytoFLEX型流式细胞仪(美国Beckman公司);TDZ4-WS型离心机(上海卢湘仪离心机仪器有限公司);Mini-Protean 3 Cell型电泳仪(美国Bio-Rad公司);PS-9型电转仪(大连竞迈科技有限公司);ABI-7300型Real-time PCR检测仪(美国ABI公司);TG-16M型低温冷冻离心机(上海卢湘仪离心机仪器有限公司);DNM-9602型酶标分析仪(北京普朗新技术有限公司);XDS-500C型显微镜(上海蔡康光学仪器有限公司)。
1.4 药物及制备 清肺通络方由桑白皮10 g、地骨皮10 g、虎杖15 g、桃仁10 g、地龙10 g、半枝莲15 g、苏子10 g、葶苈子10 g、甘草5 g组成。上述中药饮片为华宇中药上海有限责任公司产品。按桑白皮∶地骨皮∶虎杖∶桃仁∶地龙∶半枝莲∶苏子∶葶苈子∶甘草=2∶2∶3∶2∶2∶3∶2∶2∶1,将中药材研磨粉碎后,放入容器,用10倍纯水浸泡40 min,经2次煎煮(第1次1 h,第2次30 min)过滤后,浓缩药液至浸膏状,用冷冻干燥机制成干粉。由上海中医药大学附属龙华医院制剂室制备。每100 g中药饮片可提取出19.8 g中药提取物粉末。称取药物提取物粉末,加少量DMSO助溶,再加入双蒸水溶解,超声震荡,过滤除菌,配制为1 g/mL(生药浓度)的中药溶液。将配制好的中药溶液保存在-20℃冰箱中备用。
1.5 肺炎支原体菌株扩增 每100 mL支原体肉汤培养基,包括支原体肉汤干粉2.04 g、葡萄糖0.5 g、双蒸水80 mL、0.1%酚红2 mL,混匀后于121℃高压灭菌15 min。取支原体添加剂G(SR0059)溶于20 mL高压灭菌处理的蒸馏水中,在冷却至50℃时加入支原体肉汤培养基,将暗红色菌液于4℃保存。使用液体培养法连续将菌种传代,选择第3代,选取颜色变化单位(color change units,CCU)测定菌液浓度。进行后续实验时,将原始MP菌液稀释至1×107CCU/mL。
1.6 BEAS-2B细胞模型的制备与分组 不同浓度中药提取物对MP感染BEAS-2B细胞活力的影响:取96孔培养板,将BEAS-2B细胞分为空白对照组、模型对照组、清肺通络方5个浓度组,每孔5×104个细胞。模型对照组和清肺通络方组以1×107CCU/mL浓度MP感染BEAS-2B细胞,置于5%CO2恒温培养箱内37℃孵育24 h。清肺通络方5个浓度组分别在培养基中滴加0.1、0.5、1、2、4 mg/L清肺通络方溶液,培养24 h。按1∶10体积比混合Cell Counting Kit-8(CCK-8)和无血清必需基本培养基,每孔100μL加入待测孔中,在37℃、5%CO2培养箱中孵育1 h。应用酶标仪测定450 nm波长处吸光度,并计算细胞存活率。确认经不同浓度清肺通络方干预MP感染细胞后,清肺通络方各浓度组较模型组有一定的促进细胞增殖作用,且呈浓度依赖关系。最终筛选清肺通络方最佳浓度为2 mg/L用于后续实验。
继而,将BEAS-2B细胞随机分为4组:空白对照组(A)、模型组(B)、清肺通络方组(C)、Caspase-1抑制剂组(D)。BEAS-2B细胞常规复苏后,用含10%胎牛血清F12K培养基调整细胞浓度至1×109个/mL,按照每孔0.5 mL接种至96孔培养板,置于37℃、5%CO2培养箱中培养。待细胞生长进入对数增殖期时,收获培养细胞。模型组(B):细胞传代培养至对数生长期时,采用1×107CCU/mL浓度MP菌液进行感染。同时,设立正常培养的BEAS-2B细胞为空白对照组(A),于37℃、5%CO2条件下分别继续培养24 h。清肺通络方组(C):在1×107CCU/mL浓度MP菌液感染24 h后加入2 mg/L清肺通络方溶液培养24 h。Caspase-1抑制剂组(D):在1×107CCU/mL浓度MP菌液感染前1 h加入20μmol/L Z-YVAD-FMK作为阳性对照组干预。
1.7 过表达Caspase-1质粒构建、转染与分组通过NCBI网站查找Caspase-1(人)基因的mRNA序列,针对CDS区域以及选用载体设计引物及酶切位点。将含有酶切位点的目的基因ncRNA区域序列交予金唯智基因公司合成,将合成的质粒送往上海美吉生物有限公司DNA测序,测序所得结果与NCBI网站中Caspase-1序列进行比对,比对率为100%的质粒保留菌液。
将BEAS-2B细胞随机分为4组:空白对照组(E)、空白质粒组(F)、过表达质粒组(G)、清肺通络方2组(H)。
将状态良好的细胞铺于细胞培养板中,在细胞长至70%~80%时,按照Lipofectamine 2000转染试剂说明书上的步骤,将空载体以及Caspase-1过表达质粒单独转染6 h,换液继续培养48 h,收集细胞。转染空载体的为空白质粒组(F);转染Caspase-1过表达质粒的为过表达质粒组(G)。
空白质粒组(F)、过表达质粒组(G):细胞传代培养至对数生长期时,分别用1×107CCU/mL浓度MP菌液进行感染,同时设立BEAS-2B细胞为空白对照组(E),于37℃、5%CO2条件下分别继续培养24 h。清肺通络方2组(H):在1×107CCU/mL浓度MP菌液感染24 h后,加入2 mg/L清肺通络方溶液培养24 h。
1.8 观察指标与方法
1.8.1 CCK-8法检测12、24 h细胞增殖活性 将BEAS-2B细胞随机分为4组,即空白对照组(A)、模型组(B)、清肺通络方组(C)、Caspase-1抑制剂组(D);另将BEAS-2B细胞随机分为3组,包括空白质粒组(F)、过表达质粒组(G)、清肺通络方2组(H)。细胞处理同上。用CCK-8法检测12、24 h细胞增殖活性。操作方法:将处于对数生长期的细胞经胰蛋白酶消化,显微镜下计数后制成5×104个/mL的细胞悬液。分别取100μL至96孔培养板,设3个复孔,5×103个细胞/孔,以100μL培养液做空白对照,37℃培养过夜。按照实验分组对细胞进行相应处理,在0、12、24 h后,按照1∶10体积比混合CCK-8和无血清必需基本培养基,每孔100μL加入待测孔中,在37℃、5%CO2培养箱中孵育1 h,用酶标仪测定450 nm波长处的吸光度,并计算细胞活力。
1.8.2 Western Blot法检测细胞Caspase-1、pro-Caspase-1、GSDMD、GSDMD-N表达 将需要抽提蛋白的细胞,以磷酸盐缓冲液(PBS)洗涤2次,按比例加入裂解液进行匀浆,冰上静置30 min后,于4℃、12 000 r/min离心10 min。取上清,使用BAC法测定蛋白浓度后,置-80℃冰箱备用。将上清液(含25μg蛋白)经十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离后转移到聚偏氟乙烯(PVDF)膜上(25 V,30 min)。经50 g/L脱脂奶粉封闭后加按体积比稀释的一抗Caspase-1(1∶1 000)、pro-Caspase-1(1∶800)、GSDMD(1∶1 000)、GSDND-N(1∶1 000)、GAPDH(1∶2 000)工作液4℃孵育过夜,磷酸盐-Tween-20缓冲液(PBST)洗涤后再加入按体积比1∶500稀释的二抗,室温孵育1 h。再经PBST漂洗后加入化学发光液进行曝光显影,最后应用ImageJ软件分析灰度值。结果以目的蛋白与内参蛋白(GAPDH)灰度值比值表示。
1.8.3 ELISA法检测细胞上清液IL-1β和IL-18水平 取BEAS-2B细胞上清液,严格按照ELISA试剂盒说明书进行,在全自动酶标仪上450 nm波长处测各组吸光度,绘制标准曲线并求出浓度。
1.8.4 生化法检测细胞LDH和Na+-K+-ATP酶活性 严格按照LDH测试盒说明书进行操作,检测LDH活性需将待测液体混匀后,室温放置5 min,应用全自动酶标仪于450 nm波长处测定吸光度。检测Na+-K+-ATP酶活性需将待测液体40℃水浴10 min,应用全自动酶标仪于660 nm波长处测定吸光度。根据公式计算LDH、Na+-K+-ATP酶活性。
1.8.5 流式细胞术检测细胞焦亡 离心收集BEAS-2B细胞,制成单细胞悬液,参照Caspase-1FLICA分析试剂盒说明书,对细胞中活化的Caspase-1进行FLICA/PI双阳性染色来评估细胞焦亡。
1.8.6 PCR法检测细胞Caspase-1 mRNA表达 提取各组细胞总RNA,反转录为cDNA,以GAPDH为内参。PCR扩增反应程序:95℃10 min;95℃15 s,60℃45 s,40个循环。熔解曲线:95℃15 s,60℃1 min,95℃15 s,60℃15 s。采用仪器自带软件(ABIPrism 7300 SDSSoftware)进行数据分析。Caspase-1上游引物序列为5’-TGAATTATTACAG ACAAGGGTG-3’,下游引物序列为5’-AACGGAG TCAATCAAAGC-3’,扩增片段为103 bp;GAPDH上游引物序列为5’-AATCCCATCACCATCTTC-3’,下游引物序列为5’-AGGCTGTTGTCATACTT C-3’,扩增片段为218 bp。
1.9 统计方法 采用SPSS25.0统计软件进行数据分析,数据描述以均数±标准差(±s)表示,以One-Way ANOVA的Homogeneity-of-variance进行方差齐性检验,如方差齐则直接进行单因素方差分析,并用LSD进行两两比较;如方差不齐则用Transform中的Rank Cases进行变量变换后,再用One-Way ANOVA进行单因素方差分析,并用LSD进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 清肺通络方干预MP感染BEAS-2B细胞的实验结果
2.1.1 清肺通络方对MP感染BEAS-2B细胞活力的影响 图1结果显示:与空白对照组比较,模型组12、24 h细胞活力显著下降(P<0.001)。与模型组比较,清肺通络方组、Caspase-1抑制剂组12、24 h细胞活力均显著增加(P<0.001)。

图1 清肺通络方(QTF)干预12、24 h对肺炎支原体(MP)感染BEAS-2B细胞活力的影响Figure 1 Effect of 12-and 24-hour intervention with Qingfei Tongluo Prescription on the viability of MP-infected BEAS-2B cells
2.1.2 清肺通络方对MP感染BEAS-2B细胞pro-Caspase-1、Caspase-1、GSDMD、GSDMD-N表达的影响 图2结果显示:与空白对照组比较,模型组Pro-Caspase-1、Caspase-1、GSDMD、GSDMD-N表达水平显著升高(P<0.01或P<0.001);与模型组比较,清肺通络方组Caspase-1、GSDMD-N、GSDMD表达降低(P<0.05或P<0.01),Pro-Caspase-1表达差异无统计学意义(P>0.05);Caspase-1抑制剂组Pro-Caspase-1、GSDMD、GSDMD-N、Caspase-1表达水平显著降低(P<0.01或P<0.001)。

图2 清肺通络方(QTF)对肺炎支原体(MP)感染BEAS-2B细胞pro-Caspase-1、Caspase-1、消皮素D(GSDMD)、消皮素D-N端片段(GSDMD-N)表达的影响Figure 2 Effect of Qingfei Tongluo Prescription on the expression of pro-Caspase-1,Caspase-1,GSDMD and GSDMD-N in MP-infected BEAS-2B cells
2.1.3 清肺通络方对MP感染BEAS-2B细胞炎症因子IL-1β、IL-18含量的影响 图3结果显示:与空白对照组比较,模型组IL-1β、IL-18含量均显著升高(P<0.001);与模型组比较,清肺通络方组、Caspase-1抑制剂组IL-1β、IL-18含量均显著降低(P<0.001)。

图3 清肺通络方(QTF)对肺炎支原体(MP)感染BEAS-2B细胞炎症因子白细胞介素(IL)-1β、IL-18含量的影响Figure 3 Effect of Qingfei Tongluo Prescription on the content of inflammatory factors IL-1βand IL-18 in MP-infected BEAS-2B cells
2.1.4 清肺通络方对MP感染BEAS-2B细胞焦亡率的影响 图4结果显示:与空白对照组比较,模型组细胞焦亡率显著上升(P<0.001);与模型组比较,清肺通络方组、Caspase-1抑制剂组细胞焦亡率均显著下降(P<0.001)。
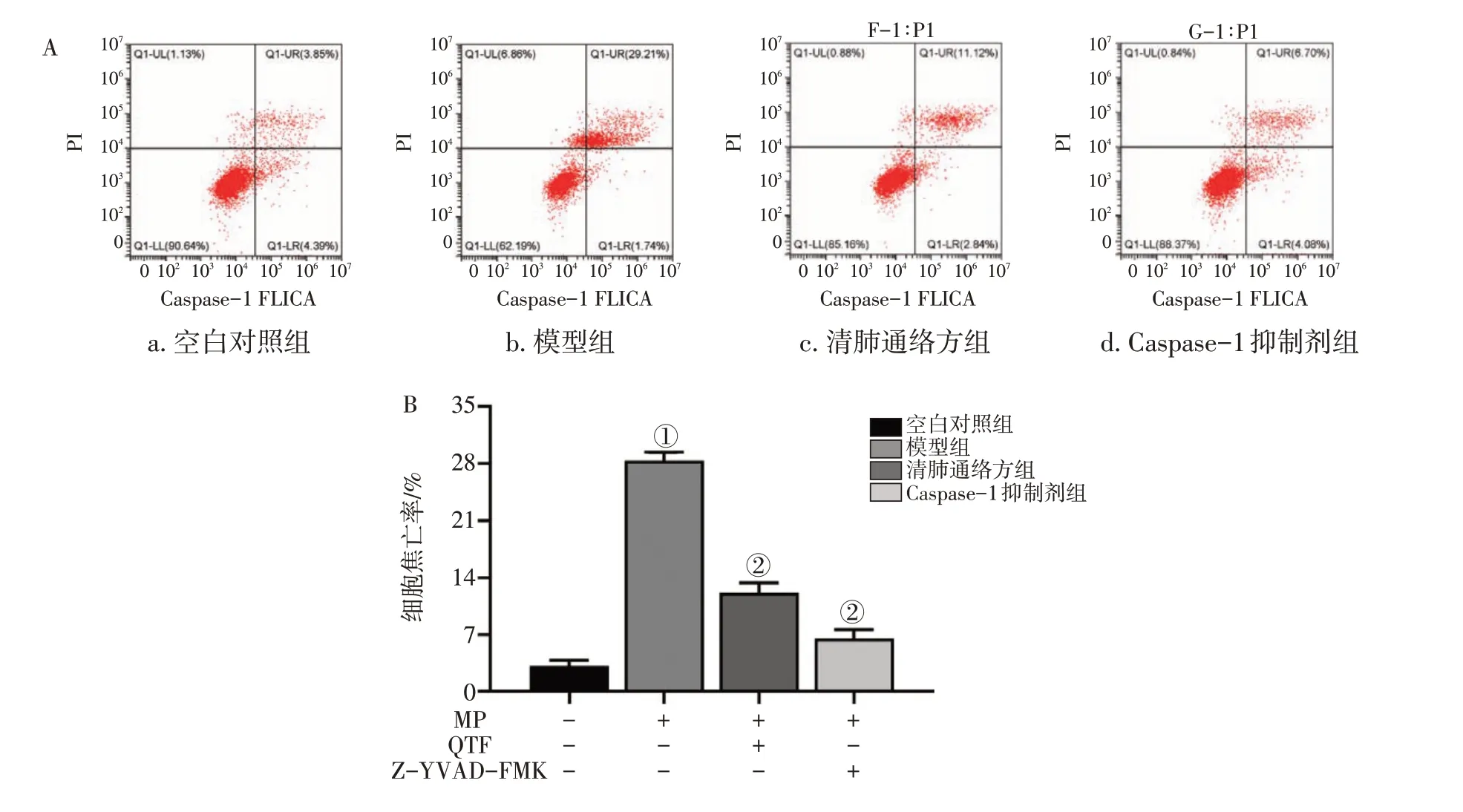
图4 清肺通络方(QTF)对肺炎支原体(MP)感染BEAS-2B细胞焦亡的影响Figure 4 Effect of Qingfei Tongluo Prescription on the pyroptosis of MP-infected BEAS-2B cells
2.1.5 清肺通络方对MP感染BEAS-2B细胞LDH、Na+-K+-ATP酶活性的影响 图5结果显示:与空白对照组比较,模型组LDH活性明显上升(P<0.001)、Na+-K+-ATP酶活性显著下降(P<0.001);与模型组比较,清肺通络方组、Caspase-1抑制剂组LDH活性显著下降(P<0.001),Na+-K+-ATP酶活性明显上升(P<0.01或P<0.001)。

图5 清肺通络方(QTF)对肺炎支原体(MP)感染BEAS-2B细胞乳酸脱氢酶(LDH)、Na+-K+-ATP酶活性的影响Figure 5 Effect of Qingfei Tongluo Prescription on LDH and Na+-K+-ATPase activities in MP-infected BEAS-2B cells
2.2 清肺通络方干预过表达Caspase-1质粒转染BEAS-2B细胞的实验结果
2.2.1 过表达Caspase-1质粒转染BEAS-2B细胞Caspase-1蛋白mRNA表达 图6结果显示:与空白对照组比较,空白质粒组Caspase-1蛋白mRNA表达差异无统计学意义(P>0.05);与空白质粒组比较,过表达质粒组Caspase-1蛋白mRNA表达明显增高(P<0.001)。

图6 过表达Caspase-1质粒转染BEAS-2B细胞Caspase-1蛋白mRNA表达Figure 6 Caspase-1 protein mRNA expression in BEAS-2B cells transfected with overexpressed Caspase-1 plasmids
2.2.2 清肺通络方对过表达Caspase-1质粒转染BEAS-2B细胞增殖活性的影响 图7结果显示:与空白质粒组比较,过表达质粒组12、24 h细胞增殖活性明显下降(P<0.001);与过表达质粒组比较,清肺通络方2组干预12、24 h细胞增殖活性显著上升(P<0.05或P<0.001)。
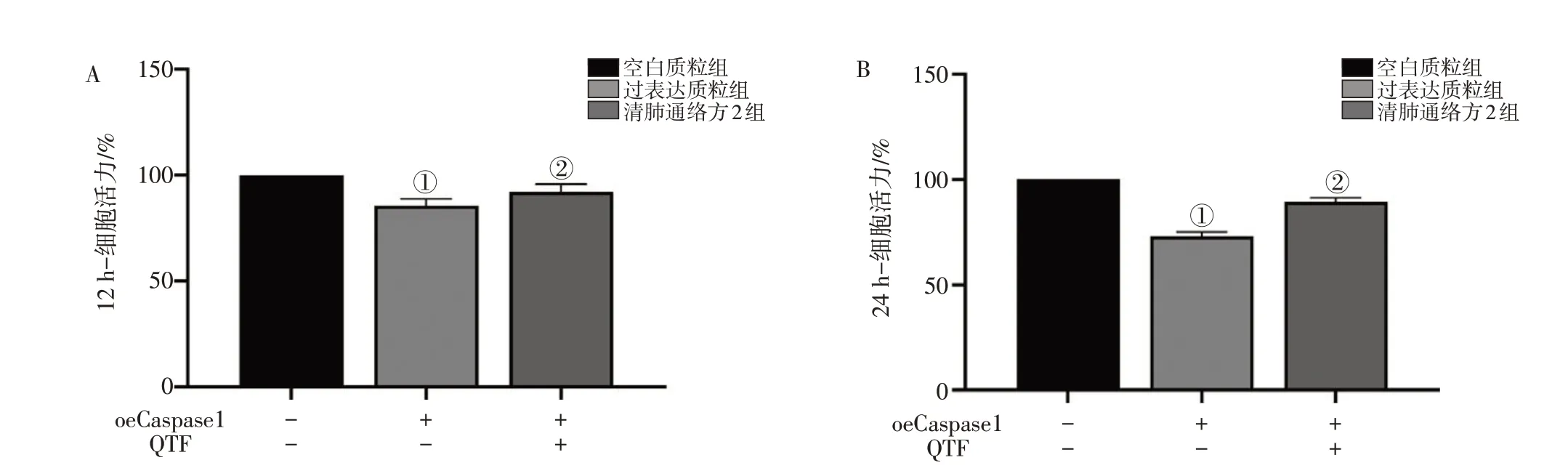
图7 清肺通络方(QTF)对过表达Caspase-1质粒转染BEAS-2B细胞增殖活性的影响Figure 7 Effect of Qingfei Tongluo Prescription on the proliferative activity of BEAS-2B cells transfected with overexpressed Caspase-1 plasmids
2.2.3 清肺通络方对过表达Caspase-1质粒转染BEAS-2B细胞的Pro-Caspase-1、Caspase-1、GSDMD、GSDMD-N表达的影响 图8结果显示:与空白质粒组比较,过表达质粒组细胞中pro-Caspase-1、Caspase-1、GSDMD、GSDMD-N表达明显升高(P<0.01或P<0.001);与过表达质粒组比较,清肺通络方2组细胞pro-Caspase-1、Caspase-1、GSDMD、GSDMD-N表达明显降低(P<0.05或P<0.01)。

图8 清肺通络方(QTF)对过表达Caspase-1质粒转染BEAS-2B细胞的pro-Caspase-1、Caspase-1、消皮素D(GSDMD)、消皮素D N端片段(GSDMD-N)表达的影响Figure 8 Effect of Qingfei Tongluo Prescription on the expression of pro-Caspase-1,Caspase-1,GSDMD and GSDMD-N in BEAS-2B cells transfected with overexpressed Caspase-1 plasmids
2.2.4 清肺通络方对过表达Caspase-1质粒转染BEAS-2B细胞的炎症因子IL-1β、IL-18含量的影响 图9结果显示:与空白质粒组比较,过表达质粒组细胞上清液中IL-1β和IL-18含量显著升高(P<0.001);与过表达质粒组比较,清肺通络方2组细胞上清液中IL-1β、IL-18含量显著降低(P<0.01或P<0.001)。
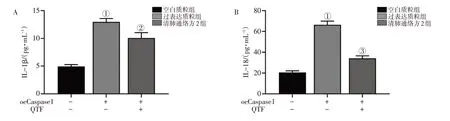
图9 清肺通络方(QTF)对过表达Caspase-1质粒转染BEAS-2B细胞的炎症因子白细胞介素(IL)-1β、IL-18含量的影响Figure 9 Effect of Qingfei Tongluo Prescription on the content of inflammatory factors IL-1βand IL-18 in BEAS-2B cells transfected with overexpressed Caspase-1 plasmids
2.2.5 清肺通络方对过表达Caspase-1质粒转染BEAS-2B细胞焦亡的影响 图10结果显示:与空白质粒组比较,过表达质粒组细胞焦亡率显著上升(P<0.001);与过表达质粒组比较,清肺通络方2组细胞焦亡率显著下降(P<0.001)。
2.2.6 清肺通络方对过表达Caspase-1质粒转染BEAS-2B细胞LDH、Na+-K+-ATP酶活性的影响图11结果显示:与空白质粒组比较,过表达质粒组LDH活性显著上升(P<0.001),Na+-K+-ATP酶活性显著下降(P<0.001);与过表达质粒组比较,清肺通络方2组LDH活性显著下降(P<0.001),Na+-K+-ATP酶活性明显上升(P<0.01)。

图11 清肺通络方(QTF)对过表达Caspase-1质粒转染BEAS-2B细胞乳酸脱氢酶(LDH)、Na+-K+-ATP酶活性的影响Figure 11 Effect of Qingfei Tongluo Prescription on LDH and Na+-K+-ATPase activities in BEAS-2B cells transfected with overexpressed Caspase-1 plasmids
3 讨论
肺炎支原体(MP)可引起上、下呼吸道感染,在世界范围内具有地方性和流行性[7],是目前儿童社区获得性肺炎最常见的病原体之一,且感染率呈明显上升趋势[8]。肺炎支原体肺炎(MPP)患儿可达儿童社区获得性肺炎住院病例的40%[9-10]。MP因其具有季节性、流行性和传染性的特点,且MPP的发病特征符合温邪致病的特点,故可从“温病”论治。叶天士云“温邪上受,首先犯肺”,小儿形气未充,肺脏娇嫩,易感外邪,MP自口鼻循气道直侵肺络,痹阻气络则气滞痰凝,痹阻血络则营血瘀阻,痰瘀互结痹阻肺络,终使肺失宣肃而发病[11]。因此,我们提出MPP“肺络痹阻”的中医病机。清肺通络方以“肺络”为理论依据,结合临床实践,用于治疗儿童MPP,该方以泻白散(桑白皮、地骨皮)为基础,贯穿化痰通络(虎杖、紫苏子、葶苈子)与祛瘀通络(桃仁、地龙、半枝莲)并行的理念,从而恢复肺络气血运行,通达肺络,恢复肺脏之宣发肃降的功能。方中:桑白皮泻肺平喘,利水消肿,可降气散血,地骨皮凉血除蒸,清肺降火,二者共为君药;虎杖化痰止咳、活血利湿,桃仁化痰止咳、活血润肠,地龙清热、平喘、通络、利尿,三药合用,既能化痰通络,又可助君药降气平喘,故共为臣药;半枝莲清热解毒、化瘀利尿,紫苏子降气消痰,葶苈子泻肺平喘、利水消肿,共为佐药;甘草祛痰止咳,调和诸药,而为使药。全方相合,共奏清热化痰、祛瘀通络之效,使肺络通畅、宣降有章、气血复常,则病邪得去。
本项目组前期临床研究发现,清肺通络方治疗MPP的疗效明显,临床总有效率达94.67%,显著优于单纯西药治疗[12],可有效缩短退热时间、改善肺部症状和体征,缩短病程,减少抗生素的使用[13]。
MPP的发病机制,目前尚不完全清楚,主要包括细胞粘附、组织损伤、免疫损伤、细胞凋亡等方面。近期相关实验表明,MP感染与细胞焦亡之间关系密切[4]。另有研究发现,炎症与细胞焦亡之间也存在一定联系[14]。细胞焦亡是一种由炎症小体引起的细胞程序性裂解死亡方式,可以用来检测细胞受到的感染或干扰情况[15],当机体受到外界的细菌、病毒或其他病原体的侵袭后会刺激炎症小体启动细胞焦亡途径。细胞焦亡是机体重要的天然免疫反应,在拮抗感染和内源危险信号中发挥重要作用。相比细胞凋亡(apoptosis),细胞焦亡发生更快,并会伴随大量促炎症因子的释放[5]。细胞焦亡途径包括2种,分别是由Caspase-1介导的细胞焦亡经典途径和由Caspase-4/-5/-11、Caspase-3或Caspase-8介导的细胞焦亡非经典途径[16-18]。在经典途径中,细胞表面模式识别受体与内源性或外源性危险信号相互作用触发信号通路,诱导ASC的募集形成炎症小体,从而将pro-Caspase-1转化为有活性的Caspase-1。Caspase-1也称为白细胞介素转化酶,诱导IL-1β、IL-18成熟,从而切割GSDMD形成GSDMD-C和GSDMD-N。随后,GSDMD-N在细胞膜的内小叶上形成低聚物,并与磷脂酸和磷脂酰丝氨酸相互作用[20],导致GSDMD诱导的孔隙形成,IL-1β、IL-18分泌[5,18,20]。本研究结果显示,MP感染BEAS-2B细胞后Caspase-1、GSDMD-N表达升高,细胞焦亡率上升,提示MP感染激活Caspase-1介导的细胞焦亡经典途径,Caspase-1活化后,切割GSDMD,GSDMD结构的自抑性遭到破坏,使GSDMD-N表达升高。此外,MP感染BEAS-2B细胞后,细胞上清液中炎症因子表达上升,表明活化的Caspase-1使无活性的pro-IL-1β、pro-IL-18加工为有活性的形式进而分泌到细胞外,从而使两者表达上升。
LDH参与丙酮酸和乳酸应之间的转化,在细胞膜破裂后分泌,因此,被广泛应用于检测细胞焦亡的发生。Na+-K+-ATP酶广泛表达于各种组织和器官[21],是维持内环境稳定的基础[22]。本研究结果表明,MP感染引起细胞发生焦亡,细胞结构遭到破坏、内环境紊乱,导致LDH活性升高、Na+-K+-ATP酶活性下降。然而,单靠LDH活性改变不足以量化细胞焦亡,在其他类型的细胞死亡过程中LDH也会释放,比如细胞坏死和凋亡。因此,LDH活性的检测结果应与Caspase-1的检测结果结合起来进行综合分析[23]。
质粒常被用作基因的载体,可高效、稳定表达所携带的信息。本研究构建了过表达Caspase-1质粒转染模型,过表达质粒组检测结果显示,细胞中Caspase-1、GSDMD-N表达及细胞焦亡率均升高,细胞上清液中炎症因子的含量上升,LDH和Na+-K+-ATP酶的活性失调。与MP感染BEAS-2B细胞的结果相似,再次显示出Caspase-1在细胞焦亡过程中起着重要的调控作用[24-25]。
清肺通络方干预后,MP感染BEAS-2B细胞、过表达Caspase-1质粒转染BEAS-2B细胞焦亡情况得到明显改善,有效抑制了Caspase-1、GSDMD-N的表达,减少IL-1β、IL-18的释放,降低细胞焦亡率,恢复LDH、Na+-K+-ATP酶活性水平。以上结果提示,清肺通络方可以通过抑制Caspase-1有效调控细胞焦亡经典途径中相关因子在MP感染细胞模型及过表达Caspase-1质粒转染细胞模型中的表达。根据本实验结果,可考虑将清肺通络方作为Caspase-1抑制剂的替代药物用于临床治疗。
综上所述,MP可以激活Caspase-1介导的细胞焦亡,使得GSDMD-N表达升高、炎症因子释放、相关酶活性失调,而清肺通络方能够通过抑制Caspase-1的激活,缓解细胞焦亡进程,减轻炎症反应,发挥抗MPP作用。本研究结果可为清肺通络方治疗小儿MPP提供更多的实验依据,也可为治疗该疾病药物的开发提供新的思路和借鉴。
